2. 通用电气医疗公司 (中国), 北京 100176;
3. 福建医科大学附属第一医院核医学科, 福州 350005
2. GE Healthcare China, Beijing 100176, China;
3. Department of Nuclear Medicine, First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
成纤维细胞活化蛋白抑制剂(fibroblast activation protein inhibitor, FAPI)是一种特异性靶向成纤维细胞活化蛋白(fibroblast activation protein,FAP)的小分子[1-2]。自2018年起,以FAPI为基础开发的核素示踪剂开始用于多种肿瘤的成像和治疗[3-4]。FAPI-04是FAPIs的一个亚型,可以被68Ga标记用于正电子发射计算机断层显像(PET/CT)[2],具有本底信号低、肿瘤/本底比高、肿瘤边界清晰、稳定性高等特性。已有多篇文章报道了68Ga-FAPI-04在诊断与评估多种肿瘤及非肿瘤性疾病(如IgG4相关疾病)中具有较大的临床意义[5-10]。与18F-FDG相比,68Ga-FAPI-04在脑部及肝脏等腹腔脏器背景本底更低[8]。在肝胆肿瘤中,68Ga-FAPI-04较18F-FDG的病灶检出能力更高[11]。考虑到68Ga-FAPI-04有前景的临床前结果和初步临床数据,本研究设计前瞻性试验,用于评估68Ga-FAPI-04在肝胆肿瘤患者中的生物分布和内照射剂量,为68Ga-FAPI-04的临床应用推广提供参考。
资料与方法1. 研究对象:本研究所有环节均经过北京协和医院伦理委员会审查并获得许可(审批号:ZS-1810),所有受试者均签署知情同意书。6例因肝脏占位在北京协和医院就诊的患者,其中男性3例,女性3例,年龄(63.5 ± 8.7)岁(46~70岁),肝内单发病灶5例(其中1例有多发肝外病灶),肝内多发病灶1例。纳入标准:病理证实的肝脏恶性病变。排除标准:接受过肿瘤特异性治疗,如射频消融、动脉内灌注化疗、全身静脉化疗、放疗等;年龄 < 18岁;哺乳期或妊娠期;已知对68Ga或FAPI-04或68Ga-FAPI-04有过敏史;主要脏器及结构等不存在严重缺陷。
2. 68Ga-FAPI-04制备及质量控制:68Ga-FAPI-04采用手工法合成。用HCl(0.1 mol/L)淋洗68Ge/68Ga发生器(德国ITG公司),用醋酸-醋酸钠(HOAc-NaOAc)(1.25 mol/L)缓冲液调节淋洗液pH值为3.5~4.5,加入20 μg的FAPI-04(美国CSBio公司)混匀后,置于100℃恒温金属浴加热10 min。待反应液冷却后,通过C-18 Sep-Pak Light固相萃取柱,用无菌注射用水冲洗除去游离的68Ga离子、可能漏穿的68Ge离子和水溶性杂质,然后用1 ml体积分数75%乙醇洗脱,6.5 ml生理盐水冲洗并稀释,使乙醇含量 < 10%,过无菌滤膜(0.22 μm)注入无菌密封瓶中,得到注射液。产品比活度为7.6~16.8 GBq/μmol。使用radio-TLC(美国BioScan公司)进行质量控制,展开剂为醋酸铵(NH4Ac,1 mol/L)/甲醇(CH3OH)=50/50(%,V/V)。68Ga-FAPI-04的Rf值为0.76,放化纯>99%。
3. PET/CT采集:使用赛诺联合医疗科技(北京)有限公司PoleStar m660型PET/CT,有56个硅酸铱镥(LYSO)晶体环,具有飞行时间(TOF)功能,配备64层螺旋CT。患者无需特殊准备,平卧于检查床上,首先采集全身低剂量CT(120 kV,100 mAs,层厚2.5 mm,旋转时间0.5 s,螺距1.0)用于图像定位及衰减校正;随后患者保持体位不变,经床旁肘静脉注射68Ga-FAPI-04(170.57± 14.43)MBq后,第3、10、15、20、30、60 min分别采集包含脑、心脏、肝脏、脾脏、胃、肾脏、肠道等全身主要脏器的PET图像(5个检查床位,60 s/检查床位)。图像采用OSEM + TOF重建算法(2次迭代,10子集,高斯滤波)。
4. 图像分析:使用MIM图像软件(美国MIM Software Inc公司)分析图像。在所有时间点评估以下组织和器官的生理性摄取,包括脑、肺、心血池、肝、肾(肾实质)、子宫和肌肉(臀大肌)。由1名有经验的核医学医师手动勾画感兴趣区(region of interest,ROI)并除外病变部位,记录最大标准化摄取值(standardized uptake value maximum,SUVmax)。对于双侧器官,如肺、肾和肌肉,计算双侧的平均SUVmax。
同时,测量肿瘤病灶SUVmax,每例患者最多选择4个病灶,包括2个肝内病灶和2个肝外病灶。计算肿瘤病灶与正常肝实质的靶-本底比值(target-to-background ratio,TBR)。
5. 内照射剂量估算:选择下列组织或脏器做为源器官(source organs),包括肝、胰腺、第1~5腰椎、肾、子宫和膀胱。由同一位有10年工作经验的研究人员在CT图像上分别沿肝、胰腺、第1~5腰椎和肾的边界手动勾画ROI,再将其复制到PET图像中。由于子宫和膀胱的体积和位置会随显像时间延长发生变化,对于二者的ROI勾画采用在PET图像上逐层勾画的方法。在各时间点,未经时间衰减校正的源器官的放射性分布使用百分注射剂量(percentage of injected dosage,%ID)表示,并用单指数曲线拟合,得到源器官的时间-放射性曲线(time activity curve,TAC)。
用三分法计算曲线下面积,得到滞留时间(residence time):从0到第1个时间点假设源器官的放射性活度呈线性增长,从第一时间点到最后一时间点采用梯形积分法[12],从最后一个时间点到无穷大时间采用前述拟合的单指数函数进行外推。骨髓滞留时间采用基于第1~5腰椎的图像分析方法计算,假设第1~5腰椎占全身骨髓的12.3%[13]。膀胱的滞留时间使用OLINDA/EXM软件(version 1.0)的膀胱排空模型(voiding bladder model)计算,排空时间设置为1 h。全身剩余(remainder of the body)滞留时间的计算用最大可能滞留时间(仅基于物理衰变)减其他所有源器官的滞留时间之和。所有靶器官的吸收剂量(absorbed dose,mGy/MBq)及全身有效剂量(effective dose,mSv/MBq)使用OLINDA/EXM软件的成年男性模型计算。
6. 统计学处理:数据采用SPSS 26.0软件进行处理。正态分布的连续变量表示为x±s。男性患者与女性患者各器官吸收剂量的比较采用Student′s t检验。
结果1. 生物分布和图像特征:分别以其中1例男性患者和1例女性患者不同时间点全身最大密度投影(maximum-intensity-projection,MIP)为例,由图 1可见,静脉注射68Ga-FAPI-04后,放射性示踪剂经大血管迅速分布至各器官,脑内未见明显放射性浓聚,表明该示踪剂无法通过血脑屏障。双肾实质内示踪剂从肾盂逐渐排入膀胱,提示该示踪剂主要经过泌尿系统排泄。
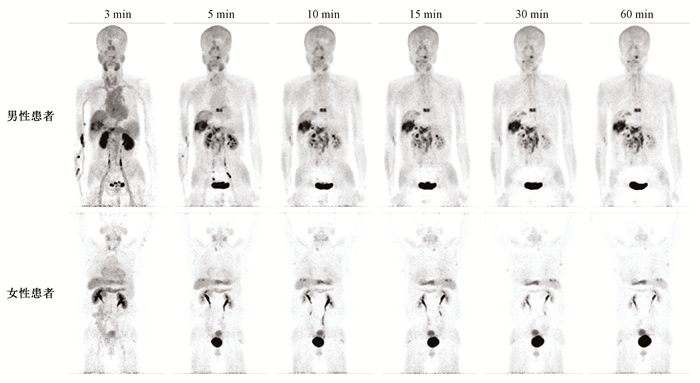
|
图 1 2例肝癌患者注射68Ga-FAPI-04后不同时间点全身最大密度投影图 Figure 1 Whole body MIP images at different time points in 2 patients with liver cancer after 68Ga-FAPI-04 injection |
肝脏表现为轻-中度放射性浓聚,且随时间延长,肝内放射性本底迅速退去,注射后30 min,肝内放射性已接近本底水平。女性患者子宫放射性摄取较高,注射后20 min,子宫平均SUVmax达到最大,为12.15±2.38,随时间延长放射性洗脱缓慢,至注射后60 min,平均SUVmax仍可达到11.27±2.62。不同时间点全身各正常组织器官平均SUVmax如图 2所示。
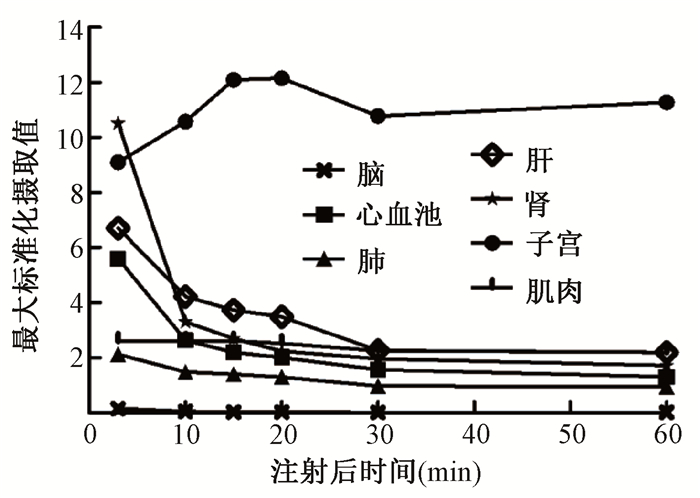
|
图 2 注射68Ga-FAPI-04后不同时间点全身各正常组织器官平均最大标准化摄取值 Figure 2 Mean SUVmax of all normal tissues and organs at different time points after injection of 68Ga-FAPI-04 |
对6例患者9个肿瘤病灶的SUVmax进行分析(包括7个肝内病灶和2个肝外病灶),对于68Ga-FAPI-04,肿瘤组织放射性摄取较为稳定,注射后20 min,病灶平均SUVmax达到最大,为13.87±2.55。随时间延长病灶平均TBR逐渐升高(图 3),注射后30 min,平均TBR达到最大,为10.09±8.17。
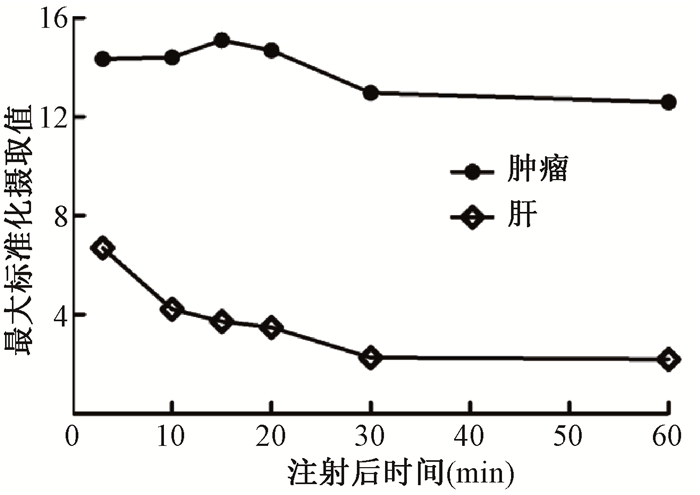
|
图 3 注射68Ga-FAPI-04后不同时间点肿瘤病灶与正常肝脏组织的平均最大标准化摄取值 Figure 3 Mean SUVmax of tumor lesions and normal liver tissue at different time points after injection of68Ga-FAPI-04 |
2. 内照射剂量:各靶器官的吸收剂量见表 1。吸收剂量最高的器官是膀胱壁,为(0.146 ± 0.035)mGy/MBq。全身有效剂量为(0.020 ± 0.002)mSv/MBq。女性患者子宫吸收剂量(0.034±0.007)mGy/MBq显著高于男性患者(0.017±0.001)mGy/MBq(t=-4.274,P=0.013),其余各靶器官差异均无统计学意义(P > 0.05)。
|
|
表 1 6例患者注射68Ga-FAPI-04后各靶器官的吸收剂量(mGy/MBq) Table 1 Absorbed doses of each target organ after injection of 68Ga-FAPI-04 of 6 patients (mGy/MBq) |
讨论
FAP在CAF中的高表达与肝胆肿瘤患者的预后水平呈现负相关[14]。在前期的临床结果中,发现68Ga-FAPI-04在不同分化程度的肝胆肿瘤成像中,均呈现较高的诊断精度与灵敏度[11]。本实验深入讨论了68Ga-FAPI-04在肝胆肿瘤患者体内的代谢特性及在各个器官中的生物分布,发现68Ga-FAPI-04在肝胆肿瘤患者中表现出良好的生物分布特征与剂量学特征。
本研究发现,68Ga-FAPI-04在女性患者子宫内有较高的放射性浓聚,且不随时间延长降低。注射放射性药物后5 min肿瘤病灶摄取迅速升高,并持续升高至注射后20 min,至注射后60 min,病灶内仍有较高放射性摄取。这一非肿瘤特异性摄取也在其他报道中出现[15]。这可能是由于子宫内膜具有较高的成纤维细胞活性[16],随着FAPI-04采集病例的增加,有经验的医生可以区分出这种正常组织的摄取和肿瘤摄取的区别。3例女性病例的平均年龄为68.7岁,均为绝经期女性,受入组条件的限制,本研究中并未纳入生育期女性病例。
另外,在注射10 min后,68Ga-FAPI-04在正常组织中摄取大幅下降。而肿瘤摄取迅速,SUVmax均超过12,这就可以保证早期显像的质量,即可以在注射后10~30 min对患者进行成像,从而实现更短的等待时间以及更加流畅的工作流程。除此之外,无需限制饮食等优势使得68Ga-FAPI-04比18F-FDG具有简单快速的操作条件。
同国外其他文献[10]相比,虽然各脏器的SUVmax在注射后1 h呈现更高的摄取值(国外文献普遍报道1.5~1.7),但脏器/肌肉数值接近。这说明68Ga-FAPI-04在国内外呈现为一致的分布情况,可能会由于药物制备、ROI勾画、重建算法的不同造成SUVmax计算的差异。
与欧洲课题组发表的辐射剂量研究[17]进行对比,本课题组进行成像测算的时间点更为集中。由于68Ga-FAPI-04主要在注射后1 h进行体内循环及代谢,后续的时间点各脏器摄取基本保持一致。所以在时间点的选择上进行了3、10、15、20、30、60 min的成像(前者为12、60、120 min),以保证更加准确的测定各脏器的剂量。鉴于成像间隔的缩短,本研究缩减了成像范围,仅包含脑、心脏、肝脏、脾脏、胃、肾脏、肠道等全身主要脏器,双侧下肢及部分病例的双侧上肢不在PET/CT扫描野内,所以使用最大可能滞留时间(仅基于物理衰变)而不是通过勾画全身感兴越区(ROI)来定义全身滞留时间。通过对比,发现在本研究中,心脏的辐射剂量(0.013 mSv/MBq)要明显低于前文报道(0.020 mSv/MBq),而在子宫、膀胱壁等部分则明显增加[17]。分析这正是由于时间点相对密集所形成的更贴近真实的辐射剂量趋势。本研究得到的全身有效剂量为(0.020±0.002)mSv/MBq,稍高于欧洲报道中的数值0.016 mSv/MBq,基本与现有的临床应用较为成熟的分子探针如18F-FDG(0.019 mSv/MBq)、18F-FDOPA(0.025 mSv/MBq)、18F-choline(0.020 mSv/MBq)[18]和68Ga-PSMA-617(0.021 mSv/MBq)[19]相近。假设患者注射68Ga-FAPI-04 185 MBq,全身有效剂量约3.7 mSv。同时,由于示踪剂主要经泌尿系统排出,通过鼓励患者适当增加排泄次数可进一步降低辐射剂量。
18F-FDG在肝细胞肝癌和胆管癌中表现一般,其灵敏度为50%~70%,与传统MR成像相当[20-21]。因为高分化肝细胞肝癌与正常肝脏细胞具有相同的糖代谢活性[22],同时胆管癌却表现出差别较大的FDG摄取[23],为诊断带来了极大挑战。而FAPI-04在肝脏区域的摄取非常低,前期研究显示68Ga-FAPI-04在肝胆肿瘤中呈现中等摄取,可以更好地呈现出肿瘤的边界[13],不仅增加了诊断精度,也为后续治疗手段的开展提供了更加准确的体积信息。68Ga-FAPI-04在一些肝胆肿瘤中也会出现一些假阳性的病例,主要出现在一些炎症囊肿、纤维化以及硬化组织中[8]。随着PET/CT的不断更新,更高的单位灵敏度也会使68Ga-FAPI-04在小体积转移灶的诊断效能方面进一步提高。多项研究显示,68Ga-FAPI-04可能在多种肿瘤的良恶性鉴别[24]、转移势能[25]、放疗靶区勾画[12]方面呈现出优势,后续也会在多方面对68Ga-FAPI-04在肝胆肿瘤成像优势进行系统研究。
利益冲突 无
志谢 感谢中国医学科学院医学与健康科技创新工程重大协同创新项目(2018-I2M-3-001)对本研究的资助
作者贡献声明 邢海群负责实验设计、实验总体实施及论文撰写;朱文佳、董诚岩负责实验数据整理及分析;王静楠、石希敏、吴美其负责实验执行;要少波参与论文的修改;李方、霍力负责实验指导和论文审核
| [1] |
Loktev A, Lindner T, Mier W, et al. A tumor-imaging method targeting cancer-associated fibroblasts[J]. J Nucl Med, 2018, 59(9): 1423-1429. DOI:10.2967/jnumed.118.210435 |
| [2] |
Lindner T, Loktev A, Altmann A, et al. Development of quinoline-based theranostic ligands for the targeting of fibroblast activation protein[J]. J Nucl Med, 2018, 59(9): 1415-1422. DOI:10.2967/jnumed.118.210443 |
| [3] |
Jansen K, Heirbaut L, Verkerk R, et al. Extended structure-activity relationship and pharmacokinetic investigation of (4-quinolinoyl)glycyl-2-cyanopyrrolidine inhibitors of fibroblast activation protein (FAP)[J]. J Med Chem, 2014, 57(7): 3053-3074. DOI:10.1021/jm500031w |
| [4] |
Watabe T, Liu Y, Kaneda-nakashima K, et al. Theranostics targeting fibroblast activation protein in the tumor stroma: 64Cu- and 225Ac-labeled FAPI-04 in pancreatic cancer xenograft mouse models[J]. J Nucl Med, 2020, 61(4): 563-569. DOI:10.2967/jnumed.119.233122 |
| [5] |
Röhrich M, Loktev A, Wefers AK, et al. IDH-wildtype glioblastomas and grade Ⅲ/IV IDH-mutant gliomas show elevated tracer uptake in fibroblast activation protein-specific PET/CT[J]. Eur J Nucl Med Mol Imaging, 2019, 46(12): 2569-2580. DOI:10.1007/s00259-019-04444-y |
| [6] |
Koerber SA, Staudinger F, Kratochwil C, et al. The role of FAPI-PET/CT for patients with malignancies of the lower gastrointestinal tract - first clinical experience[J]. J Nucl Med, 2020, 61(9): 1331-1336. DOI:10.2967/jnumed.119.237016 |
| [7] |
Luo Y, Pan Q, Yang H, et al. Fibroblast activation protein targeted PET/CT with 68Ga-FAPI for imaging IgG4-related disease: comparison to 18F-FDG PET/CT[J]. J Nucl Med, 2020, 62(2): jnumed.120.244723. DOI:10.2967/jnumed.120.244723 |
| [8] |
Chen H, Pang Y, Wu J, et al. Comparison of 68Ga Ga-DOTA-FAPI-04 and 18F FDG PET/CT for the diagnosis of primary and metastatic lesions in patients with various types of cancer[J]. Eur J Nucl Med Mol Imaging, 2020, 47(8): 1820-1832. DOI:10.1007/s00259-020-04769-z |
| [9] |
Giesel FL, Heussel CP, Lindner T, et al. FAPI-PET/CT improves staging in a lung cancer patient with cerebral metastasis[J]. Eur J Nucl Med Mol Imaging, 2019, 46(8): 1754-1755. DOI:10.1007/s00259-019-04346-z |
| [10] |
Syed M, Flechsig P, Liermann J, et al. Fibroblast activation protein inhibitor (FAPI) PET for diagnostics and advanced targeted radiotherapy in head and neck cancers[J]. Eur J Nucl Med Mol Imaging, 2020, 47(12): 2836-2845. DOI:10.1007/s00259-020-04859-y |
| [11] |
Shi X, Xing H, Yang X, et al. Fibroblast imaging of hepatic carcinoma with 68Ga-FAPI-04 PET/CT: a pilot study in patients with suspected hepatic nodules[J]. Eur J Nucl Med Mol Imaging, 2020. DOI:10.1007/s00259-020-04882-z |
| [12] |
Zhu W, Yao S, Xing H, et al. Biodistribution and radiation dosimetry of the enterobacteriaceae-specific imaging probe 18F fluorodeoxysorbitol determined by PET/CT in healthy human volunteers[J]. Mol Imaging Biol, 2016, 18(5): 782-787. DOI:10.1007/s11307-016-0946-9 |
| [13] |
Valentin J. Basic anatomical and physiological data for use in radiological protection: reference values[J]. Ann ICRP, 2002, 32(3-4): 1-277. DOI:10.1016/S0146-6453(03)00002-2 |
| [14] |
Zou B, Liu X, Zhang B, et al. The expression of FAP in hepatocellular carcinoma cells is induced by hypoxia and correlates with poor clinical outcomes[J]. J Cancer, 2018, 9(18): 3278-3286. DOI:10.7150/jca.25775 |
| [15] |
Kratochwil C, Flechsig P, Lindner T, et al. 68Ga-FAPI PET/CT: Tracer uptake in 28 different kinds of cancer[J]. J Nucl Med, 2019, 60(6): 801-805. DOI:10.2967/jnumed.119.227967 |
| [16] |
Calais J, Mona CE. Will FAPI PET/CT replace FDG PET/CT in the next decade?-Point: an important diagnostic, phenotypic and biomarker role[J]. AJR Am J Roentgenol, 2020. DOI:10.2214/AJR.20.24302 |
| [17] |
Giesel FL, Kratochwil C, Lindner T, et al. 68Ga-FAPI PET/CT: Biodistribution and preliminary dosimetry estimate of 2 DOTA-containing FAP-targeting agents in patients with various cancers[J]. J Nucl Med, 2019, 60(3): 386-392. DOI:10.2967/jnumed.118.215913 |
| [18] |
Mattsson S, Johansson L, Leide Svegborn S, et al. Radiation dose to patients from radiopharmaceuticals: a compendium of current information related to frequently used substances[J]. Ann ICRP, 2015, 44(2 Suppl): 7-321. DOI:10.1177/0146645314558019 |
| [19] |
Pfob CH, Ziegler S, Graner FP, et al. Biodistribution and radiation dosimetry of 68Ga-PSMA HBED CC-a PSMA specific probe for PET imaging of prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2016, 43(11): 1962-1970. DOI:10.1007/s00259-016-3424-3 |
| [20] |
Khan MA, Combs CS, Brunt EM, et al. Positron emission tomography scanning in the evaluation of hepatocellular carcinoma[J]. J Hepatol, 2000, 32(5): 792-797. DOI:10.1016/s0168-8278(00)80248-2 |
| [21] |
Trojan J, Schroeder O, Raedle J, et al. Fluorine-18 FDG positron emission tomography for imaging of hepatocellular carcinoma[J]. Am J Gastroenterol, 1999, 94(11): 3314-3319. DOI:10.1111/j.1572-0241.1999.01544.x |
| [22] |
Almuhaideb A, Papathanasiou N, Bomanji J. 18F-FDG PET/CT imaging in oncology[J]. Ann Saudi Med, 2011, 31(1): 3-13. DOI:10.4103/0256-4947.75771 |
| [23] |
Paudyal B, Oriuchi N, Paudyal P, et al. Clinicopathological presentation of varying 18F-FDG uptake and expression of glucose transporter 1 and hexokinase Ⅱ in cases of hepatocellular carcinoma and cholangiocellular carcinoma[J]. Ann Nucl Med, 2008, 22(1): 83-86. DOI:10.1007/s12149-007-0076-1 |
| [24] |
Gascard P, Tlsty TD. Carcinoma-associated fibroblasts: orchestrating the composition of malignancy[J]. Genes Dev, 2016, 30(9): 1002-1019. DOI:10.1101/gad.279737.116 |
| [25] |
Henriksson ML, Edin S, Dahlin AM, et al. Colorectal cancer cells activate adjacent fibroblasts resulting in FGF1/FGFR3 signaling and increased invasion[J]. Am J Pathol, 2011, 178(3): 1387-1394. DOI:10.1016/j.ajpath.2010.12.008 |
 2021, Vol. 41
2021, Vol. 41


