随着调强放射治疗(intensity modulated radiotherapy,IMRT)技术的推广,同时联合化疗、靶向治疗等综合治疗手段的应用日益广泛,鼻咽癌患者局部控制率与整体生存率显著提高,不同分期之间生存率差异有逐渐减小的趋势,单纯TNM分期在调强放疗时代显示出了一定的局限性[1]。
列线图(Nomogram)是一种利用图像来计算的统计模型,能将复杂的统计预测模型进行精简,建立图形化的统计学预测模型,并以图形方式表示每个预测变量对结果的影响,最后针对患者的个体情况进行事件发生概率的精确估计,近年来被越来越多地应用于医学研究的各领域中。既往关于鼻咽癌的Nomogram研究多见于我国南方高发地区[2-3],而西北等非高发区鼻咽癌具有肿瘤体积大、血浆EB病毒DNA(EBA-DNA)拷贝高、病理类型世界卫生组织(WHO)Ⅱ型占比高等特点,直接将这些模型应用于新疆地区,其结果可能出现偏差。因此,本课题组认为有必要构建适用于本地区的预后模型,识别具有预后意义的相关因素,并将其与临床分期结合,建立动态Nomogram模型,为本地区鼻咽癌患者的诊疗提供更多参考意见。
资料与方法1. 一般临床资料:回顾性选取2010年7月至2017年6月在新疆医科大学附属肿瘤医院治疗的317例鼻咽癌患者,全组患者中位年龄47岁(11~84岁),中位原发肿瘤体积(GTVnx)为44.02 cm3 (0,239.86),中位转移性淋巴结体积(GTVnd)为5.84 cm3(0,250.72),中位EBV-DNA拷贝数为42.31/ml(0,90 600),其他临床资料见表 1。纳入标准:经确切病理证实的初治Ⅲ~ⅣA期局部晚期鼻咽癌患者;接受鼻咽及颈部调强放射治疗;能获取治疗前血浆标本及具有完整临床资料的患者;KPS评分≥80。排除标准:合并其他恶性肿瘤病史;存在自身免疫疾病病史、接受全身糖皮质激素或免疫抑制治疗等免疫受损情况。患者签署知情同意书,获取治疗前血液标本,用以检测血浆EBV-DNA拷贝量。所有患者均应用美国癌症联合委员会(AJCC)第8版分期系统分期。本研究经新疆医科大学附属肿瘤医院伦理委员会审批通过(审批号:K-201811)。
2. 肿瘤体积及血浆EBV-DNA拷贝数获取:研究所需的GTVnx及GTVnd数据由美国瓦里安放射治疗计划系统导出。所有的靶区图像首先由具有5年以上鼻咽癌放疗经验的放射肿瘤学医师勾画完成,然后由1~2名放射肿瘤学副主任医师和/或主任医师进行确认。在CT与MRI融合靶区图像上,GTVnx和GTVnd定义为可见原发肿瘤和转移性淋巴结。血浆EBV-DNA拷贝量,由EB病毒核酸定量检测试剂盒(PCR-荧光探针法)测定,试剂盒购自长沙圣湘生物科技有限公司。
3. 治疗方法:鼻咽及颈部放疗33次,单次剂量2.0~2.12 Gy,总剂量约66~69.96 Gy,其中PGTVnx 69.96 Gy,GTVnd 69.96 Gy,PTV1 60~66 Gy,PTV2 50~56 Gy。
同时根据美国国立综合癌症网络(NCCN)指南,Ⅲ~ⅣA期的局部晚期鼻咽癌患者行同步放化疗(CCRT)±诱导/辅助化疗。诱导化疗方案为TP方案化疗:多西他赛75 mg/m2第1天,顺铂75 mg/m2第1~3天,每21天为1个周期;同步化疗的方案具体为:顺铂30~40 mg/m2,1次/周,连续6~7周;或在放疗第1天开始,100 mg/m2,每21天为1个周期。本组患者行单纯调强放疗者90例(28.4%),同步放化疗者226例(71.3%),诱导化疗者284例(89.6%)。
4. 随访:随访时间从患者治疗第1天开始,全组病例以住院、门诊、信访或电话等方式随访,本研究随访截止时间为2020年6月30日。本研究以总生存(overall survival, OS)作为主要的研究终点,其定义为从治疗之日开始,到患者发生因为任何原因的死亡或随访终止的这段时间间隔(以较早的时间截点为准)。
5. 统计学处理:采用SPSS 25.0及R软件(version 4.0.3) 进行统计分析。计量资料不满足正态分布者采用非参数检验,计数资料采用卡方检验,等级资料采用秩和检验,生存率的计算采用K-M法估算,并采用时序检验(Log-rank)法检验。P<0.05为差异有统计学意义。
结果1. 一般临床资料:将本组患者按照3∶1的比例随机分配至训练队列和验证队列中,两个队列患者特征见表 1,队列间差异无统计学意义(P > 0.05)。中位随访时间为66.5个月,全组患者随访满1、3、5年者分别为99.7%(316/317)、77.9%(247/317)、41.3%(131/317)。本研究入组患者:T3~4期患者占比78.9%,N2~3期患者占比83.0%;中位GTVnx为44.02(0,239.86)cm3,均值为51.38 cm3;中位GTVnd为5.84(0,250.72)cm3,均值为17.48 cm3;中位EBV-DNA拷贝数为42.31(0,90 600)copies/ml,均值为989.86 copies/ml。病理类型以非角化性癌未分化型(WHO Ⅲ型)为主(56.2%),分化型(WHO Ⅱ型)次之(30.6%),不能明确其分化类型者记为其他(13.2%)。整体队列中3年总生存率79.1%、无复发生存率85.8%、无远处转移生存率79.6%;5年总生存率71.3%、无复发生存率81.0%、无远处转移生存率75.3%。
|
|
表 1 鼻咽癌患者临床资料 Table 1 Clinical characteristics of patients with nasopharyngeal carcinoma |
2. 局部晚期鼻咽癌患者的危险因素:根据LASSO回归计算的最小λ系数,从中筛选出了6个OS预后因素:T分期、N分期、乳酸脱氢酶(LDH)、GTVnx、GTVnd及EBV-DNA,将6个因素进行逐步法Cox回归多因素分析,建立Cox回归模型,多因素分析显示,T分期(χ2=6.966, P=0.008)、LDH(χ2=6.954, P=0.008)、GTVnd (χ2=12.450, P<0.001)及治疗前血浆EBV-DNA拷贝量(χ2=19.694, P<0.001)是局部晚期鼻咽癌患者OS的独立预后因素。
3. 构建列线图模型,绘制校准曲线:基于Cox回归筛选因素(T、N分期、LDH、GTVnd及EBV-DNA)的列线图模型可有效预测局部晚期鼻咽癌患者3年及5年OS,C-index为0.784 (95%CI:0.736~0.831,P<0.01)优于AJCC第8版TNM分期系统所构建的模型,C-index为0.670 (95%CI:0.610~0.730,P<0.01)。在验证队列中能得到相似的结果。校准曲线显示,本模型比基于TNM分期的模型在训练队列及验证队列中均有更好的一致性,见图 1。
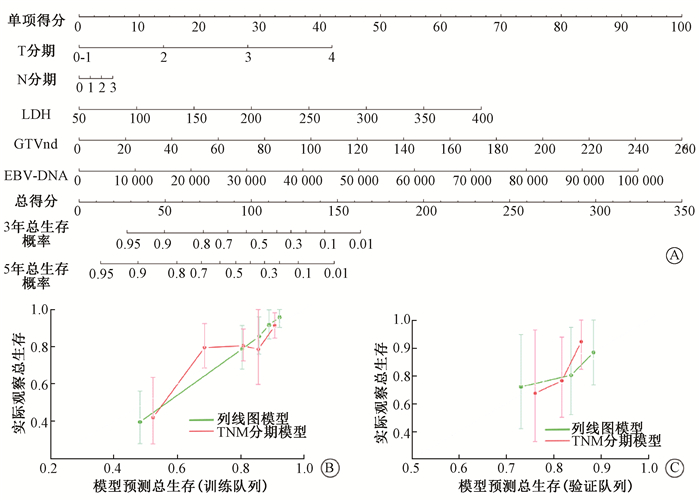
|
注:列线图模型:代表每个预测因子的线段,根据患者的不同取值,投影于顶部的单项得分线段,可得到每个患者的因素单项得分,将每个因子的得分相加即可得到总分,在总得分线段上定位总分并向下投影,即可得到每位患者由模型预测的3年及5年总生存概率。校准曲线示意图:横轴表示由模型预测所得生存,纵轴表示实际观察生存,当模型预测与实际观察一致时,表现为图中灰色对角线。代表不同模型的曲线,越接近对角线表明模型预测与实际观察越符合,其预测能力越好。LDH. 乳酸脱氢酶;EBV-DNA. 治疗前血浆EB病毒脱氧核糖核酸拷贝量;GTVnd. 转移性淋巴结体积 图 1 列线图模型与校准曲线A. 列线图模型; B~C. 校准曲线 Figure 1 Nomogram model and calibration curve A. Nomogram model; B-C. Calibration curve |
4.模型验证:相对于传统的AJCC第8版TNM分期系统,本模型在3年及5年的净重分类改善指数(NRI)与综合判别改善指数(IDI)值均明显增加;同时在本模型内,去除GTVnd或血浆EBV-DNA后模型的C-index值分别下降至0.707、0.777,且NRI与IDI均表现出下降趋势,见表 2。
|
|
表 2 列线图模型与TNM分期、去除GTVnd或EBV-DNA后的列线图模型准确性比较 Table 2 Comparison of accuracy between the nomogram model and TNM staging, and the nomogram model without GTVnd or EBV-DNA |
5.危险组分层:分别计算每位患者的Nomogram总得分,决策树算法计算患者的Nomogram得分风险分层最佳截断值为:52.06、78.34、97.86(χ2=78.370, P<0.01),为便于临床应用,取得50、80、100分作为截断值将患者分为低、中低、中高、高危4个风险组,3年总生存率为96.1%、82.5%、55.6%和36.7%;5年总生存率分别为94.8%、74.9%、48.1%和23.3%。绘制不同Nomogram得分风险组的生存函数曲线,并使用Log-rank法检验(图 2 A)。将Nomogram评分的中高风险组及高风险组合并为高风险队列,中低风险组及低风险组合并为低风险队列,单因素分析显示,高风险队列内患者同步放化疗前行诱导化疗者总生存高于未行诱导化疗者(图 2B),而低风险队列差异无统计学意义(P > 0.05)(图 2C)。
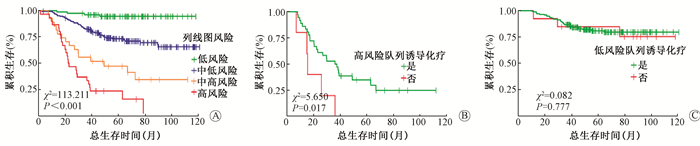
|
图 2 局部晚期鼻咽癌患者总生存曲线分析图A. 列线图模型风险分组总生存;B. 高风险患者总生存;C. 低风险患者总生存 Figure 2 Analysis of overall survival curveof patients with locally advanced NPC A. Overall survival of risk stratified by nomogram model; B. Overall survival of high-risk patients; C. Overall survival of low-risk patients |
讨论
TNM分期系统是对肿瘤大小、肿瘤浸润和淋巴结转移程度进行分层,是临床医生预测鼻咽癌患者预后最常用的工具,但它并不能为患者提供个性化的风险预测及精确地诊疗指导,由此在高发区发展出各种Nomogram预后模型,Liu等[2]在3 000例大样本研究中使用颈部淋巴结坏死情况、N分期、性别及EBV-DNA等因素构建了评估Ⅱ~ⅣA期鼻咽癌患者无进展生存的Nomogram模型(C-index 0.733),对患者预后评估有较好的作用,同时该研究使用多中心的数据作为外部验证,均显示出较好的一致性。Tang等[3]使用T期、N期、体质量指数(BMI)、血浆EBV-DNA、C-反应蛋白等因素构建了评估Ⅰ~ⅣB期鼻咽癌患者3年及5年无病生存的Nomogram模型,并将其与传统TNM分期进行比较,结果显示Nomogram具有优于传统分期的良好预测效果。
在大量Nomogram研究中,本课题组发现模型之间的比较大部分仅来源于C-index及校准曲线,这些参数只能显示模型预测效果与患者实际观察情况符合程度。本院收治的鼻咽癌与南方高发地区比较,表现出分期晚、肿瘤体积大、血浆EBV-DNA拷贝数高、病理类型WHOⅡ型占比较高等特点,这使得此前的各种模型在本地区直接使用可能会出现偏差[4]。因此本课题组采用易于获得的预测因素:TN分期、LDH、GTVnd、EBV-DNA构建了列线图模型,并采用C-index、校准曲线、NRI及IDI等多种指标与方法,从多个层面进行了全面综合的比较,各指标均显示相对于传统TNM分期,本模型能够更有效地对局部晚期鼻咽癌患者的预后做出评估。
血浆EBV-DNA和肿瘤体积是影响鼻咽癌患者预后的常见因素,被大量应用于预后评估中[4-5]。研究表明,高血浆EBV-DNA及GTVnd水平,与预后较差相关[6-7]。本研究得到类似结果:血浆EBV-DNA水平及GTVnd水平组是鼻咽癌患者总生存的独立危险因素。这可能是因为转移性淋巴结中的肿瘤细胞可以直接侵袭局部血管、种植远处器官,形成远处转移[8];也有研究认为EBV阳性鼻咽癌细胞外泌体较正常鼻咽上皮细胞明显促进淋巴管内皮细胞成管与迁移,也可促进鼻咽癌细胞淋巴结转移[9],由此说明GTVnd及血浆EBV-DNA水平从一定程度上反映了肿瘤血管生成能力及转移潜能[10],而远处转移已成为鼻咽癌患者治疗失败、影响生存的主要原因[11-12]。另有研究显示,加入血浆EBV-DNA后能够提高Nomogram模型准确预测的能力[13],在本研究中也得到类似结果:去除模型中血浆EBV-DNA或GTVnd后,模型的能效下降,这也进一步说明EBV-DNA及GTVnd与局部晚期鼻咽癌患者总生存密切相关。以上结果表明,血浆EBV-DNA及GTVnd在本地区的局部晚期鼻咽癌患者预后评估中有重要的作用,应考虑将其纳入预后评估体系中综合考量。
Nomogram不仅可用于预测患者预后,更希望它能为临床开展个体化随访、临床干预提供科学的依据,例如对于高风险的患者是否需要更密切的随访、更全面的辅助检查手段,以及为患者是否能从诱导化疗中得到更多获益提供参考意见。例如Sun等[14]研究显示,局部晚期鼻咽癌患者生存模型的预后指数可识别出高风险患者,并发现其在同步放化疗前接受诱导化疗可提高生存获益,这与本研究结果相似,也符合2021年中国临床肿瘤学会(CSCO)及美国临床肿瘤学会(ASCO)指南推荐:Ⅲ~ⅣA期(T3N0除外)的NPC患者高度建议诱导化疗联合同步放化疗[15]。同时在本研究中低风险队列内同步放化疗的患者未能观察到从诱导化疗中获益,值得关注。
利益冲突 无
志谢 感谢中国医学科学院中央级公益性科研院所基本科研业务费(2018PT31050)对本研究的资助
作者贡献声明 赵敏负责课题设计、数据分析和论文撰写;刘凯负责课题思路、论文修改的探讨;王若峥指导课题设计、论文写作和修改
| [1] |
Pan JJ, Ng WT, Zong JF, et al. Proposal for the 8th edition of the AJCC/UICC staging system for nasopharyngeal cancer in the era of intensity-modulated radiotherapy[J]. Cancer, 2016, 122(4): 546-558. DOI:10.1002/cncr.29795 |
| [2] |
Liu K, Lin S, Ke L, et al. Prognostic value and the potential role of treatment options for cervical lymph node necrosis in nasopharyngeal carcinoma[J]. Oral Oncol, 2020, 109: 104864. DOI:10.1016/j.oraloncology.2020.104864 |
| [3] |
Tang LQ, Li CF, Li J, et al. Establishment and validation of prognostic nomograms for endemic nasopharyngeal carcinoma[J]. J Natl Cancer Inst, 2015, 108(1): 10. DOI:10.1093/jnci/djv291 |
| [4] |
Chen FP, Lin L, Qi ZY, et al. Pretreatment nomograms for local and regional recurrence after radical radiation therapy for primary nasopharyngeal carcinoma[J]. J Cancer, 2017, 8(13): 2595-2603. DOI:10.7150/jca.20255 |
| [5] |
Chen FP, Huang XD, Lv JW, et al. Prognostic potential of liquid biopsy tracking in the posttreatment surveillance of patients with nonmetastatic nasopharyngeal carcinoma[J]. Cancer, 2020, 126(10): 2163-2173. DOI:10.1002/cncr.32770 |
| [6] |
Zhou X, Yang YQ, Ou XM, et al. Interplay of tumor spread, volume and Epstein-Barr virus DNA in nasopharyngeal carcinoma: feasibility of an integrative risk stratification scheme[J]. J Cancer, 2018, 9(22): 4271-4278. DOI:10.7150/jca.26777 |
| [7] |
Liu LT, Chen QY, Tang LQ, et al. Neoadjuvant or adjuvant chemotherapy plus concurrent CRT versus concurrent CRT alone in the treatment of nasopharyngeal carcinoma: a study based on EBV DNA[J]. J Natl Compr Canc Netw, 2019, 17(6): 703-710. DOI:10.6004/jnccn.2018.7270 |
| [8] |
Pereira ER, Kedrin D, Seano G, et al. Lymph node metastases can invade local blood vessels, exit the node, and colonize distant organs in mice[J]. Science, 2018, 359(6382): 1403-1407. DOI:10.1126/science.aal3622 |
| [9] |
陈星睿, 李登科, 黄仲曦, 等. EBV阳性人鼻咽癌细胞外泌体促进淋巴管新生与鼻咽癌淋巴结转移[J]. 南方医科大学学报, 2020, 40(12): 1776-1783. Chen XR, Li DK, Huang ZX, et al. Effect of exosomes derived from human Epstein-Barr virus-positive nasopharyngeal carcinoma cells on lymphangiogenesis and lymph node metastasis[J]. J South Med Univ, 2020, 40(12): 1776-1783. DOI:10.12122/j.issn.1673-4254.2020.12.12 |
| [10] |
Peng L, Yang Y, Guo R, et al. Relationship between pretreatment concentration of plasma Epstein-Barr virus DNA and tumor burden in nasopharyngeal carcinoma: An updated interpretation[J]. Cancer Med, 2018, 7(12): 5988-5998. DOI:10.1002/cam4.1858 |
| [11] |
许曼, 石梅, 臧健, 等. 中国西北非高发区鼻咽癌IMRT远期疗效和不良反应分析[J]. 中华放射肿瘤学杂志, 2020, 29(2): 81-87. Xu M, Shi M, Zang J, et al. Long-term efficacy and adverse reactions of intensity-modulated radiotherapy for patients with nasopharyngeal carcinoma in non-endemic northwest China[J]. Chin J Radiat Oncol, 2020, 29(2): 81-87. DOI:10.3760/cma.j.issn.1004-4221.2020.02.001 |
| [12] |
王冬青, 曹秀娟, 董伟, 等. 儿童及青少年鼻咽癌调强放射治疗联合化疗疗效分析[J]. 中华放射医学与防护杂志, 2017, 37(2): 125-131. Wang DQ, Cao XJ, Dong W, et al. Efficacy of intensity-modulated radiotherapy combined with chemotherapy for nasopharyngeal carcinoma in children and adolescents[J]. Chin J Radiol Med Prot, 2017, 37(2): 125-131. DOI:10.3760/cma.j.issn.0254-5098.2017.02.008 |
| [13] |
Li JP, Chen SL, Peng SG, et al. Prognostic nomogram for patients with nasopharyngeal carcinoma incorporating hematological biomarkers and clinical characteristics[J]. Int J Biol Sci, 2018, 14(5): 549-556. DOI:10.7150/ijbs.24374 |
| [14] |
Sun XS, Xiao BB, Lu ZJ, et al. Stratification of candidates for induction chemotherapy in stage nasopharyngeal carcinoma: a large cohort study based on a comprehensive prognostic model[J]. Front Oncol, 2020, 10: 255. DOI:10.3389/fonc.2020.00255 |
| [15] |
Chen YP, Ismaila N, MLK C, et al. Chemotherapy in combination with radiotherapy for definitive-intent treatment of stage Ⅱ-IVA nasopharyngeal carcinoma: CSCO and ASCO Guideline[J]. J Clin Oncol, 2021, 39(7): 840-859. DOI:10.1200/JCO.20.03237 |
 2021, Vol. 41
2021, Vol. 41


