2. 中国科学技术大学第一附属医院, 合肥 230000
2. Intelligent Pathology Institute, The First Affiliated Hospital of USTC, Hefei 230000, China
胶质瘤是最常见的颅内原发性肿瘤,占中枢神经系统恶性肿瘤的81%[1]。低级别胶质瘤的中位生存期为4.7~9.8年,高级别胶质瘤,以胶质母细胞瘤为例,中位生存期约15个月[2-3]。根据中国胶质瘤诊疗指南,目前建议对胶质瘤采用手术、术后放疗和化疗的综合治疗方式[4]。但是胶质瘤细胞对放射线抗拒导致疗效欠佳。因此,如何提高胶质瘤细胞的放射敏感性是目前研究的重点课题[5]。既往研究已经证明阿帕替尼能提高食管癌、肝癌等细胞的放射敏感性[6-7],但鲜有报道阿帕替尼对胶质瘤细胞放射敏感性的影响。本研究以阿帕替尼联合照射作用于脑胶质瘤细胞,初步探讨阿帕替尼对胶质瘤细胞U87MG的放射增敏作用及相关机制。
材料与方法1. 主要试剂及仪器:人脑胶质瘤细胞U87MG购自中国科学院上海细胞库。阿帕替尼(江苏恒瑞公司),用二甲基亚枫(DMSO)溶解至10 mmol/L。CCK-8试剂盒(日本同仁研究所),细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司),Matrigel基质胶(美国BD公司),兔抗人bax多克隆抗体(50599-2-Ig)、兔抗人bcl-2多克隆抗体(12789-1-AP)(武汉三鹰生物技术有限公司),胎牛血清(FBS)、DMEM高糖培养液、青霉素-链霉素(美国Biological公司)。
2. 细胞培养:将U87MG接种于含有10% FBS、1%青霉素-链霉素DMEM高糖培养基的培养瓶中,置于37℃、含5%CO2培养箱培养,定期传代,取对数生长期细胞进行实验。将胶质瘤细胞U87MG分为空白对照组、阿帕替尼组、单纯照射组、阿帕替尼联合照射组。采用6 MV X射线照射,照射野15 cm×15 cm,培养皿下方垫1 cm硅胶垫,机头旋转180°。X射线辐射装置(美国Varian CX型医用直线加速器),吸收剂量率600 cGy/min,源靶距(SSD)为100 cm。
3. CCK-8检测U87MG的增殖抑制作用:取对数生长期细胞,胰酶消化后,制备成单细胞悬液,以4×103/孔接种到96孔板内,过夜孵育后,加入含不同浓度的阿帕替尼(5、10、20、40、80 μmol/L) 培养液, 培养24、48和72 h,加入10 μl的CCK-8试剂,继续孵育2 h后,在酶标仪450 nm波长处,检测各孔的吸光度(A)值。细胞抑制率=[(A对照-A实验)/(A对照-A空白)]×100%。
4. 创伤愈合实验:将U87MG以4×105接种于6孔板,37℃、5%CO2培养箱过夜孵育至80%~90%,用200 μl的枪头尖端在板内中心区域十字划痕,用磷酸盐缓释液(PBS)清洗细胞后,拍照观察记录0 h细胞的伤口情况。空白对照组用无血清细胞培养液,观察6 h后阿帕替尼组、单纯照射组、照射联合阿帕替尼组伤口闭合情况。迁移率(%)=(划痕距离-生长后距离)/划痕距离。
5. 细胞侵袭实验:将基质胶(Matrigel胶)、小室、枪头提前4℃预冷,无血清培养基与Matrigel胶按照5 ∶1混合后,加入小室内部,恒温箱孵育1 h。取对数生长期的正常或者2 Gy照射后的U87MG细胞,胰酶消化吹打均匀,用无血清培养基或者含药物的无血清培养基制成单细胞悬液,调整细胞浓度为5×104/ml,上室加入200 μl的细胞悬液,下室加入600 μl的含20% FBS的完全培养液,将细胞孵育48 h后,4%多聚甲醛固定,0.1%结晶紫染色,PBS清洗后,显微镜下观察并计数。
6. 平板克隆形成实验:待细胞完全贴壁后,取对数生长期的U87MG细胞,胰酶消化吹打均匀,制成单细胞悬液,进行细胞分组,接种于6孔板内。分为空白对照组,10 μmol/L阿帕替尼,照射组(2、4、6、8 Gy),以及阿帕替尼联合照射组(阿帕替尼剂量为10 μmol/L)。用10 μmol/L阿帕替尼预处理24 h后,用新鲜培养基更换上清液,并用不同剂量(2~8 Gy)的X射线照射。照后10~ 12 d,将细胞用4%多聚甲醛固定20 min,然后在室温下用结晶紫染色10 min。计算每个培养皿中含有≥50个细胞的菌落。克隆形成率(PE,%)=克隆形成数/接种细胞数×100%,细胞存活分数(SF)=克隆形成数/(实验组细胞数×PE),放射增敏比(SER)=对照组D0/实验组D0。应用GraphPad Prism 7.0软件,以单击多靶模型,SF=1-(1-e-kD)N拟合细胞存活曲线,得出D0、Dq和SF2等放射生物学参数,计算放射增敏比(SERD0)。
7. Annexin V-FITC/PI染色法检测凋亡:用10 μmol/L阿帕替尼预处理24 h后,8 Gy照射,继续培养24 h,用不含EDTA的胰酶消化收集。用PBS洗涤2次,离心半径10 cm,2 000 r/min离心5 min,收集5×105细胞,加入500 μl的结合缓冲液(binding buffer)悬浮细胞,加入5 μl的膜联蛋白V-FITC(Annexin V-FITC)混匀后,加入5 μl的碘化丙啶(propidium iodide, PI)混匀。室温,避光反应15 min。流式细胞仪的观察和检测细胞凋亡情况。
8. Western blot检测相关蛋白表达:收集贴壁生长的U87MG细胞,加入含有苯甲基磺酰氟(PMSF)的RIPA裂解液,冰上裂解细胞。采用二喹啉甲酸(BCA)蛋白定量试剂盒测定蛋白浓度,各取20 μl蛋白样本进行凝胶电泳。通过电转印法将凝胶上的蛋白转移至聚偏二氟乙烯(PVDF)膜,转膜完毕后,用5%脱脂牛奶室温封闭1 h。加入兔一抗(Bcl-2,1 ∶2 000)以及内参蛋白(β-肌动蛋白,1 ∶3 000)在4℃孵育过夜,Tris-HCl缓冲盐溶液(TBST)洗膜,加入相应的抗兔IgG抗体(1 ∶10 000)室温下轻摇1 h。再次洗膜,配置发光工作液2 ml,成像仪显影。然后采用抗体剥离液,快速振荡10 min,TBST洗膜,重新用5%脱脂牛奶室温封闭1 h。加入兔一抗(Bax,1 ∶8 000)在4℃孵育过夜,TBST洗膜,加入相应的抗兔IgG抗体(1 ∶10 000)室温下轻摇1 h。再次洗膜,配置发光工作液2 ml,成像仪显影。
9. 统计学处理:采用SPSS 24.0软件进行数据分析。数据符合正态分布,用x±s表示,两组间比较采用独立样本t检验,多组差异比较经方差齐性检验采用单因素方差分析,细胞生存曲线和放射生物学参数用GraphPad Prism 7.0进行拟合。P < 0.05为差异有统计学意义。
结果1. 阿帕替尼对U87MG细胞的增殖抑制作用:结果示于表 1,CCK-8检测显示,不同浓度的阿帕替尼处理24、48和72 h,U87MG细胞的IC50分别为33.49、24.40和16.32 μmol/L,且随着药物浓度的增加,细胞毒性增加呈现出时间-剂量依赖性。为避免或尽量减少药物本身的细胞毒性作用,选用10 μmol/L阿帕替尼用于后续实验[8]。
|
|
表 1 不同浓度阿帕替尼处理后不同时间的U87MG细胞增殖抑制率(%,x±s) Table 1 Cell proliferation inhibition rate of different concentrations of apatinib with different time (%, x±s) |
2. 阿帕替尼联合照射对U87MG细胞增殖作用的影响:结果示于表 2,单纯照射组和阿帕替尼组的胶质瘤细胞存活率降低,且阿帕替尼联合照射处理对胶质瘤细胞存活率的下调作用更强(F= 310.182,P < 0.05)。阿帕替尼联合照射降低胶质瘤细胞增殖能力。
|
|
表 2 阿帕替尼联合照射作用U87MG细胞的存活率和迁移率(%,x±s) Table 2 Survival rate and migration rate of U87MG cells treated with apatinib combined with radiation (%, x±s) |
3. 创伤愈合实验:结果示于表 2。由表 2可见,U87MG胶质瘤细胞划痕6 h后,药物和照射对细胞迁移均有抑制作用。阿帕替尼联合照射组较其他组相比抑制作用更强,差异有统计学意义(t=33.263、10.795、18.704,P<0.05)。
4. 细胞侵袭实验:结果示于图 1。U87MG孵育48 h后,显微镜下观察细胞。药物和照射对U87MG细胞迁移均有抑制作用。与单纯照射组对比,阿帕替尼联合照射组明显抑制细胞侵袭,差异有统计学意义(t=4.197,P < 0.05)。
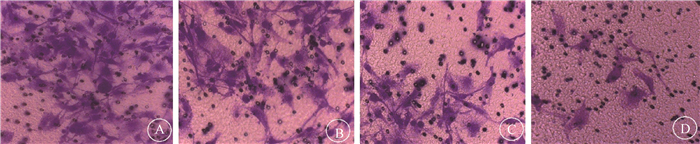
|
图 1 不同组别的U87MG胶质瘤细胞侵袭实验结晶紫染色×200 A.空白对照组;B.阿帕替尼组;C.单纯照射组;D.阿帕替尼联合照射组 Figure 1 Invasion of U87MG cells in different groups Crystal violet staining ×200 A. Control group; B. Apatinib group; C. Radiation group; D. Combination group treated with apatinib and radiation |
5. 克隆形成实验检测药物对细胞的放射增敏性的影响:根据单击多靶模型拟合细胞的存活曲线,与单纯照射组相比,阿帕替尼联合照射组曲线下移,且肩区也小于单纯照射组肩区,提示阿帕替尼可以提高U87MG细胞的放射敏感性,放射增敏比SERD0分别为1.3,提示阿帕替尼具有放射增敏作用(图 2,表 3)。

|
图 2 阿帕替尼对U87MG细胞放射增敏性的影响 Figure 2 The effect of apatinib on the radiosensitivity of U87MG cells |
|
|
表 3 U87MG细胞不同组别存活曲线的相关参数 Table 3 The main parameters of survival curves for different groups of U87MG cells |
6. 细胞凋亡实验:流式细胞分析结果示于图 3。U87MG胶质瘤细胞经阿帕替尼组、单纯照射组、阿帕替尼联合照射组的处理后24 h,凋亡率较空白对照组增加,差异有统计学意义(t=18.636、20.774、36.961,P < 0.05)。
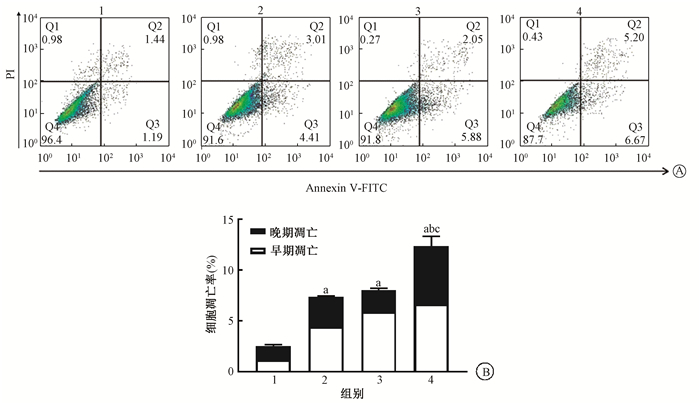
|
注:1.空白对照组;2.阿帕替尼组;3.单纯照射组;4.阿帕替尼联合照射组;a与空白对照组比较,t=18.636、20.774、36.961,P<0.05;b与阿帕替尼组比较,t=18.325,P<0.05;c与单纯照射组比较,t=16.187,P<0.05 图 3 U87MG细胞的流式细胞仪分析结果A. 流式细胞图;B. 流式细胞结果量化图 Figure 3 Flow cytometry analysis of U87MG cell apoptosis. A. The scatter diagram of the flow cytometry assay; B. Cell apoptosis rates in different groups |
7. 药物联合照射对U87MG细胞相关凋亡蛋白的影响:结果见图 4。与空白对照组相比,单纯照射组、阿帕替尼组、阿帕替尼联合照射的Bax蛋白表达均有所增加,Bcl-2蛋白表达均有所降低。与单纯照射相比,U87MG细胞的阿帕替尼联合照射的Bcl-2、Bax蛋白表达差异有统计学意义(t=8.890、5.222,P < 0.05)。
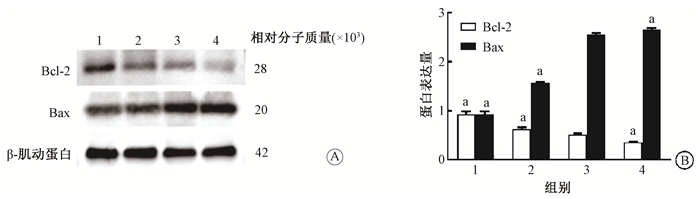
|
注:1.空白对照组;2.阿帕替尼组;3.单纯照射组;4.阿帕替尼联合照射组。Bcl-2、Bax 4组间比较,F=136.525、347.141,P<0.05;a与同一蛋白单纯照射组比较,tBcl-2=26.07、6.156、8.890,P<0.05;tBax=31.250、51.170、5.222,P < 0.05 图 4 Western blot检测U87MG细胞Bcl-2、Bax蛋白水平A.电泳条带;B. Bcl-2、Bax蛋白的相对表达量 Figure 4 Western blot assay of Bax and Bcl-2 proteins level in each group of U87MG cells A. Protein bands of Western blot assay; B. Relative expression levels of Bcl-2 and Bax proteins in U87MG cells |
讨论
脑胶质瘤是最常见的原发性颅内肿瘤,占原发性中枢神经系统肿瘤的32%。恶性胶质瘤的发病率5.8/10万,5年病死率仅次于胰腺癌和肺癌[9]。胶质瘤的治疗方式是以手术为主,结合放化疗等综合治疗。但对于胶质瘤,特别是胶质母细胞瘤,侵袭性强,预后差,复发率高,对放射治疗抵抗。因此,提高胶质瘤的放射敏感性极为重要。阿帕替尼是一种新型口服小分子酪氨酸激酶抑制剂,它高度选择性地抑制血管内皮生长因子受体2(VEGFR-2)的活性,阻断血管内皮生长因子与其受体结合后的信号转导通路,从而强烈抑制肿瘤血管生成,发挥其抗血管生成作用[10]。研究证明,阿帕替尼能够体外抑制食管癌、乳腺癌、肺癌等细胞的增殖,促进细胞的凋亡[11]。但阿帕替尼是否对肿瘤细胞有放射增敏作用及其相关机制的研究较少。本实验主要研究阿帕替尼对胶质瘤细胞放射敏感性的影响,并对机制初步探讨。细胞增殖抑制实验显示,随着阿帕替尼浓度增加,作用时间的延长,细胞的抑制率升高,提示阿帕替尼能够体外抑制胶质瘤细胞U87MG的增殖,且对细胞毒性呈时间-剂量依赖性。细胞创伤愈合实验和侵袭实验提示,阿帕替尼联合照射较其他组能明显抑制细胞的侵袭和迁移。
本研究显示,与单纯照射组相比,阿帕替尼联合照射组的D0、Dq和N值均明显降低,U87MG的放射增敏比为1.3。联合组的细胞存活曲线明显下移,肩区变窄,说明阿帕替尼可能抑制了细胞照射后的DNA损伤修复,从而增加其放射敏感性。凋亡实验结果显示经阿帕替尼处理过的胶质瘤细胞对射线更为敏感,U87MG细胞作用24 h后的阿帕替尼联合照射组的凋亡率高于单纯照射组和阿帕替尼组,证实阿帕替尼促进射线诱导的胶质瘤细胞的凋亡。
肿瘤细胞对射线的敏感性与放射诱导的凋亡有关[12]。辐射主要诱导内源凋亡途径,外源凋亡途径以及膜应激途径。内源凋亡途径主要是Bcl-2家族,它在细胞凋亡的调控中起着重要作用[13]。Bcl-2是Bcl-2家族的抗凋亡成员,主要位于线粒体的外层,其表达与肿瘤细胞的辐射敏感性有关。Bax是Bcl-2基因家族的促凋亡成员,可抑制Bcl-2蛋白的抗凋亡作用。在多种癌症中,抗凋亡Bcl-2的表达增加或促凋亡Bax的表达降低,提示肿瘤细胞对凋亡的抗性[14]。Bcl-2/Bax的比值是抑制细胞凋亡的关键因素。在肿瘤细胞中,Bcl-2/Bax比值参与放射敏感性的调节,其比例升高提示肿瘤对辅助放疗的抵抗力增强,可预测放疗反应。本研究发现,单纯照射组、阿帕替尼组、阿帕替尼联合照射组的抗凋亡蛋白Bcl-2表达较空白对照组降低,促凋亡蛋白Bax均较空白对照组明显增加,联合组的变化最为明显。说明单纯照射和药物均能调节蛋白表达,而两者联合作用最强。初步证实阿帕替尼增加胶质瘤细胞的放射敏感性的机制可能和调控凋亡蛋白Bcl-2和Bax表达相关。另外,是否与凋亡蛋白PRAP、Caspase-3、Caspase-9等表达相关有待于进一步实验证实。再之,肿瘤细胞放射敏感性与细胞周期有关,细胞处于不同的周期放射敏感性不同,其中G2、M期对射线最敏感,阿帕替尼作用于胶质瘤细胞是否影响了细胞周期的再分布从而增加U87MG细胞的放射敏感性有待于进一步研究。
总之,本实验证实阿帕替尼可增加胶质瘤细胞U87MG的放射敏感性,为胶质瘤患者提高放疗疗效提供了理论依据。但是,胶质瘤细胞的异质性存在差异,例如,已知的胶质瘤细胞系U87MG和U251生物学特性相差很大,特别是在细胞增殖、迁移和侵袭方面[15]。因此,也需要进一步研究证实阿帕替尼对U251细胞放射敏感性的影响,从而避免由于胶质瘤细胞的异质性带来的偏差。
利益冲突 无
作者贡献声明 李田源撰写论文;海龙、卢晓旭指导实验;赵鹏飞负责细胞照射;孙学明、黄蓉协助数据整理和分析;吴慧指导论文修改
| [1] |
Ostrom QT, Bauchet L, Davis FG, et al. The epidemiology of glioma in adults: a "state of the science" review[J]. Neuro Oncol, 2014, 16(7): 896-913. DOI:10.1093/neuonc/nou087 |
| [2] |
Kumthekar P, Raizer J, Singh S. Low-grade glioma[J]. Cancer Treat Res, 2015, 163: 75-87. DOI:10.1007/978-3-319-12048-5_5 |
| [3] |
Ameratunga M, Pavlakis N, Wheeler H, et al. Anti-angiogenic therapy for high-grade glioma[J]. Cochrane Database Syst Rev, 2018, 11: CD008218. DOI:10.1002/14651858.CD008218.pub4 |
| [4] |
国家卫生健康委员会医政医管局. 脑胶质瘤诊疗规范(2018年版)[J]. 中华神经外科杂志, 2019, 35(3): 217-239. Medical Administration, National Health Commission. Specification for diagnosis and treatment of glioma (2018 Edition)[J]. Chin J Neurosurg, 2019, 35(3): 217-239. DOI:10.3760/cma.j.issn.1001-2346.2019.03.001 |
| [5] |
钟佳伟, 牟福玲, 孙鹏飞. 胶质瘤放化疗敏感性的研究进展[J]. 中国肿瘤, 2020, 29(4): 299-303. Zhong JW, Mou FL, Sun PF. Research progress on sensitivity of glioma to chemoradiotherapy[J]. China Cancer, 2020, 29(4): 299-303. DOI:10.11735/j.issn.1004-0242.2020.04.A010 |
| [6] |
孙菲, 孙志强, 汪建林, 等. 阿帕替尼对食管癌Kyse-150细胞放射敏感性影响的实验研究[J]. 中华放射医学与防护杂志, 2017, 37(11): 805-809, 831. Sun F, Sun ZQ, Wang JL, et al. Radiosensitizing effect of apatinib on esophageal cancer cell line Kyse-150[J]. Chin J Radiol Med Prot, 2017, 37(11): 805-809, 831. DOI:10.3760/cma.j.issn.0254-5098.2017.11.001 |
| [7] |
Liao J, Jin H, Li S, et al. Apatinib potentiates irradiation effect via suppressing PI3K/AKT signaling pathway in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2019, 38(1): 454. DOI:10.1186/s13046-019-1419-1 |
| [8] |
Wang C, Jiang M, Hou H, et al. Apatinib suppresses cell growth and metastasis and promotes antitumor activity of temozolomide in glioma[J]. Oncol Lett, 2018, 16(5): 5607-5614. DOI:10.3892/ol.2018.9355 |
| [9] |
中国医师协会神经外科医师分会脑胶质瘤专业委员会. 胶质瘤多学科诊治(MDT)中国专家共识[J]. 中华神经外科杂志, 2018, 34(2): 113-118. Glioma Committee of Neurosurgeons Branch of Chinese Medical Association. Chinese experts' consensus on multidisciplinary diagnosis and treatment of glioma (MDT)[J]. Chin J Neurosurg, 2018, 34(2): 113-118. DOI:10.3760/cma.j.issn.1001-2346.2018.02.002 |
| [10] |
Scott LJ. Apatinib: a review in advanced gastric cancer and other advanced cancers[J]. Drugs, 2018, 78(7): 747-758. DOI:10.1007/s40265-018-0903-9 |
| [11] |
Gao Z, Shi M, Wang Y, et al. Apatinib enhanced anti-tumor activity of cisplatin on triple-negative breast cancer through inhibition of VEGFR-2[J]. Pathol Res Pract, 2019, 215(7): 152422. DOI:10.1016/j.prp.2019.04.014 |
| [12] |
Zhivotovsky B, Joseph B, Orrenius S. Tumor radiosensitivity and apoptosis[J]. Exp Cell Res, 1999, 248(1): 10-17. DOI:10.1006/excr.1999.4452 |
| [13] |
Streffer JR, Rimner A, Rieger J, et al. BCL-2 family proteins modulate radiosensitivity in human malignant glioma cells[J]. J Neurooncol, 2002, 56(1): 43-49. DOI:10.1023/a:1014448721327 |
| [14] |
Wang PG, Li YT, Pan Y, et al. Lower expression of Bax predicts poor clinical outcome in patients with glioma after curative resection and radiotherapy/chemotherapy[J]. J Neurooncol, 2019, 141(1): 71-81. DOI:10.1007/s11060-018-03031-9 |
| [15] |
Li H, Lei B, Xiang W, et al. Differences in protein expression between the U251 and U87 cell lines[J]. Turk Neurosurg, 2017, 27(6): 894-903. DOI:10.5137/1019-5149.JTN.17746-16.1 |
 2021, Vol. 41
2021, Vol. 41


