2. 上海大学生命科学学院 200444
2. College of Life Science, Shanghai University, Shanghai 200444, China
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种具有高度侵袭和转移特性的乳腺癌亚型,预后较差[1]。放射治疗是TNBC保乳手术治疗后的重要综合治疗手段之一[2],能有效提高患者的无瘤生存率[3-4]。然而,仍有10%的TNBC患者出现局部复发转移[5],放射抵抗是其放疗疗效欠佳的重要原因[6]。因此,寻找安全高效的放射增敏剂已成为目前研究的热点问题。近年来,许多实验研究表明,纳米材料类放射增敏剂对实体肿瘤具有较好的放射增敏作用,显示出良好的应用前景[7]。本课题组前期体外实验证实,含高原子序数(Z)钽(Ta)元素、经聚乙烯吡咯烷酮(PVP)改性的碳化钽-PVP(Ta4C3-PVP)纳米片对人TNBC细胞具有明显的放射增敏作用[8]。本研究拟在动物水平上探究Ta4C3-PVP对TNBC 4T1荷瘤小鼠的放射增敏作用,为高Z金属元素纳米材料类肿瘤放射增敏剂的研发提供参考。
材料与方法1. 纳米材料、主要试剂和仪器:聚乙烯吡咯烷酮改性的碳化钽(Ta4C3-PVP)MXene纳米片按文献[8]方法制备。DMEM培养基购自美国Hyclone公司,胎牛血清、青-链霉素溶液及含乙二胺四乙酸(EDTA)的0.25%胰酶均购自美国GIBCO公司,苏木素和伊红染液购自武汉谷歌生物科技有限公司,鼠源Ki-67抗体购自美国Cell Signaling Technology公司,兔源γ-H2AX抗体购自美国Abcam公司,山羊抗鼠/兔IgG-HRP购自美国Proteintech公司,Alexa fluor 488驴抗兔IgG购自美国Invitrogen公司,4, 6-二脒基-2-苯基吲哚(DAPI)购自美国Sigma公司。X射线辐照装置(X-Rad 320型)购自美国Precision X-Ray公司,光学显微镜(Ts2-FL型)购自日本尼康公司,荧光显微镜(BX51型)购自日本Olympus公司。
2. 细胞与动物:小鼠三阴性乳腺癌4T1细胞购自中国科学院上海细胞库,用含10%胎牛血清和1%青-链霉素的DMEM培养液,于37℃、饱和湿度、5%CO2的培养箱中培养和传代。SPF级雌性BALB/c小鼠,体重18~20 g,购自上海杰思捷动物有限公司,实验动物生产许可证号为:SCXK(沪)2018-0004。饲养于SPF级净化小鼠独立送风隔离笼具笼盒内,环境温度为20~26℃,12 h/12 h昼夜明暗交替。
3. 荷瘤鼠模型的建立与实验分组:培养4T1细胞至对数生长期,经胰酶消化、磷酸盐缓冲液(PBS)洗涤及重悬,制成2×107/ml单细胞悬液。取100 μl细胞悬液注射于小鼠右侧腹皮下。自接种之日起,每日观察小鼠活动及肿瘤生长情况,当触及肿块后采用游标卡尺测量肿瘤长径(a)及与其垂直的短径(b),采用下式计算肿瘤体积:V= ab2/2。待移植瘤体积达到10 ~ 30 mm3时(检测γ-H2AX时移植瘤体积需达到80~100 mm3),按其体积大小将荷瘤小鼠均匀分成4组:空白对照组、单纯Ta4C3-PVP组、单纯照射组、Ta4C3-PVP联合照射组。以空白对照组小鼠移植瘤体积达约800 mm3,即皮下接种4T1细胞后20 d为各组荷瘤小鼠处死时间,以符合动物实验伦理要求。
4. 给药及照射方法:单纯Ta4C3-PVP组及Ta4C3-PVP联合照射组小鼠尾静脉注射20 mg/kg Ta4C3-PVP水溶液,空白对照组和单纯照射组小鼠尾静脉注射相同体积的生理盐水;24 h后,将单纯照射组和Ta4C3-PVP联合照射组小鼠固定于照射板上,用0.32 MV X射线辐照装置分别对肿瘤进行单次局部照射,剂量为8 Gy,剂量率为2 Gy/min,照射野为直径20 cm圆形,源皮距为50 cm,肿瘤以外区域用铅板防护。
5. 肿瘤生长情况与放射敏感性参数计算:各组荷瘤小鼠于照射后隔日测量肿瘤大小,并计算肿瘤体积,绘制肿瘤生长曲线。于照射后第16天(皮下接种4T1细胞后20 d)处死小鼠,解剖取出肿瘤组织,称重后于4%多聚甲醛固定,用于病理检查和免疫组织化学检测。
依据肿瘤体积计算肿瘤5倍倍增时间(TGT5)和增敏系数(enhancement factor, EF)。TGT5为肿瘤体积增长至照射前体积的5倍所需时间,EF=标准化肿瘤生长延缓时间(normalized growth delay, NGD)/绝对肿瘤生长延缓时间(absolute growth delay, AGD),其中,AGD=单纯照射组TGT5-空白对照组TGT5;NGD=Ta4C3-PVP联合照射组TGT5 -单纯Ta4C3-PVP组TGT5。EF>1表示具有放射增敏作用。依据肿瘤质量计算肿瘤生长抑制率即抑瘤率,抑瘤率(%)=(1-实验组平均瘤质量/对照组平均瘤质量)×100%。
6. 肿瘤组织病理学观察:肿瘤组织经石蜡包埋、切片、脱蜡、水化和苏木素-伊红染色(HE)后,于400倍视野下光镜观察肿瘤组织中细胞形态的改变。
7. 免疫组织化学检测肿瘤细胞增殖:将瘤组织石蜡切片充分脱蜡和水化后,置于100℃的2%柠檬酸钠溶液中加热20 min进行抗原修复,冷却至室温后用PBS清洗3次,室温下置于3% H2O2中孵育10 min,以消除内源性过氧化氢酶活性,再依次用去离子水、PBS和含Triton的磷酸盐缓冲液(PBST)清洗1次后,滴加驴血清室温封闭1 h,然后加入Ki-67一抗(1 ∶500)4℃孵育过夜。PBST清洗3次,滴加山羊抗鼠/兔IgG-HRP, 室温孵育1 h,PBST清洗3次,滴加1% 二氨基联苯胺(DAB)工作液显色约3 min,去离子水清洗3次,苏木素溶液染色2 min,再次用水清洗3次,PBS中反蓝5 min,再次用水清洗3次后脱水,中性树脂封片。在400倍视野下光镜观察并拍照,细胞核呈棕色者为Ki-67阳性细胞。计数至少20个视野内的阳性细胞数,换算成每个视野的平均阳性细胞数。
8. 免疫荧光组织化学检测肿瘤细胞γ-H2AX的形成:按上述方法对瘤组织石蜡切片进行脱蜡、水化、抗原修复和血清封闭,然后滴加γ-H2AX一抗(1 ∶500)4℃孵育过夜。PBST清洗3次,滴加Alexa fluor 488驴抗兔IgG(1 ∶500),室温避光孵育1 h,PBST清洗3次,滴加DAPI孵育5 min,PBS清洗2次,用含DAPI的封固剂封片,玻片保存于-20℃待检。采用荧光显微镜在1 000倍视野下观察并拍照,随机计数100个细胞核中含有的绿色焦点数,换算成每个细胞含有的焦点数。
9. 统计学处理:采用SPSS 17.0软件进行统计分析,经检验数据符合正态分布,用x±s表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD法检验。P < 0.05为差异有统计学意义。
结果1. Ta4C3-PVP对4T1荷瘤小鼠肿瘤体积和增敏作用的影响:由图 1可见,各组4T1荷瘤小鼠移植瘤的生长均随时间延长而体积增大,空白对照组和单纯Ta4C3-PVP组移植瘤体积增长幅度最大,两组间无明显差异;单纯照射组和Ta4C3-PVP联合照射组移植瘤体积于照射后16 d均明显小于空白对照组(t=5.41、9.59,P < 0.05),而Ta4C3-PVP联合照射组移植瘤体积又明显低于单纯照射组(t=3.82,P < 0.05)。根据肿瘤体积计算各组TGT5得出空白对照组、单纯Ta4C3-PVP组、单纯照射组和Ta4C3-PVP联合照射组分别为(3.55±1.17)、(3.90±1.52)、(5.31±1.55)和(6.67±1.52)d,可见Ta4C3-PVP联合照射组TGT5明显低于空白对照组(t=3.97,P < 0.05),NGD为2.77,ADG为1.76,其EF为1.57,表明Ta4C3-PVP对4T1移植瘤具有明显的放射增敏作用。
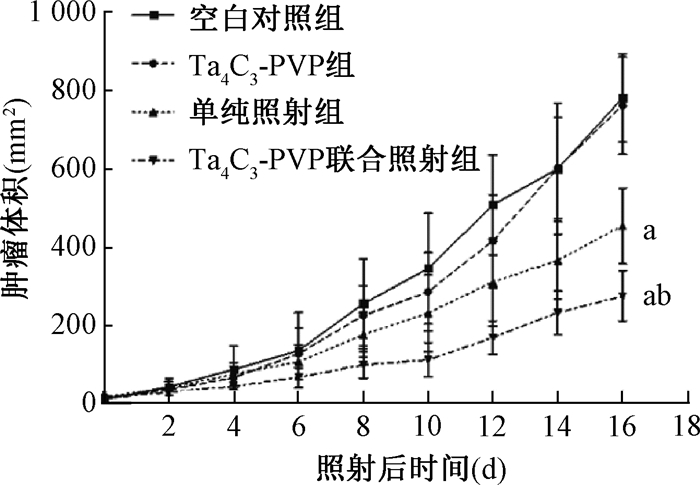
|
注:a与空白对照组相比,t=5.41、9.59,P < 0.05;b与单纯照射组相比,t= 3.82,P < 0.05 图 1 各组4T1荷瘤小鼠移植瘤生长曲线 Figure 1 The growth curves of xenograft tumor for each group of 4T1 tumor-bearing mice |
2. Ta4C3-PVP对受照4T1荷瘤小鼠移植瘤质量的影响和抑瘤作用:如表 1所示,空白对照组与单纯Ta4C3-PVP组的肿瘤质量差异无统计学意义(P > 0.05),而单纯照射组与Ta4C3-PVP联合照射组的肿瘤质量均较空白对照组明显下降(t=2.67、4.40,P < 0.05),其中Ta4C3-PVP联合照射组的瘤重又明显低于单纯照射组(t=4.16,P < 0.05)。以空白对照组为参照,Ta4C3-PVP联合照射组的抑瘤作用最强。
|
|
表 1 各组4T1荷瘤小鼠移植瘤质量及其抑瘤率(x±s) Table 1 The weight and inhibition rate of xenograft tumor for each 4T1 tumor-bearing mice group(x±s) |
3. Ta4C3-PVP对受照4T1荷瘤小鼠移植瘤组织病理形态的影响:如图 2所示,空白对照组及单纯Ta4C3-PVP组肿瘤组织经HE染色后光镜下观察可见肿瘤细胞密集排列,细胞边界清楚,细胞大小不一,核大深染。单纯照射组及Ta4C3-PVP联合照射组肿瘤组织中肿瘤细胞排列疏松,胞核固缩,亦可见细胞碎片增多,表明坏死增加,其中Ta4C3-PVP联合照射组的细胞坏死程度更甚于单纯照射组。
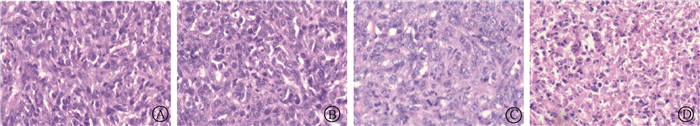
|
图 2 Ta4C3-PVP对受照4T1荷瘤小鼠移植瘤组织病理形态的影响HE染色×400 A.空白对照组;B.单纯Ta4C3-PVP组;C.单纯照射组;D.Ta4C3-PVP联合照射组 Figure 2 Effect of Ta4C3-PVP on the pathological feature of xenograft tumor tissue of the irradiated 4T1 xenograft tumor in mice HE staining ×400 A. Blank control group; B. Ta4C3-PVP group; C. IR group; D.Ta4C3-PVP plus IR group |
4. Ta4C3-PVP对受照4T1荷瘤小鼠移植瘤细胞增殖的影响:如图 3所示,细胞增殖核抗原Ki-67表达的肿瘤细胞数,空白对照组为每个视野314.63±35.38,单纯Ta4C3-PVP组为353.63±57.84,差异无统计学意义(P > 0.05),而单纯照射组和Ta4C3-PVP联合照射组Ki-67表达的肿瘤细胞数为每个视野195.20±15.26和122.37±21.77,比空白对照组明显降低(t=5.37、8.02,P < 0.05),Ta4C3-PVP联合照射组表达Ki-67的肿瘤细胞数又明显少于单纯照射组(t=4.75,P < 0.05),表明Ta4C3-PVP提高了辐射对4T1肿瘤细胞增殖的抑制作用。
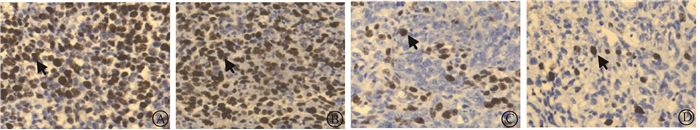
|
注:箭头指示为Ki-67阳性细胞 图 3 Ta4C3-PVP对受照4T1荷瘤小鼠移植瘤细胞增殖的影响免疫组织化学染色×400 A.空白对照组;B.单纯Ta4C3-PVP组;C.单纯照射组;D.Ta4C3-PVP联合照射组 Figure 3 Effect of Ta4C3-PVP on the cell proliferation of irradiated xenograft tumor in mice Immunohistochemical staining ×400 A.Blank control group; B.Ta4C3-PVP group; C.IR group; D.Ta4C3-PVP plus IR group |
5. Ta4C3-PVP对受照4T1荷瘤小鼠移植瘤细胞DNA双链断裂(double-strand breaks,DSBs)的影响:如图 4所示,与空白对照组相比,单纯Ta4C3-PVP处理对肿瘤细胞核内γ-H2AX焦点产额无明显影响(空白对照组:0.92±0.49/细胞,单纯Ta4C3-PVP组:1.00±0.43/细胞);单纯照射组与Ta4C3-PVP联合照射组于肿瘤局部8 Gy X射线照射后6 h,γ-H2AX焦点产额(2.64±0.87/细胞和5.35±0.61/细胞)较空白对照组显著增加,差异有统计学意义(t=2.97、9.86,P < 0.05),Ta4C3-PVP联合照射组于照射后6 h的γ-H2AX焦点产额则显著高于单纯照射组(t=4.42,P < 0.05),表明Ta4C3-PVP加重了辐射诱导的4T1肿瘤细胞的DNA DSBs。
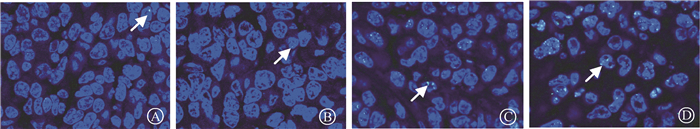
|
注:箭头指示为γ-H2AX焦点 图 4 Ta4C3-PVP对受照4T1荷瘤小鼠移植瘤细胞γ-H2AX焦点形成的影响免疫荧光组织化学染色×600 A.空白对照组;B.单纯Ta4C3-PVP组;C.单纯照射组;D.Ta4C3-PVP联合照射组 Figure 4 Effect of Ta4C3-PVP on the formation of γ-H2AX foci in the cells of irradiated xenograft tumor in mice Immunofluorescence histochemical staining ×600 A. Blank control group; B. Ta4C3-PVP group; C. IR group; D. Ta4C3-PVP plus IR group |
讨论
近年来,含高Z金属元素的纳米材料作为肿瘤放射增敏剂的研发已受到广泛关注[9],其优势在于高Z材料受到射线照射后发射出的光电子、康普顿电子和俄歇电子等次级电子进一步提高了肿瘤细胞的受照剂量,从而增强射线对肿瘤细胞的杀伤效应[10-11]。多种金属纳米材料如金(Au)和铪(Hf)纳米粒等的放射增敏作用已被大量细胞和动物实验所证实[12-14],其中,功能化HfO2纳米粒(NBTXR3)已进入Ⅰ期临床试验阶段,显示出潜在的临床转化前景[15],极大推动了其他金属纳米材料放射增敏剂的研发。MXene纳米片是由过渡金属元素(M)、碳/氮元素(X)组成的新型超薄片状二维纳米材料,由MAX相陶瓷(A代表A族元素)经氢氟酸刻蚀剥离A元素制备而来,具有比表面积大、易于功能化改性的结构特性,而且MAX相陶瓷组成的多样性为制备不同元素组成的MXene纳米片提供了可能性,从而使其可同时具有不同高Z元素的物理特性。Lin等[16]成功制备了Ta4C3 MXene纳米片,并采用大豆磷脂(SP)进行改性制备得到Ta4C3-SP纳米片,因Ta元素优良的X射线衰减性能[17]及其MXene材料高效的光热转换效率,其在肿瘤CT成像及光热治疗中显示出其独特的优势[16];有研究表明,空心的氧化钽纳米球对小鼠乳腺癌移植瘤具有一定的放射增敏作用[18]。本课题组前期制备了Ta4C3-PVP纳米片,在细胞水平证实其对人三阴性乳腺癌细胞MDA-MB-231具有明显的放射增敏作用[8]。
本研究采用小鼠TNBC 4T1荷瘤鼠模型,进一步探究Ta4C3-PVP纳米片对在体肿瘤的放射增敏效果。研究结果显示,与空白对照组相比,单纯尾静脉注射20 mg/kg Ta4C3-PVP对荷瘤小鼠移植瘤生长、抑瘤率、肿瘤组织病理变化及细胞增殖标志物Ki-67表达均无明显影响,表明此剂量对肿瘤细胞无明显细胞毒作用;相比较于单纯照射组,Ta4C3-PVP纳米片联合照射则可明显抑制体内肿瘤的生长,表现为瘤体体积明显减小及质量减轻,HE染色显示肿瘤组织中细胞死亡更为严重,免疫组织化学染色观测到细胞增殖标志物Ki-67表达明显减少,表明Ta4C3-PVP纳米片对体内肿瘤有较好的放射增敏作用。目前研究认为,射线与高Z金属纳米材料相互作用诱导金属原子电离及发射出各种次级电子,随后次级电子通过对关键靶分子的直接作用及诱导ROS生成的间接作用,进一步加重生物大分子如DNA损伤及细胞死亡,是高Z金属纳米材料放射增敏的主要物理化学基础[9]。本研究观察到Ta4C3-PVP联合照射可使DSBs分子标志物γ-H2AX焦点产额明显高于单纯照射组,而单纯Ta4C3-PVP则无此作用,与Ta4C3-PVP体外放射增敏MDA-MB-231细胞的作用原理相一致[8]。
综上所述,本研究从动物水平进一步证实Ta4C3-PVP纳米片通过加重受照射肿瘤组织细胞中DNA损伤程度,进而抑制了4T1荷瘤小鼠皮下肿瘤的生长,提高了4T1肿瘤组织的放射敏感性。本研究为二维Ta4C3MXene纳米材料在放射增敏领域的应用提供了体内实验依据。
利益冲突 全体作者无任何利益冲突
作者贡献声明 李欣悦负责实验操作、数据处理及撰写论文;尹俊、张旭霞、钟登琴协助实验进行;陈雨指导实验;陈红红指导实验和论文修改
| [1] |
Moran MS. Radiation therapy in the locoregional treatment of triple-negative breast cancer[J]. Lancet Oncol, 2015, 16(3): e113-e122. DOI:10.1016/S1470-2045(14)71104-0 |
| [2] |
Kumar P, Aggarwal R. An overview of triple-negative breast cancer[J]. Arch Gynecol Obstet, 2016, 293(2): 247-269. DOI:10.1007/s00404-015-3859-y |
| [3] |
Dragun AE, Pan J, Rai SN, et al. Locoregional recurrence in patients with triple-negative breast cancer: preliminary results of a single institution study[J]. Am J Clin Oncol, 2011, 34(3): 231-237. DOI:10.1097/COC.0b013e3181dea993 |
| [4] |
Abdulkarim BS, Cuartero J, Hanson J, et al. Increased risk of locoregional recurrence for women with T1-2N0 triple-negative breast cancer treated with modified radical mastectomy without adjuvant radiation therapy compared with breast-conserving therapy[J]. J Clin Oncol, 2011, 29(21): 2852-2858. DOI:10.1200/JCO.2010.33.4714 |
| [5] |
Lee YC, Wang WL, Chang WC, et al. Tribbles homolog 3 involved in radiation response of triple negative breast cancer cells by regulating notch1 activation[J]. Cancers (Basel), 2019, 11(2): 127. DOI:10.3390/cancers11020127 |
| [6] |
He MY, Rancoule C, Rehailia-Blanchard A, et al. Radiotherapy in triple-negative breast cancer: current situation and upcoming strategies[J]. Crit Rev Oncol Hematol, 2018, 131: 96-101. DOI:10.1016/j.critrevonc.2018.09.004 |
| [7] |
Xie J, Gong L, Zhu S, et al. Emerging strategies of nanomaterial-mediated tumor radiosensitization[J]. Adv Mater, 2019, 31(3): e1802244. DOI:10.1002/adma.201802244 |
| [8] |
尹俊, 李欣悦, 张旭霞, 等. Ta4C3-PVP纳米片对三阴性乳腺癌MDA-MB-231细胞的放射增敏作用[J]. 中华放射医学与防护杂志, 2020, 40(7): 493-499. Yin J, Li XY, Zhang XX, et al. Radiosensitization effect of Ta4C3-PVP nanosheets in human triple-negative breast cancer MDA-MB-231 cells[J]. Chin J Radiol Med Prot, 2020, 40(7): 493-499. DOI:10.3760/cma.j.issn.0254-5098.2020.07.001 |
| [9] |
Liu Y, Zhang P, Li F, et al. Metal-based nanoenhancers for future radiotherapy: radiosensitizing and synergistic effects on tumor cells[J]. Theranostics, 2018, 8(7): 1824-1849. DOI:10.7150/thno.22172 |
| [10] |
Hossain M, Su M. Nanoparticle location and material dependent dose enhancement in X-ray radiation therapy[J]. J Phys Chem C Nanomater Interfaces, 2012, 116(43): 23047-23052. DOI:10.1021/jp306543q |
| [11] |
Kobayashi K, Usami N, Porcel E, et al. Enhancement of radiation effect by heavy elements[J]. Mutat Res Rev Mutat Res, 2010, 704: 123-131. DOI:10.1016/j.mrrev.2010.01.002 |
| [12] |
Hainfeld JF, Slatkin DN, Smilowitz HM. The use of gold nanoparticles to enhance radiotherapy in mice[J]. Phys Med Biol, 2004, 49(18): 309-315. DOI:10.1088/0031-9155/49/18/n03 |
| [13] |
Her S, Jaffray DA, Allen C. Gold nanoparticles for applications in cancer radiotherapy: mechanisms and recent advancements[J]. Adv Drug Deliv Rev, 2017, 109: 84-101. DOI:10.1016/j.addr.2015.12.012 |
| [14] |
Maggiorella L, Barouch G, Devaux C, et al. Nanoscale radiotherapy with hafnium oxide nanoparticles[J]. Future Oncol, 2012, 8(9): 1167-1181. DOI:10.2217/fon.12.96 |
| [15] |
Bonvalot S, Le Pechoux C, de Baere T, et al. First-in-human study testing a new radioenhancer using nanoparticles (NBTXR3) activated by radiation therapy in patients with locally advanced soft tissue sarcomas[J]. Clin Cancer Res, 2017, 23(4): 908-917. DOI:10.1158/1078-0432.CCR-16-1297 |
| [16] |
Lin H, Wang YW, Gao SS, et al. Theranostic 2D tantalum carbide (MXene)[J]. Adv Mater, 2018, 30(4): 1703284. DOI:10.1002/adma.201703284 |
| [17] |
Brown R, Tehei M, Oktaria S, et al. High-Z nanostructured ceramics in radiotherapy: first evidence of Ta2O5-induced dose enhancement on radioresistant cancer cells in an MV photon field[J]. Part Part Syst Char, 2014, 31(4): 500-505. DOI:10.1002/ppsc.201300276 |
| [18] |
Song G, Chen Y, Liang C, et al. Catalase-loaded TaOx nanoshells as bio-nanoreactors combining high-Z element and enzyme delivery for enhancing radiotherapy[J]. Adv Mater, 2016, 28(33): 7143-7148. DOI:10.1002/adma.201602111 |
 2021, Vol. 41
2021, Vol. 41


