肠道组织自我更新较快,对电离辐射十分敏感,是电离辐射损伤的重要靶组织。肠道的损伤既是急性放射病患者死亡的重要原因,又是临床肿瘤患者放射治疗中最主要的不良反应和照射剂量限制因素[1],越来越受到医学界的关注和重视。然而,目前放射性肠损伤的准确机制尚不清楚,临床上缺乏有效的干预手段,防治药物研究面临瓶颈[2]。脂质参与能量转换、细胞发育和分化、信息识别与传递等多种生理过程,脂质代谢的研究在医学上具有重要的生物意义。2003年国际上正式提出了脂质组学这一新的前沿研究领域[3],脂质组学基于高通量分析技术,系统性解析生物体脂质组成与表达变化,进而阐明相关的生命活动机制与机理,已被广泛应用于标志物的筛选、病理机制探索、药物作用靶点筛选等研究[4-5]。本研究采用基于液相色谱-质谱联用技术(LC-MS)的靶向脂质组学方法,分析受到不同剂量60Co γ射线全身照射大鼠的小肠组织中的脂质代谢物变化,筛选辐射敏感脂质代谢物并探索其代谢通路,为放射性肠损伤生物标志物的研究提供科学依据。
材料与方法1. 动物分组与照射条件:雄性SD大鼠50只(SPF级),6~8周龄、体重200~250 g,购自北京维通利华实验动物技术有限公司,生产许可证号为SYXK(京)2016-0006。用单纯随机抽样方法将大鼠分为健康对照组和5个照射组,其中5和8 Gy组为9只,其他组为8只。在北京市辐照中心用60Co γ射线对大鼠进行全身照射,照射剂量分别为0、1、2、3、5、8 Gy。剂量率为1 Gy/min,源强130 TBq,源靶距为84 cm,平均照射野50 cm×50 cm。本研究所有动物实验已通过中国疾病预防控制中心辐射防护与核安全医学所实验动物伦理福利委员会审查。
2. 小肠样本采集:大鼠照射后放回屏障系统继续饲养3 d。大鼠脱颈椎处死后,沿腹白线剪开,解剖腹部,取腹腔内左上腹的小肠,约2 cm,用1×磷酸盐缓冲液(PBS)冲洗,清除肠道内容物及附着物,用滤纸吸干后置于-80℃冰箱冻存。
3. 样品前处理:称取小肠组织约100 mg于1.5 ml匀浆管中,匀浆1 h。加入300 μl甲醇(含脂质内标和抗氧化剂)和1 ml甲基叔丁基醚,进行脂质提取1 h,加入250 μl水,涡旋混匀30 s。4℃ 12 000 r/min,离心半径5 cm,离心5 min,取上层溶液100 μl,置于1.5 ml Eppendorf微量离心管中。真空离心浓缩样本4 h,向干燥后的样品中加入200 μl异丙醇/乙腈(1 ∶1, V/V)溶液,涡旋混匀10 min。12 000 r/min,离心半径5 cm,离心5 min,取上清液100 μl,置于200 μl内衬管中,待测。质量控制(QC)样品是由所有小肠样本的匀浆提取液各移取10 μl混合均匀后得到,前处理方法与实测样品相同。
4. 色谱条件:采用超高压液相色谱系统对小肠样本进行分离(美国Waters公司)。色谱柱为UPLC BEH C8(2.1 mm×100 mm,1.7 μm;美国Waters公司)。流动相A为乙腈∶水=6 ∶4,0.1%甲酸、5 mmol甲酸铵;流动相B为乙腈∶异丙醇9 ∶1,0.1%甲酸、5 mmol甲酸铵。柱温55℃,流速0.26 ml/min,进样量1.0 μl。
5. 质谱条件:采用XEVO TQ-S Micro型串联四级杆质谱仪(美国Waters公司),对样品在电喷雾正、负电离模式下进行多反应监测(multiple reaction monitoring,MRM)扫描。正离子源电压为3 kV,锥孔电压为25 V,去溶剂温度500℃,源温度150℃。负离子源电压为1.5 kV,锥孔电压为20 V,去溶剂温度500℃,源温度150℃。采用MasslynxV4.1软件进行质谱数据采集。
6. 数据处理和统计分析:原始数据和建立方法的离子对表导入Skyline 3.5软件[6],根据保留时间来确定各个指标的色谱峰,保留时间允许误差15 s,对色谱峰进行积分,通过内标一点法得到各个指标的浓度。应用MetaboAnalyst 4.0及Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库进行主成分分析(principal component analysis,PCA)、热图分析、代谢通路分析。差异脂质代谢物的筛选方法为8 Gy组和0 Gy组进行非配对双样本t检验,P < 0.05和错误发现率(FDR) < 0.05为差异具有统计学意义。用SPSS 19.0软件进行统计学分析,多组间脂质代谢物浓度经正态性检验符合正态分布。组间比较采用单因素方差分析,两两比较采用LSD-t检验。P < 0.05为差异具有统计学意义。
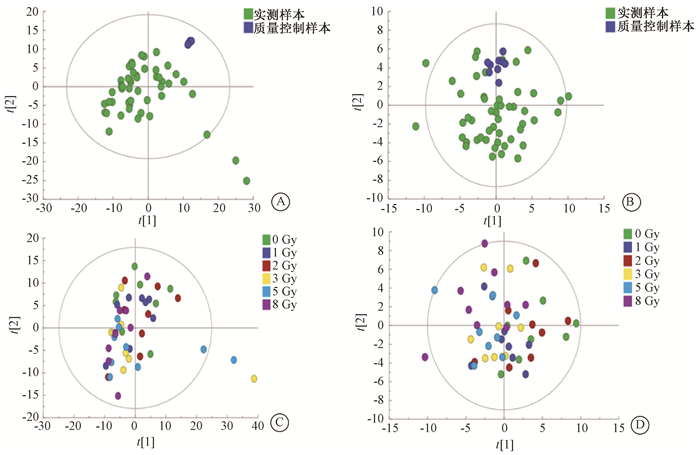
结果1. 质量控制:QC样本在正、负离子模式下PCA得分图如图 1A、1B所示,QC样本的投影位置聚集在一起,表明LC-MS系统稳定,获得的实验数据可靠,能够满足脂质组学分析要求。大鼠小肠组织经过靶向脂质组学分析后,检测并定量414种脂质代谢物,包括脂肪酸、甘油脂、鞘脂、甘油磷脂、胆固醇酯等5个大类,脂肪酸(fatty acids,FA),甘油二酯(diacylglycerol,DG),甘油三酯(triacylglycerol,TG),鞘磷脂(sphingomyelin,SM),神经酰胺(ceramide,Cer),二己糖神经酰胺(dihexosylcermide,Hex2Cer),磷脂酰胆碱(phosphatidylcholine,PC),烷基醚磷脂酰胆碱(alkyl ether PC,PC-O),磷脂酰乙醇胺(phosphatidylethanolamine,PE),烷基醚磷脂酰乙醇胺(alkyl ether PE,PE-O),磷脂酰肌醇(phosphatidylinositol,PI),磷脂酸(phosphatidic acid,PA),磷脂酰甘油(phosphatidylglycerol,PG),磷酯酰丝氨酸(phosphatidylserine,PS),溶血磷脂酰胆碱(lysophosphatidylcholine,LPC),烷基醚溶血磷脂酰胆碱(alkyl etherLPC,LPC-O),溶血磷脂酰乙醇胺(lysophosphatidylethanolamine,LPE),胆固醇酯(cholesteryl ester,CE)等18个亚类。
|
图 1 大鼠小肠组织样本的主成分分析得分 A.质量控制样本与实测样本正离子模式;B.质量控制样本与实测样本负离子模式;C.各剂量组大鼠小肠组织样本正离子模式;D. 各剂量组大鼠小肠组织样本负离子模式 Figure 1 Score of principal component analysis of rat small intestine samples A.Quality control and on-test samples (ESI+); B.Quality control and on-test samples (ESI-); C. The clusters of rat small intestine samples of 6 groups (ESI+); D. The clusters of rat small intestine samples of 6 groups (ESI-) |
2. 主成分分析:为观察大鼠小肠组织中脂质代谢物的整体变化情况,将各组大鼠小肠组织样本进行PCA分析(图 1)。在PCA得分图上的每个点代表一个独立的样本,各组投影点的距离越远,表示组间差异越大。结果显示,大鼠受到60Co γ射线照射后,小肠组织脂质代谢物发生显著变化。
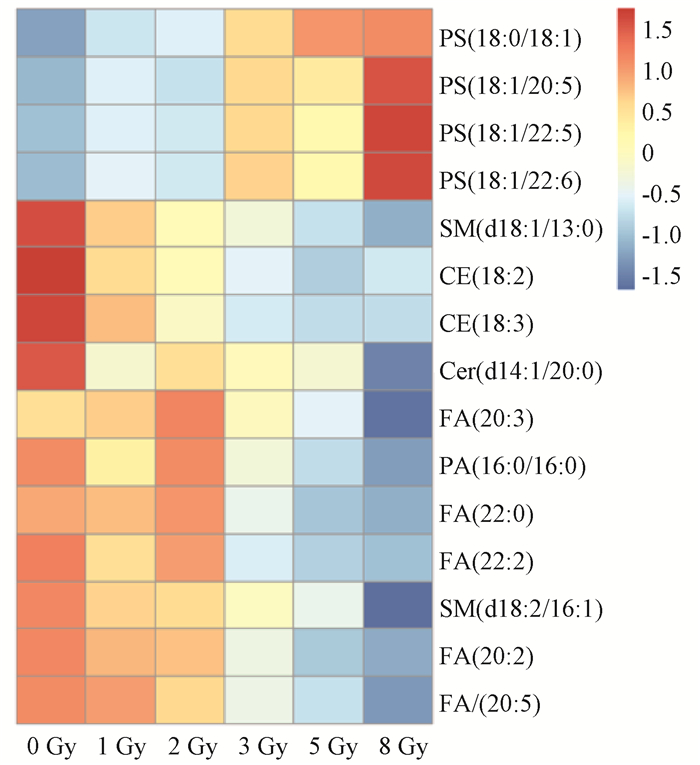
3. 辐射敏感脂质代谢物的筛选:从定量分析到的414种脂质代谢物中筛选差异代谢物。8 Gy与0 Gy组同代谢物相比,共筛选出15个差异脂质代谢物,包括胆固醇酯、鞘脂、甘油磷脂、游离脂肪酸等(表 2)。其中正离子模式筛选出5个差异脂质代谢物,包括CE(2个)、SM(2个)、Cer(1个);负离子模式筛选出10个差异脂质代谢物,包括FA(5个)、PS(4个)、PA(1个)。根据差异代谢物的浓度进行热图分析,用颜色的深浅代表浓度的高低,其中红色表示浓度高,蓝色表示浓度低(图 2)。其中4个差异代谢物浓度明显升高,11个差异代谢物浓度明显降低。
|
|
表 2 8 Gy60Co γ射线全身照射后大鼠的小肠组织中差异脂质代谢物 Table 2 Differential lipids in rat small intestine after total body irradiation with 8 Gy 60Co γ-rays |
|
图 2 大鼠受到8 Gy60Co γ射线全身照射后小肠组织中各差异脂质代谢物的热图分析 Figure 2 Heatmap of differential lipids in rat small intestine after total body irradiation with 8 Gy 60Co γ-rays |
4. 辐射敏感脂质代谢物的剂量-效应关系:0~8 Gy 60Co γ射线照射后大鼠小肠组织差异脂质代谢物的浓度在不同剂量组间差异有统计学意义(F =4.079 ~ 11.09,P < 0.05)。两两比较显示,对于定量分析到的414种脂质代谢物,与0 Gy组相比,4个磷脂酰丝氨酸PS(18 ∶0/18 ∶1)、PS(18 ∶1/20 ∶5)、PS(18 ∶1/22 ∶5) 及PS(18 ∶1/22 ∶6)在3、5、8 Gy组均显著升高,差异有统计学意义(t=-5.503、-5.449、-5.422、-6.395,P < 0.05),1个鞘磷脂SM(d18 ∶1/13 ∶0)、4个脂肪酸FA(20 ∶2)、FA(20 ∶5)、FA(22 ∶0)及FA(22 ∶2) 在3、5、8 Gy组均显著降低,差异均有统计学意义(t=4.110、4.841、5.998、4.373、4.457,P < 0.05),CE(18 ∶2)、CE(18 ∶3)在2、3、5、8 Gy组均显著降低,差异均有统计学意义(t=3.945、4.802,P < 0.05)。
11个差异脂质代谢物具有良好的剂量-效应关系(R2> 0.80, P < 0.05),其中,代谢物PS(18 ∶0/18 ∶1)、PS(18 ∶1/20 ∶5)、PS(18 ∶1/22 ∶5) 及PS(18 ∶1/22 ∶6)随照射剂量的上升而上升,SM(d18 ∶1/13 ∶0)、SM(d18 ∶2/16 ∶1)、FA(20 ∶2)、FA(20 ∶3)、FA(20 ∶5)、FA(22 ∶0)及PA(16 ∶0/16 ∶0)随照射剂量的上升而下降,符合线性方程模型(表 3)。分析0、1、2、3、5和8 Gy 6个剂量中,11个差异脂质代谢物浓度的均值及标准偏差,发现在各个组别中,代谢物的标准偏差均小于均值的30%(6.9%~29.3%),说明这11个代谢物在各个大鼠之间的个体差异在可接受的范围内。
|
|
表 3 大鼠小肠组织辐射敏感差异脂质代谢物的剂量-效应曲线 Table 3 Dose-response curves of radiosensitive lipids in rat small intestine |
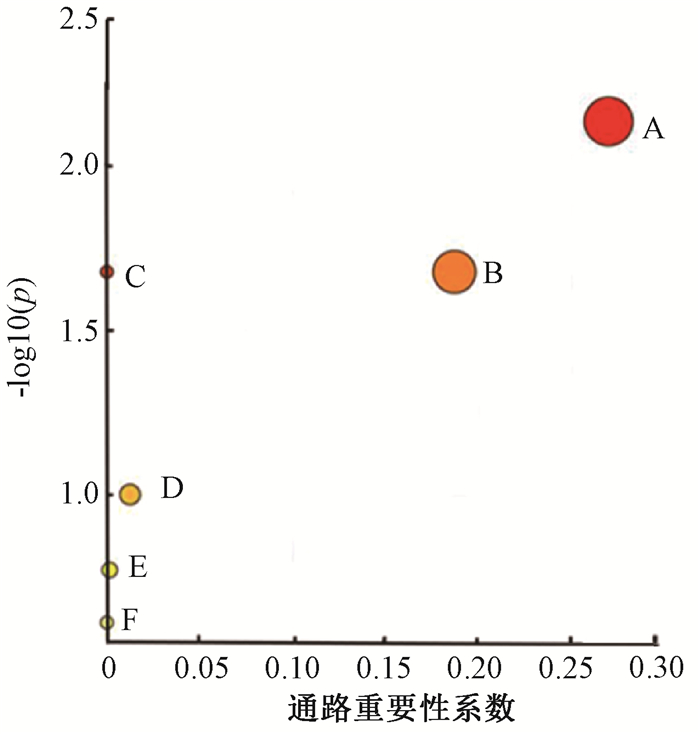
5. 代谢通路分析:为研究大鼠小肠组织辐射损伤脂质代谢物所涉及的代谢途径和代谢物之间的关联性,对15个差异脂质代谢物进行通路富集分析。将所有差异脂质代谢物进行整合,寻找其关联性并筛选出和辐射损伤最相关的代谢途径(图 3)。图中横坐标Pathway impact表示代谢通路的重要性,纵坐标-log10(p)表示代谢通路富集分析的显著性水平,代谢通路越靠近右上方则表示通路可信性越高。结果显示,大鼠受到60Co γ射线全身照射后,肠损伤主要涉及鞘脂代谢、甘油磷脂代谢等代谢通路。
|
注:A. 鞘脂代谢;B. 甘油磷脂代谢;C. 甘油脂代谢;D. 不饱和脂肪酸生物合成;E. 磷脂酰肌醇信号系统;F. 类固醇生物合成 图 3 大鼠受到60Co γ射线全身照射后小肠组织的脂质代谢通路 Figure 3 Lipid metabolic pathway analysis of rat small intestine after total body irradiation with 60Co γ-rays |
讨论
辐射可直接或间接对机体组织和细胞造成损伤,影响机体正常代谢活动,进而引发一系列氧化应激反应并导致机体代谢功能紊乱。小肠代谢更新快,对电离辐射十分敏感,受到照射后快速发生损伤。国内外尚缺乏有效的放射性肠损伤防治手段,因此寻找放射性肠损伤相关生物标志物,具有重要的研究意义。
目前脂质组学一般采用LC-MS技术,主要分为非靶向分析和靶向分析两类。脂质分子根据种类,有特定的质谱裂解规律,根据设置可能存在的母离子、子离子的离子对进行多反应监测(MRM),可以实现对脂质分子的靶向分析。靶向脂质组学方法具有高通量、高灵敏、广覆盖等特点,在生物标志物筛选中具有显著优势。
过往已有研究报道,在小鼠或非人灵长类(NHP)模型中,电离辐射可以诱导小肠组织中脂质代谢发生扰动,目前未见利用大鼠模型探索受照后小肠组织中脂质代谢变化的研究。而且已有研究均集中于发现差异脂质代谢物,未对其剂量-效应关系进行探究。本研究利用基于LC-MS技术的靶向脂质组学方法,分析了受到60Co γ射线全身照射的大鼠小肠组织中脂质代谢物的变化,筛选出15个差异脂质代谢物,其中11个代谢物(包括FA,PA,PS,SM)在0~8 Gy范围内具有良好的剂量-效应关系,说明其对电离辐射非常敏感,非常有潜力成为放射性肠损伤生物标志物。Ghosh等[7]已报道小鼠受到60Co γ射线全身照射后,小肠组织中的PS、FA均会发生显著变化。该研究组还发现,非人灵长类(NHP)受到60Co γ射线全身照射后,小肠组织中的PA、PS均会发生显著变化[8]。本研究结果及文献结果都提示FA、PA和PS是很有潜力的放射性肠损伤生物标志物种类。以往的辐射代谢组学研究发现,不同的动物模型在受照后3 d,代谢物均发生显著变化,因此本研究选用了受照后3 d这一时间点[9-10]。
本研究将辐射敏感脂质代谢物进行代谢通路分析,发现与放射性肠损伤最相关的代谢通路为鞘脂代谢及甘油磷脂代谢。鞘脂是一类含有鞘氨醇骨架的两性脂,包括鞘磷脂(SM)、神经节苷脂等,是生物膜结构的重要组成成分。鞘脂及其代谢产物是一类很重要的活性分子,参与调节细胞的生长、分化、衰老和细胞凋亡等许多重要的信号转导过程[11-12]。本研究结果中SM水平降低,提示电离辐射暴露可能激活鞘磷脂酶水解SM,释放出神经酰胺(Cer),Cer作为第二信使,介导细胞凋亡,从而导致肠组织损伤。甘油磷脂包括PC、PE、PI、PS、PA、PG等多种亚类。PS作为一种重要的甘油磷脂,是细胞膜的重要组分,同时是经典的细胞信号通路转导分子,尤其在细胞凋亡过程中发挥重要作用[13]。本研究结果中PS水平升高,提示了与电离辐射暴露相关的细胞凋亡的增加,从而促进了辐射诱导的肠损伤。
综上所述,本研究采用靶向脂质组学的方法,以受到全身照射的大鼠作为损伤模型,发现60Co γ射线照射后3 d,小肠组织中脂质代谢物发生显著性变化,筛选出11个具有良好的剂量-效应关系的辐射敏感脂质代谢物。肠损伤主要涉及鞘脂代谢、甘油磷脂代谢等代谢通路。研究组下一步将考察不同时间点等因素的影响,同时考察辐射敏感脂质代谢物对于不同程度肠损伤的诊断区分能力,为放射性肠损伤的早期干预、治疗靶点、防治药物开发、减轻临床放疗副作用等提供科学依据。
利益冲突 无
作者贡献声明 习聪负责实验操作、数据分析、论文撰写;赵骅、陆雪、蔡恬静协助实验操作、数据分析;田梅、刘青杰指导课题设计、论文修改
| [1] |
Mallick S, Madan R, Julka PK, et al. Radiation induced cystitis and proctitis - prediction, assessment and management[J]. Asian Pac J Cancer Prev, 2015, 16(14): 5589-5594. DOI:10.7314/apjcp.2015.16.14.5589 |
| [2] |
Dickson I. Radiotherapy: pharmacological quiescence for radiation-induced intestinal injury[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(12): 683. DOI:10.1038/nrgastro.2016.175 |
| [3] |
Han X, Gross RW. Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry: a bridge to lipidomics[J]. J Lipid Res, 2003, 44(6): 1071-1079. DOI:10.1194/jlr.R300004-JLR200 |
| [4] |
Márcia CFM, Giovana CM, Célio FFA, et al. Plasma lipidomic signature of rectal adenocarcinoma reveals potential biomarkers[J]. Front Oncol, 2018, 7: 325. DOI:10.3389/fonc.2017.00325 |
| [5] |
Sorensen CM, Ding J, Zhang Q, et al. Perturbations in the lipid profile of individuals with newly diagnosed type 1 diabetes mellitus: lipidomics analysis of a diabetes antibody standardization program sample subset[J]. Clin Biochem, 2010, 43(12): 948-956. DOI:10.1016/j.clinbiochem.2010.04.075 |
| [6] |
Adams KJ, Pratt B, Bose N, et al. Skyline for small molecules: a unifying software package for quantitative metabolomics[J]. J Proteome Res, 2020, 19(4): 1447-1458. DOI:10.1021/acs.jproteome.9b00640 |
| [7] |
Ghosh SP, Singh R, Chakraborty K, et al. Metabolomic changes in gastrointestinal tissues after whole body radiation in a murine model[J]. Mol Biosyst, 2013, 9(4): 723-731. DOI:10.1039/c3mb25454b |
| [8] |
Cheema AK, Mehta KY, Rajagopal MU, et al. Metabolomicstudies of tissue injury in nonhuman primates exposed to gamma-radiation[J]. Int J Mol Sci, 2019, 20(13): 3360. DOI:10.3390/ijms20133360 |
| [9] |
Tang X, Zheng M, Zhang Y, et al. Estimation value of plasma amino acid target analysis to the acute radiation injury early triage in the rat model[J]. Metabolomics, 2013, 9: 853-863. DOI:10.1007/s11306-013-0502-4 |
| [10] |
Pannkuk EL, Laiakis EC, Singh VK, et al. Lipidomic signatures of nonhuman primates with radiation-induced hematopoietic syndrome[J]. Sci Rep, 2017, 7(1): 9777. DOI:10.1038/s41598-017-10299-w |
| [11] |
Pulli I, Asghar MY, Kemppainen K, et al. Sphingolipid-mediated calcium signaling and its pathological effects[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(11 Pt B): 1668-1677. DOI:10.1016/j.bbamcr.2018.04.012 |
| [12] |
Perry DK. Ceramide and apoptosis[J]. Biochem Soc Trans, 1999, 27(4): 399-404. DOI:10.1042/bst0270399 |
| [13] |
Segawa K, Nagata S. An apoptotic 'Eat Me' signal: phosphatidylserine exposure[J]. Trends Cell Biol, 2015, 25(11): 639-650. DOI:10.1016/j.tcb.2015.08.003 |
 2021, Vol. 41
2021, Vol. 41


