2. 苏州大学医学部公共卫生学院营养与食品卫生学教研室 215123
2. Department of Nutrition and Food Hygiene, School of Public Health, Soochow University, Suzhou 215123, China
放射治疗是肺癌的主要治疗手段之,但放射性肺损伤仍是临床的棘手问题。现用于放射性肺损伤的药物较少,且特异性差、价格昂贵,一些研究者把目光转向食物营养素及其活性成分[1]。
乳铁蛋白(Lactoferrin,Lf)是相对分子质量为80×103的糖蛋白,具有抗菌抗病毒、调节铁代谢、调节机体免疫、抗炎抗氧化等功能[2]。动物实验已证实Lf能有效改善照射后小鼠的生存状况并延长生存期[3-5],Nishimura等[3]和Feng等[4]认为Lf的辐射防护作用与提高自由基清除能力及抗氧化有关。前期研究发现,Lf干预能显著改善5 Gy全身照射小鼠的放射性肠损伤[5]。目前还没有关于Lf能否改善放射性肺损伤的研究,本研究通过建立放射性肺损伤动物模型,观察Lf干预对受照射肺的结构与功能保护作用,为肿瘤放疗引起的放射性肺损伤提供新的实验基础。
材料与方法1.药品试剂:牛奶来源的食品级Lf购于美国Glanbia Nutritional INC公司;促炎因子白介素1β(IL-1β)、IL-6及肿瘤坏死因子α(TNF-α)试剂盒购于上海碧云天生物技术有限公司;高迁移率族蛋白B1(HMGB1)试剂盒购于武汉基因美生物科技有限公司。免疫组织化学染色和Western blot用抗体:HMGB1和NF-κB购于英国Abcam公司,Toll样受体4(TLR4)购于美国Proteintech公司,MyD88购于美国Immuno Way Biotechnology公司,β-肌动蛋白购于武汉博士德生物工程有限公司。化学发光辣根过氧化物酶(HRP)底物电化学发光(ECL)试剂盒购于美国Millipore公司,二喹啉甲酸(BCA)蛋白浓度检测试剂盒购于上海碧云天生物技术有限公司。
2.实验动物及分组:6~8周龄C57BL/6 J雄性SPF级小鼠15只,体重(20±2)g,购于中国科学院上海动物史莱克有限公司(合格证号:201903A035)。饲养于苏州大学动物实验中心(许可证号:XCYK[苏]2002-0008),环境温度为22~25℃,湿度为55%~65%。1周适应喂养后,根据体重随机数表法分为3组,健康对照组、15 Gy照射组(单纯照射组)和Lf+15 Gy照射组(联合组),每组5只,自由摄食饮水。联合组于照射前3 d开始给予10 mg/ml的Lf饮用,直至实验结束[6]。实验期间称量小鼠体重及观察一般生命体征的变化。
3.照射条件及方法:5%水合氯醛麻醉小鼠,固定小鼠于特制的胸部照射装置上。采用美国Varian Clinic 600直线加速器6 MV的X射线照射,源皮距100 cm,剂量率为300 cGy/min,总照射剂量为15 Gy,照射野10 cm×10 cm,范围为小鼠胸部锁骨上至剑突下,其余用铅板遮挡。
4.标本采集与处理:照射后14 d处死小鼠,眼球取血,3 000 r/min,离心半径8.37 cm,4℃条件下离心10 min,取上清,-80℃冻存备用。左肺组织用10%甲醛溶液固定,用于肺组织病理观察及免疫组织化学实验,右肺组织-80℃存储,做分子生物学研究。
5.肺组织病理观察及评分:取肺组织石蜡包埋切片,5 μm切片脱蜡后,苏木素-伊红(HE)染色。显微镜观察并作图像采集分析。肺损伤评分参照文献[7]。
6.肺组织HMGB1和NF-κB免疫组织化学分析:取肺组织石蜡切片,脱蜡水化,微波修复,过氧化氢孵育,封闭。加入50 μl的一抗HMGB1(1 ∶500稀释)和NF-κB(1 ∶400稀释),4℃孵育过夜,冲洗后加入二抗,常温孵育1 h。中性树胶封固。HMGB1和NF-κB免疫组织化学染色阳性细胞呈棕黄,染色深者呈褐色,每张切片随机取5个视野(×200;×400)读片,并用Image Pro Plus图像分析软件对图像进行定量计算。
7.酶联免疫吸附法(ELISA)检测血清炎症因子:血清炎症因子IL-1β、IL-6、TNF-α和HMGB1按照试剂盒说明书检测,酶标仪450 nm波长检测吸光度(A450)值,计算各因子水平。
8. 免疫印迹(Western blot)检测炎症相关蛋白:按照试剂盒说明书提取肺组织总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度,进行蛋白定量。聚丙烯酰胺凝胶电泳分离、转膜、封闭。一抗HMGB1(1 ∶1 000稀释)、TLR4(1 ∶400稀释)、MyD88(1 ∶1000稀释)NF-κB (1 ∶500稀释)、β-肌动蛋白(1 ∶1000稀释),4℃过夜,然后加入对应二抗(1 ∶5000稀释)室温孵育2 h,按照ECL化学发光试剂盒说明书操作。采用Image J软件分析Western blot条带的灰度值。所有结果重复3次,取均值。
9. 统计学处理:采用SPSS 24.0进行统计分析,数据符合正态分布及方差齐性,以x±s表示。单因素方差分析用于多组间比较,组间两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果1.小鼠一般情况、体重和肺重:实验期间无小鼠死亡,照射后,单纯照射组和联合组小鼠体重均有一过性降低,然后缓慢恢复,3组间差异无统计学意义(P>0.05)。照后14 d,单纯照射组小鼠的肺重(0.17±0.01)g显著高于健康对照组(0.15±0.01)g,两组比较差异有统计学意义(t=3.20,P < 0.05);而联合组小鼠肺重(0.15±0.02)g显著低于单纯照射组,两组比较差异有统计学意义(t=2.18,P < 0.05)。
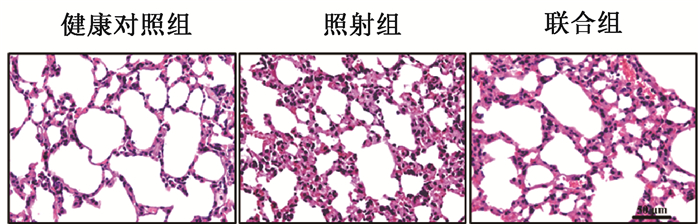
2.肺组织病理学改变及评分:HE染色镜检发现,健康对照组小鼠肺组织及肺泡形态结构完好、清晰,无炎症细胞浸润和出血现象;照射组肺组织结构破坏严重,可见肺泡充血、肺间质水肿,并伴有大量炎症细胞浸润;联合组则明显改善了上述肺损伤(图 1)。3组评分结果分别为健康对照组(0.60±0.89)分、单纯照射组(3.20±0.45)分、联合组(1.80±0.84)分,差异有统计学意义(F=14.94,P < 0.01);联合组显著低于单纯照射组(t=3.30,P < 0.01)。
|
图 1 各组小鼠15 Gy照射后14 d肺组织病理形态 HE染色 ×400 Figure 1 The pathological changes in lung tissue of mice at 14 d post-irradiation HE staining ×400 |
3.血清炎症因子的水平:ELISA法检测血清HMGB1、TNF-α、IL-1β和IL-6水平,发现照射组小鼠血清TNF-α显著高于健康对照组(t=3.07,P < 0.05);Lf抑制了照射引起的TNF-α水平升高,基本恢复到正常水平。与照射组相比,联合组小鼠血清HMGB1、TNF-α和IL-1β显著下降(t=4.67、2.97、3.49,P < 0.05),IL-6水平呈下降趋势,见表 1。
|
|
表 1 3组小鼠照后14 d血清炎症因子的表达(pg/ml, x±s) Table 1 Expression of serum inflammatory factors in each group at 14 d post-irradiation(pg/ml, x±s) |
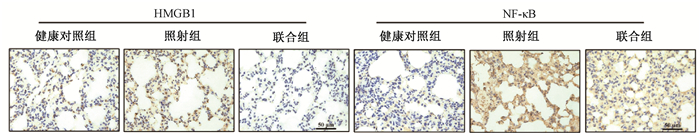
4.免疫组织化学染色检测肺组织中HMGB1和NF-κB的表达:照射组小鼠肺组织中HMGB1和NF-κB阳性细胞表达明显增加,Lf能够明显减少阳性细胞数(图 2)。健康对照组、照射组、联合组HMGB1分别为(24.94±2.30)%、(47.24±3.31)%、(28.26±3.15)%,差异有统计学意义(F=81.91,P < 0.01);联合组显著低于照射组(t=9.09,P < 0.001)。NF-κB分别为(27.88±2.76)%、(56.95±4.10)%、(34.31±4.50)%,差异有统计学意义(F=78.37,P < 0.01);联合组显著低于照射组(t=8.32,P < 0.001)。
|
图 2 各处理组小鼠照后14 d肺组织HMGB1和NF-κB阳性细胞比例 免疫组织化学染色 ×400 Figure 2 Expression of HMGB1 and NF-κB protein and the percentage of positive staining cells in mice lung tissue in each group at 14 d post-irradiation Immunohistochemistry assay ×400 |
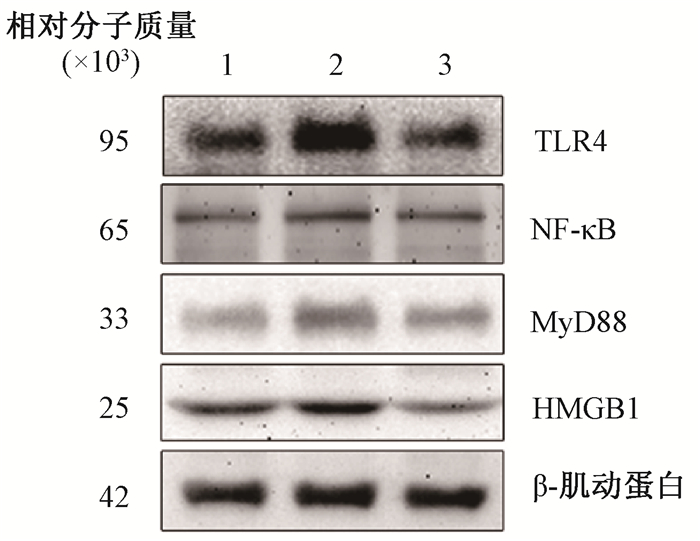
5.肺组织中炎症相关因子蛋白表达差异:蛋白的相对表达量见图 3。单纯照射组小鼠肺组织中HMGB1、TLR4、MyD88和NF-κB蛋白表达显著上调(t=4.04、4.78、3.77、6.14,P < 0.05)。与单纯照射组比较,联合组小鼠肺组织中HMGB1、TLR4、MyD88及NF-κB的蛋白表达均显著下调(t=8.06、9.80、3.07、5.56,P < 0.05),见表 2。
|
注:1.健康对照组;2.单纯照射组;3.联合组 图 3 组小鼠肺组织炎症相关通路的蛋白表达 Figure 3 Expression of proteins of inflammatory pathways in lung tissues of third group mice |
|
|
表 2 3组小鼠肺组织炎症相关通路蛋白的相对表达量(x±s) Table 2 Relative expression level of proteins of inflammatory pathways in lung tissues of three groups of mice(x±s) |
讨论
本研究发现,饮水给予Lf对胸部照射小鼠的体重影响不大,但降低了14 d照射小鼠的肺湿重,特别是改善了小鼠肺组织出血、肺间质水肿及炎症细胞浸润。Han等[8]用脓毒症诱导的肺损伤模型也发现Lf灌胃30 d显著减低了肺湿/干比。因此,Lf对外界环境急性刺激所致的肺损伤具有一定的保护作用。
Lf在外界刺激所致的细胞免疫反应和维持生理稳态中发挥重要作用。这种保护作用可能与调节炎症反应有关。前期研究观察到Lf可降低全身照射小鼠血清TNF-α和IL-6水平[8]。Han等[8]也发现可显著降低脓毒症诱导的肺损伤小鼠的TNF-α、IL-8和转移抑制因子水平。本研究虽然发现Lf降低了小鼠血清TNF-α和IL-1β水平,IL-1β甚至低于健康对照组,但是无论照射还是Lf干预,对IL-6水平影响不明显,这可能与机体免疫系统和炎症反应相互调节的复杂过程有关。
HMGB1是损伤相关分子模式成员的典型代表,在急性肺损伤中高表达的HMGB1由核内释放到细胞外,作为促炎因子参与急性肺损伤的发生发展[9]。本研究发现,饮水给予Lf能显著降低受照小鼠血清HMGB1水平,并且免疫组织化学染色和Western blot均证实其显著抑制了照射引起的肺组织HMGB1蛋白的上调。Wang等[10]用15 Gy全胸照射小鼠后腹腔注射HMGB1中和抗体,1周后发现HMGB1拮抗能缓解照射诱导的肺泡炎症反应,并显著降低肺组织炎症因子TNF-α、IL-6和IL-17 A水平,下调p65 NF-κB蛋白表达,也同样证实了降低HMGB1在缓解照射所致肺损伤中的作用。
本研究发现Lf干预显著下调了肺组织TLR4/MyD88/NF-κB通路的蛋白表达。TLR4/MyD88/NF-κB信号通路在免疫和炎症机制中发挥重要作用,IL-1受体相关激酶及TNF受体相关因子6等募集到TLR4/MyD88复合体,将IκB激酶(IKKα和IKKβ)磷酸化,活化的IKK将细胞内NF-κB-IκB复合物中IκB亚基泛素化降解,释放NF-κB进入细胞核,启动转录进程,分泌促炎细胞因子[11]。Wang等[12]发现IKKβ抑制剂IMD0354阻止了照射诱导p65 NF-κB从肺癌细胞株A549和PC9细胞的胞浆转移至细胞核,小鼠全胸12 Gy照射后,IMD0354腹腔注射降低了急慢性肺损伤和炎症细胞浸润。采用活体成像系统,Yen等[13]发现Lf灌胃2周能显著缓解高氧诱导的NF-κB/荧光素酶转基因小鼠的肺损伤,并且降低肺组织TNF-α、IL-1β和IL-6表达,增加IκB的表达。因此,NF-κB及其通路在Lf缓解放射性肺损伤中起到重要作用,但直接的作用靶点还需进一步的研究。
总之,Lf通过调节HMGB1/TLR4/MyD88/NF-κB信号通路,降低促炎因子分泌,从而改善放射性肺损伤。本动物实验还存在一定缺陷,如干预剂量和观察时点单一以及检测指标较少等,因此需要进一步的实验室研究进行验证。
利益冲突 无所有研究者均未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 陈玉中负责实验运行、数据处理和论文撰写;顾佳、堵雅芳、李云虹负责动物处理及样本收集;段广新、赵琳、秦立强、徐加英负责实验设计论文思路指导及修改
| [1] |
Smith TA, Kirkpatrick DR, Smith S, et al. Radioprotective agents to prevent cellular damage dueto ionizing radiation[J]. J Transl Med, 2017, 15(1): 232. DOI:10.1186/s12967-017-1338-x |
| [2] |
Hao L, Shan Q, Wei J, et al. Lactoferrin: major physiological functions and applications[J]. Curr Protein Pept Sci, 2019, 20(2): 139-144. DOI:10.2174/1389203719666180514150921 |
| [3] |
Nishimura Y, Homma-Takeda S, Kim HS, et al. Radioprotection of mice by lactoferrin against irradiation with sublethal X-rays[J]. J Radiat Res, 2014, 55(2): 277-282. DOI:10.1093/jrr/rrt117 |
| [4] |
Feng L, Li J, Qin L, et al. Radioprotective effect of lactoferrin in mice exposed to sublethal X-ray irradiation[J]. Exp Ther Med, 2018, 16(4): 3143-3148. DOI:10.3892/etm.2018.6570 |
| [5] |
Wei YL, Xu JY, Zhang R, et al. Effects of lactoferrin on X-ray-induced intestinal injury in BALB/C mice[J]. Appl Radiat Isot, 2019, 146: 72-77. DOI:10.1016/j.apradiso.2019.01.014 |
| [6] |
Ling CJ, Min QQ, Yang JR, et al. Lactoferrin alleviates the progression of atherosclerosis in apoE-/- mice fed with high-fat/cholesterol diet through cholesterol homeostasis[J]. J Med Food, 2019, 22(10): 1000-1008. DOI:10.1089/jmf.2018.4389 |
| [7] |
Zhang J, Cui R, Feng Y, et al. Serotonin exhibits accelerated bleomycin-induced pulmonary fibrosis through TPH1 knockout mouse experiments[J]. Mediators Inflamm, 2018, 2018: 7967868. DOI:10.1155/2018/7967868 |
| [8] |
Han N, Li H, Li G, et al. Effect of bovine lactoferrin as a novel therapeutic agent in a rat model of sepsis-induced acute lung injury[J]. AMB Express, 2019, 9(1): 177. DOI:10.1186/s13568-019-0900-8 |
| [9] |
Fan E, Brodie D, Slutsky AS. Acute respiratory distress syndrome: advances in diagnosis and treatment[J]. JAMA, 2018, 319(7): 698-710. DOI:10.1001/jama.2017.21907 |
| [10] |
Wang L, Zhang J, Wang B, et al. Blocking HMGB1 signal pathway protects early radiation-induced lung injury[J]. Int J Clin Exp Pathol, 2015, 8(5): 4815-4822. |
| [11] |
鲍璐璐, 崔立红. TLR4/MyD88/NF-κB信号通路的研究进展[J]. 胃肠病学和肝病学杂志, 2019, 28(5): 568-572. Bao LL, Cui LH. Advances in TLR4/MyD88/NF-κB signaling pathway[J]. Chin J Gastroenterol Hepatol, 2019, 28(5): 568-572. DOI:10.3969/j.issn.1006-5709 |
| [12] |
Wang R, Peng S, Zhang X, et al. Inhibition of NF-κB improves sensitivity to irradiation and EGFR-TkTs and decreases irradiation-induced lung toxicity[J]. Int J Cancer, 2019, 144(1): 200-209. DOI:10.1002/ijc.31907 |
| [13] |
Yen CC, Chang WH, Tung MC, et al. Lactoferrin protects hyperoxia-induced lung and kidney systemic inflammation in an in vivo imaging model of NF-κB/luciferase transgenic mice[J]. Mol Imaging Biol, 2020, 22(3): 526-538. DOI:10.1007/s11307-019-01390-x |
 2021, Vol. 41
2021, Vol. 41


