2. 四川省肿瘤医院·研究所 四川省癌症防治中心 电子科技大学医学院放射肿瘤学四川省重点实验室, 成都 610041;
3. 四川大学华西第二医院妇产科 西部妇幼研究院出生缺陷与相关妇儿疾病教育部重点实验室, 成都 610041
2. Sichuan Cancer Hospital & Institute, Sichuan Cancer Center, School of Medicine, University of Electronic Science and Technology of China, Radiation Oncology Key Laboratory of Sichuan Province, Chengdu 610041, China;
3. Department of Gynecology and Obstetrics, West China Second University Hospital, Sichuan University, Key Laboratory of Obstetrics & Gynecologic and Pediatric Diseases and Birth Defects of Ministry of Education, West China Second University Hospital, Sichuan University, Chengdu 610041, China
核磁加速器(MR-Linac)的出现使得磁共振图像引导的放疗技术(MRI guided radiotherapy)得以实现[1-2],并逐步开始应用于肿瘤放射治疗。在该技术广泛应用于临床之前,CBCT图像引导的放疗技术仍占主流。磁共振图像(MRI)具备很强的软组织对比度和功能影像信息,可以明显辨别软组织之间的边界,对于勾画肿瘤组织与周围正器官起到了不可或缺的作用。然而,由于MRI缺乏电子密度和信号强度之间的对应关系,不能直接在放疗计划系统上进行剂量计算。本研究使用CT图像模拟MRI,避免了两种图像融合来勾画靶区造成的误差,以及MRI产生的图像扭曲误差;通过在放疗计划系统中对CT里的器官人为指定体电子密度或者相对电子密度(relative electron density,RED),计算剂量后与原参考计划进行比较,分析该方法对计划剂量准确度的影响,为以后将MRI直接用来进行放疗计划计算提供了方法。
资料与方法1. 患者资料:回顾性分析2018—2019年在成都市第二人民医院确诊并接受放射治疗的20例宫颈癌患者的放疗计划,患者年龄24~60岁(平均年龄42岁),其中腺癌10例(ⅠA~ⅡB期),鳞腺癌10例(ⅠA~ⅣB期)。
2. 计划设计:每位患者的原治疗计划作为参考计划(Planref),根据研究需要重新生成一个符合临床处方剂量的计划(PlanRED)。具体如下:放疗计划系统为Monaco5.11版本,对危及器官的剂量限值如下:膀胱V40 Gy < 40%,直肠V40 Gy < 40%,小肠V30 Gy < 30%, 骶骨和髂骨的平均剂量Dmean < 26 Gy。根据选取的病例,18例患者靶区的剂量处方为45 Gy/25次,另外2例患者的靶区剂量处方为50 Gy/28次。制定放疗计划的基本原则是在保证处方剂量覆盖靶区体积95%以上的前提下(即D95≥处方剂量),尽可能压低正常组织的受量。在Monaco计划系统中的勾画模块中使用手动填充相对电子密度(relative electron density, RED)的方法,对所有靶区和危及器官赋予各自的平均电子密度,并计算剂量。新计划与参考计划的剂量限值条件和射野参数保持一致,采用双全弧(CCW 179°~181°, CW 181°~179°) 的容积旋转调强放疗技术(VMAT)进行照射[3-5],使用子野形状优化方法(segment shape optimization) 和存储剂量片段方法(pilot beamlets),计算网格为0.3 cm×0.3 cm× 0.3 cm,最小子野宽度0.6 cm。
3. 各器官电子密度:国际辐射单位与测量委员会(ICRU)46号报告提供了人体各组织的电子密度[6],通过计算得到RED:膀胱、直肠、小肠、股骨头、髂骨、肝脏、脊髓的RED分别为1.027、1.024、1.024、1.270、1.270、1.051、1.036。其他正常组织的电子密度取为水的等效密度即1.000。肿瘤组织的电子密度由病理科样本数据分析得出为1.012。
4. 评估指标:统计的剂量参数包括所有靶区的D98、D2、平均剂量Dmean[6],危及器官如膀胱,直肠、小肠的Dmean、最大剂量(D1 cm3), 30 Gy、40 Gy剂量覆盖的相对体积V30、V40;两组计划的子野总数,跳数。
5. 统计学处理:使用SPSS 25.0进行数据分析。数据经正态性检验,符合正态分布的用x±s表示,采用配对t检验;不符合正态分布的采用Wilcoxon符号秩和检验。P < 0.05为差异有统计学意义。
结果1. DVH剂量学参数比较:结果见表 1。计划临床靶区阴道残端(PCTV1)的剂量参数在PlanRED中比Planref计划组高出0.1%~0.2%(P>0.05),计划临床靶区宫旁组织(PCTV2)的剂量差异性在0.6%~0.7%,计划临床靶区淋巴结引流区(PCTVln)的偏差在0.4%以内。手动植入电子密度使膀胱剂量增加了0.1%~0.3%(P>0.05);直肠与小肠的个别剂量参数(V20, V30)降低了0.1%~0.6%(P>0.05)。3个靶区PCTV1、PCTV2、PCTVln的平均体积分别为(149.7 ± 53.1)、(40.36 ± 30.8)、(609.3 ± 121.9) cm3,不排除剂量差异与体积之间的关联性,当前的数据统计表明体积越大,剂量参数之间的差异越小。此外,PCTV2的D2(t=4.875,P < 0.05)、D98(t= 4.002,P < 0.05)、Dmean(t=3.075,P < 0.05),PCTVln的D2(t=6.849,P < 0.05),差异具有统计学意义。PCTV2的体积在3个靶区中最小,剂量偏差略高,但平均差别仅在1%以内。
|
|
表 1 20例术后宫颈癌放疗计划植入体相对电子密度(RED)后靶区、危及器官剂量参数与原始计划之间的差异比较(%,x±s) Table 1 Percentage deviation of the dosimetric parameters between primary plans and bulk relative electron density treatment plans for postoperative cervical cancer (%, x±s) |
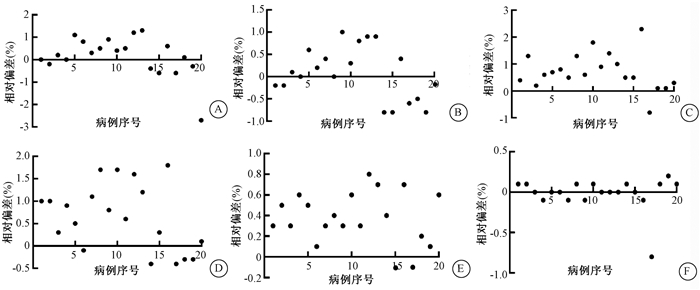
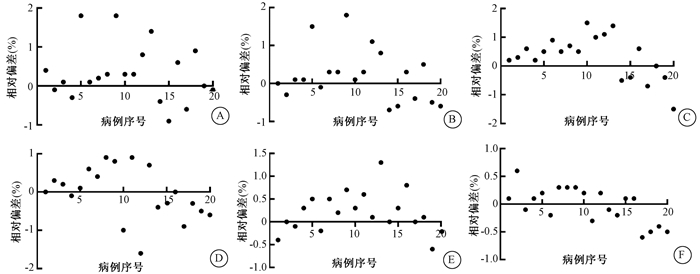
2. 散点图的分布:图 1和图 2以散点图的方式显示每例患者的放疗计划植入电子密度前后对靶区和危及器官剂量的影响。图 1为3个靶区的D2、D98在PlanRED和Planref中的偏差百分比,绝大多数参数处于1%范围以内。图 2为膀胱、直肠、小肠的D1 cm3、Dmean。图 2的(E)、(F)说明对于体积较大的小肠,剂量差异在1%以内,相比膀胱和小肠,直肠体积较小,D1 cm3、Dmean剂量偏差在2%以内。另外,图 1和图 2的大部分数值分布在横轴上方,即植入电子密度后生成的放疗计划剂量略微偏高(< 2%)。
|
A.PCTV1 D2;B. PCTV1 D98;C. PCTV2 D2;D. PCTV2 D98;E. PCTVln D2;F. PCTVln D98 图 1 每例患者两个计划的靶区剂量参数差异散点图 A.PCTV1 D2; B. PCTV1 D98; C. PCTV2 D2; D. PCTV2 D98; E. PCTVln D2; F. PCTVln D98 Figure 1 The scatter diagram for targets dosimetry parameters between two group plans for each patient |
|
A.膀胱D1 cm3;B. 膀胱Dmean; C. 直肠D1 cm3;D. 直肠Dmean;E. 小肠D1 cm3;F. 小肠Dmean 图 2 每例患者两个计划的危及器官部分剂量参数差异散点图 A. Bladder D1 cm3; B. Bladder Dmean; C. Rectum D1 cm3; D. Rectum Dmean; E. Intestine D1 cm3; F. Intestine Dmean Figure 2 The scatter diagram for OARs′ dosimetry parameters between two group plans for each patient |
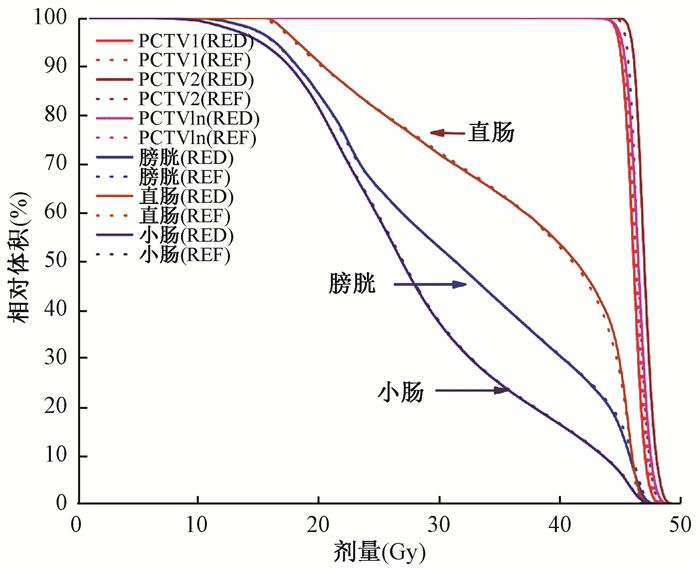
3. DVH曲线的比较:图 3为一代表性病例植入电子密度后生成的PlanRED与原始计划Planref DVH的比较,两种计划在的靶区以及危及器官直肠、膀胱、小肠的剂量曲线在宏观上表现为没有差别。PlanRED计划组与Planref计划组的平均跳数MU分别为1 080±146, 1 071±142,前者跳数比后者高出0.84%。由于PlanRED与Planref具有相同的优化通量,两者的子野总数相同。
|
图 3 植入体相对电子密度后生成的新计划(PlanRED)与原始计划(Planref)的DVH比较 Figure 3 The DVH comparison between new plan (PlanRED) generated by bulk electron density and original plan (Planref) |
讨论
与CT比较而言,MRI能够提供对于不同器官组织更加清晰的的对比度。由于技术原因,放射治疗暂时无法将MRI作为单独的图像模式使用,原因之一在于MRI缺乏支持计划系统剂量计算的电子密度信息。随着Monaco放疗计划系统的升级,可以在器官组织模块中赋予各个器官相对电子密度,实现了MRI用于剂量计算的目的[2, 7-8]。尝试性的方法是将体相对电子密度逐一手动植入计划系统的所有器官或者部分器官,这取决于肿瘤部位周围器官的数量,或者该区域的电子密度均匀性。文献报道对于体电子密度较为均匀的头部和腹部对所有组织采用相同的人体密度1.0 g/cm3,与常规计划的剂量偏差在2%以内,符合临床要求[9-14]。Karotki等[15]对于异质性明显的部位如头顶部(HN)肿瘤进行了研究,如果对周围器官只赋予相同的体电子密度(1 g/cm3)生成的放疗计划,有80%的患者剂量偏差超过了2%,而将空腔,骨头的密度赋与相应的电子密度后(空腔:0 g/cm3,骨头:1.5 g/cm3),剂量偏差降至2%以内。Prior等[8]使用CT模拟MRI, 将肺、骨头、心脏,以及其他胸部组织的体电子密度填入计划系统并计算了肿瘤位于纵隔膜和肺部外围边缘的VMAT计划,结果显示剂量偏差>5%,认为该方法不适用肺部肿瘤的放疗计划。Prior等[7]研究了体电子密度在对胰腺癌和前列腺癌治疗计划剂量的影响,并引入了磁场存在的因素,结果显示该方法对靶区和危及器官的剂量偏差分别为3%和5%以内,认为在基于MRI-only的调强计划中使用来自ICRU 46号报告导出的体电子密度来支持剂量计算是可行的。
本研究中,为了避免同一患者CT与MRI之间解剖学上的误差,使用CT代替MRI,从ICRU 46号报告查询到腹部各个器官的绝对电子密度并转换为相对电子密度植入Monaco计划系统,在保持了原始计划通量的基础上重新计算剂量,并使两种计划靶区有相同的归一处方剂量。文献报道的研究中一般只有一个靶区,本文的研究对象为术后宫颈癌,包含淋巴结引流区、宫旁、阴道残端3个靶区,以靶区和膀胱、直肠、小肠的若干剂量参数为对比指标。20例患者靶区所有的剂量参数平均值与原始计划的偏差 < 0.7%,只有患者16号PCTV2的D2与20号PCTV1的D2分别为2.3%、-2.7%。对膀胱、直肠、小肠的剂量影响同样很小,98%的数据在2%以内,每个器官剂量参数的平均偏差 < 0.6%。10和12病例的直肠V30显示异常,分别为-7.8%和-4.1%,这是因为直肠体积相对较小,低剂量的绝对数值之间很小的差别可以呈现很大的百分比,文献报道中遇到了相同的现象[6, 16-17]。PlanRED的跳数比Planref平均高0.9%,子野总数没有变化。所有参数两组计划差异无统计学意义。
本文中使用的体电子密度适用于大多数种群的各器官平均值,对于个体化差异明显的患者放疗计划另需研究,此外,靶区和危及器官勾画的准确是影响剂量计算和放疗精确性的另一原因。国内外文献尚无对宫颈癌放疗计划进行电子密度赋值研究其剂量准确性,对于头颈部及胸部的文献表明给予各个器官赋值电子密度方法生成的计划在临床上可以接受[18]。综上所述对于术后宫颈癌的放射治疗计划,在计划系统中植入适当的体电子密度生成的放疗计划,可供临床参考使用。
利益冲突 无
作者贡献声明 韩胜负责论文撰写;彭小东、袁珂、廖雄飞、王先良负责材料收集;尹如铁、陈亚正负责指导和修改论文;张磊、刘敏、毕斌负责数据采集和处理
| [1] |
Lagendijk JJ, Raaymakers BW, van Vulpen M. The magnetic resonance imaging-linac system[J]. Semin Radiat Oncol, 2014, 24(3): 207-209. DOI:10.1016/j.semradonc.2014.02.009 |
| [2] |
Chen YZ, Chen XF, Hall W, et al. A preferred patient decubitus positioning for magnetic resonance image guided online adaptive radiation therapy of pancreatic cancer[J]. Phys Imaging Radiat Oncol, 2019, 12: 22-29. DOI:10.1016/j.phro.2019.11.001 |
| [3] |
王雪桃, 肖江洪, 赵建玲, 等. 基于RayStation计划系统的宫颈癌容积旋转调强自动计划设计[J]. 中华放射医学与防护杂志, 2018, 38(10): 751-755. Wang XT, Xiao JH, Zhao JL, et al. Evaluation of fully automated volumetric modulated arc therapy planning of cervical cancer in RayStation treatment planning system[J]. Chin J Radiol Med Prot, 2018, 38(10): 751-755. DOI:10.3760/cma.j.issn.0254-5098.2018.10.006 |
| [4] |
杨瑞杰, 王俊杰. 旋转调强放疗计划和实施技术进展[J]. 中华放射医学与防护杂志, 2012, 32(3): 331-334. Yang RJ, Wang JJ. Progress in the planning and implementation of rotary intensity modulated radiotherapy[J]. Chin J Radiol Med Prot, 2012, 32(3): 331-334. DOI:10.3760/cma.j.issn.0254-5098.2012.03.029 |
| [5] |
Bai W, Kou C, Yu W, et al. Dosimetric comparison of volumetric-modulated arc therapy and intensity-modulated radiation therapy in patients with cervical cancer: a meta-analysis[J]. Onco Targets Ther, 2018, 11: 7179-7186. DOI:10.2147/OTT.S178336 |
| [6] |
International Commission on Radiation Units and Measurements. Report 46. Photon, electron, proton and neutron interaction data for body tissues[R]. Bethesda: ICRU, 1992.
|
| [7] |
Prior P, Chen X, Botros M, et al. MRI-based IMRT planning for MR-linac: comparison between CT- and MRI-based plans for pancreatic and prostate cancers[J]. Phys Med Biol, 2016, 61: 3819-3842. DOI:10.1088/0031-9155/61/10/3819 |
| [8] |
Prior P, Chen X, Gore E, et al. Technical note: Is bulk electron density assignment appropriate for MRI-only based treatment planning for lung cancer[J]. Med Phys, 2017, 44: 3437-3743. DOI:10.1002/mp.12267 |
| [9] |
Karotki A, Mah K, Meijer G, et al. Comparison of bulk electron density and voxel-based electron density treatment planning[J]. J Appl Clin Med Phys, 2011, 12(4): 3522. DOI:10.1120/jacmp.v12i4.3522 |
| [10] |
Prior P, Chen X, Botros M, et al. MRI-based IMRT planning for MR-linac: comparison between CT- and MRI-based plans for pancreatic and prostate cancers[J]. Phys Med Biol, 2016, 61(10): 3819-3842. DOI:10.1088/0031-9155/61/10/3819 |
| [11] |
Kristensen BH, Laursen FJ, Løgager V, et al. Dosimetric and geometric evaluation of an open low-field magnetic resonance simulator for radiotherapy treatment planning of brain tumours[J]. Radiother Oncol, 2008, 87(1): 100-109. DOI:10.1016/j.radonc.2008.01.014 |
| [12] |
Prabhakar R, Julka PK, Ganesh T, et al. Feasibility of using MRI alone for 3D radiation treatment planning in brain tumors[J]. Jpn J Clin Oncol, 2007, 37(6): 405-411. DOI:10.1093/jjco/hym050 |
| [13] |
Beavis AW, Gibbs P, Dealey RA, et al. Radiotherapy treatment planning of brain tumours using MRI alone[J]. Br J Radiol, 1998, 71(845): 544-548. DOI:10.1259/bjr.71.845.9691900 |
| [14] |
Stanescu T, Jans HS, Pervez N, et al. A study on the magnetic resonance imaging (MRI)-based radiation treatment planning of intracranial lesions[J]. Phys Med Biol, 2008, 53(13): 3579-3593. DOI:10.1088/0031-9155/53/13/013 |
| [15] |
Karotki A, Mah K, Meijer G, et al. Comparison of bulk electron density and voxel-based electron density treatment planning[J]. J Appl Clin Med Phys, 2011, 12(4): 97-104. DOI:10.1120/jacmp.v12i4.3522 |
| [16] |
AhnesjöA, Aspradakis MM. Dose calculations for external photon beams in radiotherapy[J]. Phys Med Biol, 1999, 44(11): R99-155. DOI:10.1088/0031-9155/44/11/201 |
| [17] |
Prior P, Chen X, Botros M, et al. MRI-based IMRT planning for MR-linac: comparison between CT- and MRI-based plans for pancreatic and prostate cancers[J]. Phys Med Biol, 2016, 61(10): 3819-3842. DOI:10.1088/0031-9155/61/10/3819 |
| [18] |
Andreasen D, Van Leemput K, Hansen RH, et al. Patch-based generation of a pseudo CT from conventional MRI sequences for MRI-only radiotherapy of the brain[J]. Med Phys, 2015, 42(4): 1596-1605. DOI:10.1118/1.4914158 |
| [19] |
Dowling JA, Lambert J, Parker J, et al. An atlas-based electron density mapping method for magnetic resonance imaging (MRI)-alone treatment planning and adaptive MRI-based prostate radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1): e5-11. DOI:10.1016/j.ijrobp.2011.11.056 |
 2021, Vol. 41
2021, Vol. 41


