2. 中国医学科学院北京协和医学院放射医学研究所 天津市放射医学与分子核医学重点实验室, 天津 300192;
3. 吉林农业大学中药材学院, 长春 130118;
4. 民航东北地区管理局民用航空医学中心, 沈阳 110066
2. Chinese Academy of Medical Sciences, Peking Union Medical College, Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine, Institute of Radiation Medicine, Tianjin 300192, China;
3. College of Chinese Medicine Materials, Jilin Agricultural University, Changchun 130118, China;
4. Civil Aviation Medical Center of CAAC Northeast Regional Administration, Shenyang 110066, China
目前放射性皮肤损伤的无创评估方式,主要是通过肉眼观察,采用急性放射损伤分级标准评级,但这些方法主观性大,对表皮和真皮病理状态缺乏客观表征。双光子激发荧光(two-photon excitation fluorescence,TPEF)成像技术由于组织穿透性强、能量低、灵敏度高,可以对活体组织中内源性荧光基团[1-2]直接成像,克服传统免疫组织化学和免疫荧光染色技术切片、染色和标记抗体的缺点,在皮肤疾病诊断和药效评估方面越来越受到关注和重视。在皮肤组织中含有大量内源性荧光基团,如尼克酰胺腺嘌呤二核苷酸(磷酸)[nicotinamide adenine dinucleotide, NAD(P)H]、胶原纤维等[3-4],因此,皮肤组织不需要任何处理,TPEF成像技术就可以直接原位对内源性荧光基团的物质成像。
本实验通过TPEF成像技术无创、活体检测不同剂量X射线照射皮肤后大鼠表皮颗粒层、棘层和基底层细胞NAD(P)H信号损伤和修复的病理变化,并进一步研究乳头层和网状层胶原纤维信号的变化特点,同时观察不同剂量X射线在不同时间皮肤损伤程度,为放射性皮肤损伤预防和药物开发提供依据。
材料与方法1. 实验动物、材料及仪器:24只雄性SD大鼠,体重230~250 g,由北京华阜康生物科技股份有限公司提供,合格证号:SCXK(京)2019-0010。饲养于12 h光照/12 h黑暗的环境中,自由摄食和饮水。异氟烷(深圳市瑞沃德生命科技有限公司);双光子显微镜(日本Olympus公司);X射线辐射仪(美国Rad source科技有限公司)。
2. 动物分组及实验模型制备:将SD大鼠采用随机数表法分为4组,即健康对照组、25 Gy照射组(25 Gy组)、35 Gy照射组(35 Gy组)、45 Gy照射组(45 Gy组),每组6只。实验前1天SD大鼠臀部剃毛面积约为2 cm×2 cm。第2天麻醉后应用X射线辐射仪按照25、35和45 Gy X射线剂量进行照射,吸收剂量率为4 Gy/min,健康对照组仅作剃毛处理。TPEP成像扫描参数,步进2.5 μm,图像采集像素1 024×1 024,采集速度4 μm/像素。
3. TPEP成像技术检测表皮细胞NAD(P)H荧光信号:分别在X射线照射5、10、15、20、25、30和35 d,各组大鼠经异氟烷麻醉后固定于双光子显微镜载物台上,采用激发波长为750 nm,数值孔径为1.05的25倍水浸显微物镜对皮损中心部位NAD(P)H荧光信号进行扫描,观察表皮颗粒层、棘层和基底层细胞荧光信号的病理变化。
4. TPEP成像技术检测真皮胶原纤维荧光信号:分别在X射线照射后不同时间,各组大鼠麻醉后固定于双光子显微镜载物台上,采用激发波长850 nm,数值孔径为1.05的25倍水浸显微物镜对皮损中心部位胶原纤维进行z轴扫描,观察乳头层和网状层胶原纤维荧光信号的变化。
5. 统计学处理:采用SPSS 22.0软件进行统计分析。正态分布数据采用x±s表示。方差齐性时采用单因素方差分析及LSD-t检验,方差不齐时采用Dunnett-t检验。P < 0.05为差异有统计学意义。
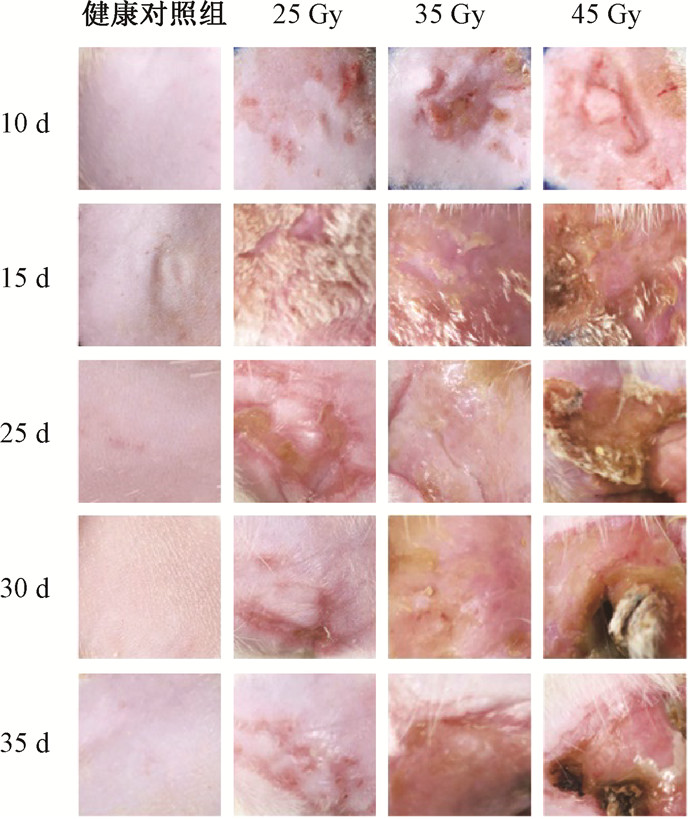
结果1. 皮肤损伤变化:X射线照射第5天,各组皮肤外观基本没有变化。第10天,各剂量组大鼠均出现红斑和脱皮。第15天,25 Gy组皮肤出现红斑,35和45 Gy组出现明显红斑和渗出,45 Gy组兼有溃疡。25 Gy组第20天出现红斑、水肿和渗出,第25天开始愈合。第20~30天,35和45 Gy组照射后均出现渗出、水肿和溃疡。第35天,25 Gy组皮肤局部有淡红斑,35 Gy组损伤周围皮肤愈合,45 Gy组中间仍有渗出和溃疡,见图 1。
|
图 1 不同剂量X射线引起大鼠皮肤损伤的成像图 Figure 1 Images of rat skin damage caused by different doses of X-rays |
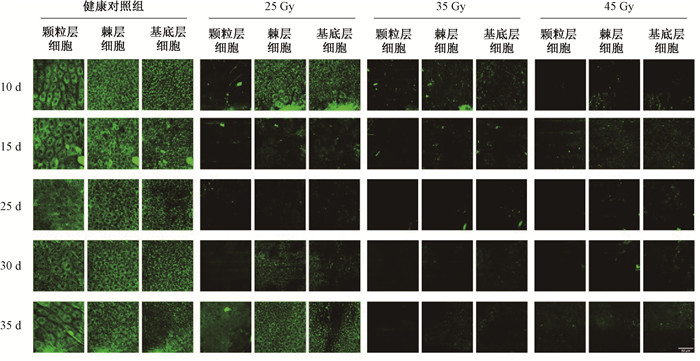
2. TPEF成像技术检测不同剂量X射线引起大鼠表皮细胞NAD(P)H荧光信号的变化:X射线照射第5天,表皮颗粒层细胞NAD(P)H荧光信号较强,各组之间没有明显变化。第10天,25 Gy组颗粒层细胞NAD(P)H明显降低,棘层和基底层部分细胞有NAD(P)H荧光信号,35和45 Gy组没有发现荧光信号。第15~25天,各剂量组颗粒层、棘层和基底层细胞均没有NAD(P)H荧光信号。第30天,25 Gy组颗粒层出现微弱的信号,棘层和基底层细胞出现较强NAD(P)H荧光信号,35和45 Gy组没有发现荧光信号。这些结果说明X射线照射后10 d颗粒层、棘层和基底层细胞NAD(P)H信号减少,第30~35天,25 Gy组颗粒层、棘层和基底层细胞NAD(P)H信号逐渐出现,见图 2。
|
图 2 不同剂量X射线后不同时间大鼠表皮颗粒层、棘层和基底层细胞NAD(P)H荧光信号的表达 Figure 2 Expression of NAD (P) H fluorescence signals in rat epidermal granular layer, spinous layer and basal layer at different times after different doses of X-rays |
3. TPEP成像技术检测不同剂量X射线引起大鼠真皮胶原纤维荧光信号的变化
(1) 真皮乳头层胶原纤维荧光信号的变化:乳头层胶原纤维荧光信号见表 1。第5天,乳头层胶原纤维荧光信号较强,各组之间变化差异无统计学意义(P>0.05)。第10天,25、35和45 Gy组荧光信号均降低,与健康对照组比较,差异有统计学意义(t=24.145、28.303、26.989,P < 0.05)。第15~30天,3个剂量组荧光信号持续降低,与健康对照组比较,荧光信号均显著降低(t=40.701~176.352,P < 0.05)。第35天,25 Gy组乳头层胶原纤维荧光信号逐渐增多,35和45 Gy组荧光信号仍较弱,与健康对照组比较,荧光信号均明显降低(t=31.760、76.385、97.207,P < 0.05)。这些结果提示X射线照射第10天真皮乳头层胶原纤维信号减少,第35天,低剂量25 Gy组乳头层胶原纤维信号开始恢复。
|
|
表 1 不同剂量X射线照射后不同时间大鼠真皮乳头层胶原纤维荧光信号值的变化(x±s) Table 1 Changes of fluorescence signal values of collagen fibers in dermal papillary layer of rats at different time after different doses of X-ray irradiation(x±s) |
(2) 真皮网状层胶原纤维荧光信号的变化:第5天,网状层胶原纤维荧光信号较强,各剂量组之间差异无统计学意义(P>0.05)。第10天,随着照射剂量的增加,辐射组胶原纤维荧光信号呈递进性减少。第10~25天,与健康对照组比较,3组荧光信号降低差异均有统计学意义(t=5.968~ 62.631,P < 0.05)。第30~35天,25 Gy组网状层胶原纤维荧光信号逐渐增加,但3组荧光信号仍明显低于健康对照组(t=17.431~108.171,P < 0.05),见表 2。这提示X射线照射第10天真皮网状层胶原纤维荧光信号开始减少,第35天,低剂量组网状层胶原纤维信号开始恢复。
|
|
表 2 不同剂量X射线照射后不同时间大鼠真皮网状层胶原纤维荧光信号值的变化(x±s) Table 2 Changes of collagen fiber fluorescence signal value in rat dermal reticular layer at different time after different doses of X-ray irradiation(x±s) |
讨论
急性放射性皮肤损伤的造模方式常使用X、γ及β射线等,剂量多为单次大剂量的照射方式,剂量为10~60 Gy不等,目前暂无统一规范[5]。其中X射线波长范围大致从0.01到10 nm[6],是临床恶性肿瘤患者治疗最常使用的射线类型,所以本实验选择X射线照射SD大鼠,同时本实验选择大鼠臀部作为造模部位,目的是尽可能减少射线对动物内脏的影响。
研究发现射线引起皮肤的急性损伤,一般在放疗治疗几天后出现症状,表现为不同程度的原发性短暂性红斑、全身性红斑、皮肤干燥、脱发、色素沉着、干性脱皮、皮肤结垢和剥落、湿性脱皮[7]。不同剂量X射线造成的皮肤损伤严重程度不同,其中红斑、干性脱皮和湿性脱皮是皮肤损伤严重程度的重要指标。当辐射剂量达20 Gy时,皮肤出现皮肤瘙痒和剥落的干性脱皮[8];当辐射剂量超过30和40 Gy时,皮肤出现发红,伴有浆液性渗出物、出血性结痂的湿性脱皮[9]。关于干性脱皮,有研究认为皮肤受到较高辐射剂量时,皮肤试图通过增加基底细胞有丝分裂率来补偿角质形成细胞,但由于新细胞周转速度比旧细胞脱落快,因此导致皮肤变厚,干性脱皮[10]。但Trueman和Taylor[11]认为干性脱皮是由于基底层替代表层细胞能力下降造成表皮脱落,而且汗液和皮脂腺受损导致皮肤润滑减少等综合因素造成。湿性脱皮是皮肤在更高辐射剂量下,基底层细胞无法恢复和进行分裂,同时分泌液被释放而形成。本实验选择25、35和45 Gy作为照射剂量,观察在不同照射剂量下,大鼠皮肤损伤出现的症状。结果发现在25 Gy剂量下,皮肤损伤以红斑、水肿和脱皮为主,兼有少量渗出,35 Gy剂量下出现红斑、水肿和渗出,45 Gy剂量组除出现红斑和渗出外,还出现溃疡。同时本实验发现25 Gy照射剂量可引起放射性皮肤损伤的典型特点,且不会引起大鼠死亡,适合作为放射引起非溃疡性皮肤损伤的造模剂量。
放射性皮肤损伤和修复时间不同于切割伤和烧烫伤,本实验发现放射性皮肤损伤一般在第10天皮肤开始出现红斑和脱皮,10~20 d皮肤损伤症状逐渐加重,出现不同程度地渗出、水肿和溃疡,低剂量25 Gy组皮肤在25~30 d开始修复,而高剂量45 Gy组皮肤在第35天仍有溃疡,皮肤没有修复。同时,本实验发现在照射第10天,肉眼可见辐射组皮肤仅有红斑和脱皮,但采用TPEF成像技术发现其表皮细胞NAD(P)H荧光信号,真皮乳头层和网状层胶原纤维已经出现不同程度地病理变化,而在疾病愈合阶段,如第35天,35 Gy组皮肤肉眼发现已开始愈合,但表皮细胞NAD(P)H荧光信号,真皮乳头层和网状层胶原纤维仍然没有修复。这表明无创、活体的TPEF成像技术在评估X射线引起大鼠皮肤放射性损伤发展、修复过程和预后方面具有传统方法无法比拟的优势。
虽然目前对放射引起皮肤损伤的研究逐渐深入[12],但关于放射性皮肤损伤的预防和控制尚无金标准,究其原因可能仍缺乏对放射性皮肤损伤的认识。本实验通过TPEF成像技术观察辐射后表皮细胞和真皮胶原纤维发展和修复过程,建立在体、无创的评估方法,丰富前瞻性数据,为放射性皮肤损伤标准的建立以及药物的开发提供方法。
利益冲突 所有研究者声明不存在利益冲突
志谢 感谢中国中医科学院医学实验中心基本科研业务费(zz2018018)、中国医学科学院医学与健康科技创新工程项目(2016-I2M-3-022)、中央高校基本科研业务费专项资金(3332020057)对本研究的资助
作者贡献声明 贺改英负责实验操作和论文撰写;勾文峰负责实验操作;王毅负责实验设计;侯文彬指导研究设计;唐靖惠负责数据采集;马淑骅、孙娅楠、杨伟峰和方蔷负责分析数据和统计数据;李祎亮负责实验设计及论文修改
| [1] |
Theer P, Hasan MT, Denk W. Two-photon imaging to a depth of 1000 microm in living brains by use of a Ti: Al2O3 regenerative amplifier[J]. Optics Letters, 2003, 28(12): 1022-1024. DOI:10.1364/ol.28.001022 |
| [2] |
Chen AC, Mcneilly C, Liu AP, et al. Second harmonic generation and multiphoton microscopic detection of collagen without the need for species specific antibodies[J]. Burns, 2011, 37(6): 1001-1009. DOI:10.1016/j.burns.2011.03.013 |
| [3] |
Konig K, Riemann I. High-resolution multiphoton tomography of human skin with subcellular spatial resolution and picosecond time resolution[J]. J Biomed Opt, 2003, 8(3): 432-439. DOI:10.1117/1.1577349 |
| [4] |
Tsai TH, Lin SJ, Lee WR, et al. Visualizing radiofrequency-skin interaction using multiphoton microscopy in vivo[J]. J Dermatol Sci, 2012, 65(2): 95-101. DOI:10.1016/j.jdermsci.2011.10.011 |
| [5] |
张倩玉, 许斌, 张惠博, 等. SD大鼠急性放射性皮炎模型的建立[J]. 现代生物医学进展, 2018, 18(8): 1419-1424. Zhang QY, Xu B, Zhang HB, et al. Establishment of a SD rat model of acute radiation-induced skin reaction[J]. Prog Modern Biomed, 2018, 18(8): 1419-1424. DOI:10.13241/j.cnki.pmb.2018.08.004 |
| [6] |
Hegedus F, Mathew LM, Schwartz RA. Radiation dermatitis: an overview[J]. Int J Dermatol, 2017, 56(9): 909-914. DOI:10.1111/ijd.13371 |
| [7] |
Mendelsohn FA, Divino CM, Reis ED, et al. Wound care after radiation therapy[J]. Adv Skin Wound Care, 2002, 15(5): 216-224. DOI:10.1097/00129334-200209000-00007 |
| [8] |
McQuestion M. Evidence-based skin care management in radiation therapy: clinical update[J]. Semin Oncol Nurs, 2011, 27(2): e1-17. DOI:10.1016/j.soncn.2011.02.009 |
| [9] |
Zenda S, Ota Y, Tachibana H, et al. A prospective picture collection study for a grading atlas of radiation dermatitis for clinical trials in head-and-neck cancer patients[J]. J Radiat Res, 2016, 57(3): 301-306. DOI:10.1093/jrr/rrv092 |
| [10] |
Glover D, Harmer V. Radiotherapy-induced skin reactions: assessment and management[J]. Br J Nurs, 2014, 23(4): S28, S30-35. DOI:10.12968/bjon.2014.23.Sup2.S28 |
| [11] |
Trueman E, Taylor L. Using a soft-silicone dressing to treat moist desquamation[J]. Br J Nurs, 2014, 23(10): S32, S34-37. DOI:10.12968/bjon.2014.23.Sup10.S32 |
| [12] |
Singh M, Alavi A, Wong R, et al. Radiodermatitis: a review of our current understanding[J]. Am J Clin Dermatol, 2016, 17(3): 277-292. DOI:10.1007/s40257-016-0186-4 |
 2021, Vol. 41
2021, Vol. 41


