2. 首都医科大学附属北京朝阳医院皮肤科, 北京 100020
2. Department of Dermatology, Beijing Chaoyang Hospital, Capital Medical University, Beijing 100020, China
中波紫外线(UVB)照射可影响皮肤细胞中黑色素水平,并引起细胞发生早衰[1]。细胞早衰是指细胞在DNA损伤、氧化应激、抗肿瘤药物等因素作用下,发生增殖能力和生理功能的下降,同时细胞形态和功能发生变化,提前出现退行性改变,属于病理性衰老[2]。酪氨酸酶是黑色素合成过程中的关键酶,可促进酪氨酸转变为黑色素(melanin)[3]。褪黑素(melatonin, MT)是一种活性氧自由基(reactive oxygen species, ROS)清除剂,具有高抗氧化性和抗炎活性[4]。现有的研究中仅表明褪黑素具有抗氧化应激作用,且能抑制酪氨酸酶活性[5-6]。然而,褪黑素对细胞早衰及黑色素合成的影响尚未阐明。
目前,对日光性色素沉着的治疗主要单纯针对黑素细胞,然而治疗效果不理想且存在复色问题[7-8]。有新的研究表明,日光性色素沉着的根本诱因与角质形成细胞p53过表达引起的早衰相关[9]。因此,本研究以人永生化表皮角质形成(HaCaT)细胞为模型, 探索褪黑素对UVB照射后细胞早衰和黑色素合成的影响及机制。
材料与方法1. 仪器与试剂:SH4B-T紫外光疗仪(上海Sigma公司);Thermo Lab systems MK3酶标仪(美国Thermo Fisher Scientific公司);倒置相差显微镜及成像系统(日本Olympus公司);ChemiDoc型多功能成像系统(美国Bio-Rad公司)。褪黑素购自美国Sigma公司;胎牛血清、MEM/ EBSS培养基购自美国HyClone公司;磷酸缓冲盐溶液(PBS)为本实验室配制;β-半乳糖苷酶早衰染色试剂盒、放射免疫沉淀(radio-immunoprecipitation assay, RIPA)细胞裂解液和青霉素链霉素溶液均购自江苏碧云天公司;二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量试剂盒、增强化学发光液均购自美国Thermo Fisher Scientific公司;5×蛋白Loading Buffer购自北京鼎国生物公司;蛋白预染Marker购自美国Fermentas公司;磷酸酶抑制剂及蛋白酶抑制剂、p53抗体、TYR抗体、毛细血管扩张性共济失调突变激酶(ataxia telangiectasia-mutated kinase, ATM)抑制剂KU-55933、毛细血管扩张性共济失调Rad3相关激酶(ataxia telangiectasia and Rad3-related kinase, ATR)抑制剂VE-821和p53抑制剂PFT-α均购自英国Abcam公司;β-肌动蛋白抗体、二抗山羊抗兔抗体和山羊抗小鼠抗体均购自北京中杉金桥生物公司;HaCaT购自北京协和医学院细胞库。
2. 细胞照射与分组:将SH4B-T紫外光疗仪的发射光波长设置为311~313 nm,采用本单位TN-2340紫外线强度计校准剂量,照射时光源距离细胞约40 cm。将细胞分为未处理组、褪黑素处理组、UVB照射组和褪黑素+UVB组。褪黑素处理组和褪黑素+UVB组的HaCaT细胞先用10-5 mol/L褪黑素预处理12 h后,利用80 mJ/cm2UVB照射细胞,照后48和72 h检测细胞黑色素水平,照后72 h检测细胞早衰比例,p53和TYR蛋白表达。探索褪黑素调控UVB引起的细胞早衰和黑色素合成关系时,将HaCaT细胞细胞分为未处理组、PFT-α组、UVB组、UVB+PFT-α组、UVB+ATMi+ATRi组与UVB+MT组。加入10-9mol/LATM抑制剂KU-55933和ATR抑制剂VE-821预处理12 h抑制细胞早衰,用10-9 mol/L浓度的p53抑制剂PFT-α预处理12 h抑制p53介导的细胞早衰,用10-5mol/L浓度的褪黑素预处理12 h,80 mJ/cm2 UVB照射各处理组细胞,照后72 h检测细胞早衰比例和黑色素水平变化。
3. β-半乳糖苷酶早衰染色实验:将HaCaT细胞接种于96孔板中,10-5 mol/L褪黑素处理HaCaT细胞12 h后,进行80 mJ/cm2UVB照射,UVB照射后培养72 h,吸除培养液,用PBS洗涤1次,每孔加入100 μl β-半乳糖苷酶染色固定液,室温固定15 min。吸除固定液,用PBS洗涤3次后,每孔加入100 μl染色工作液,37℃孵育过夜,次日使用倒置相差显微镜及成像系统观察、拍照。使用Image Pro Plus软件分析照片中蓝染的吸光度与总面积的比值(A/ARE),用A /ARE表示早衰细胞的比例。
4. NaOH法检测黑色素水平:10-5 mol/L褪黑素处理HaCaT细胞12 h后,进行80 mJ/cm2UVB照射,UVB照后48和72 h收集细胞,PBS洗涤2次后加入1 mol/L的NaOH溶液,混匀后将混合液以每孔100 μl分至96孔板中,将96孔板在37℃温箱中孵育1 h,用酶标仪测定492 nm波长下各孔的吸光度,用吸光度(A)值衡量HaCaT细胞的黑色素水平。
5. 蛋白免疫印迹试验(Western blot)检测蛋白表达量:10-5 mol/L褪黑素处理HaCaT细胞12 h后,进行80 mJ/cm2UVB照射,照后72 h收集细胞,将加入磷酸酶抑制剂和蛋白酶抑制剂的RIPA细胞裂解液加入细胞中,冰浴振荡30 min裂解细胞,12 000 r/min,离心半径8.3 cm,离心10 min后取上清。取出1 μl上清液,使用BCA蛋白定量试剂盒测定上清液中目的蛋白浓度,并计算30 μg目的蛋白的体积。剩余上清液加入5×上样缓冲液,煮沸10 min将蛋白变性后可放置-20℃冰箱保存。制备12 %的聚丙烯酰胺凝胶,取出30 μg变性后的蛋白进行垂直电泳,将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,用5%脱脂奶粉封闭2 h,一抗及二抗孵育后采用增强化学发光法显影,使用ChemiDoc型多功能成像系统曝光成像,以β-肌动蛋白为内参,采集图像数据后用Image-Lab软件分析目的蛋白的表达水平。
6. 统计学处理:采用SPSS 24.0统计软件进行数据处理,计量数据符合正态分布,用x±s表示,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
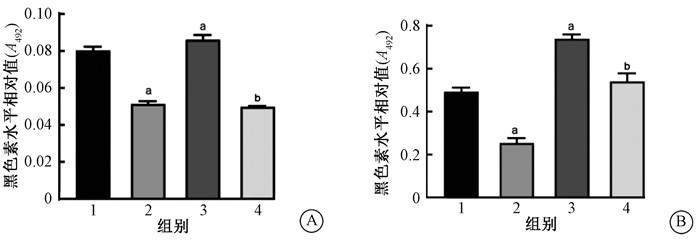
结果1. 褪黑素可抑制UVB诱导的HaCaT细胞黑色素水平升高:80 mJ/cm2 UVB照射褪黑素预处理的HaCaT细胞后48和72 h,结果如图 1所示,照后48和72 h两个时间点,HaCaT细胞黑色素水平变化趋势基本一致,即与未处理组相比,褪黑素处理组黑色素水平显著下降(t=50.23、32.94,P<0.05),UVB照射组黑色素水平显著升高(t=4.58、10.58,P<0.05);与UVB照射组相比,褪黑素+UVB组黑色素水平显著下降(t=56.65、13.39,P<0.05)。结果表明,UVB可诱导HaCaT细胞黑色素水平升高,褪黑素使得HaCaT细胞黑色素水平降低,因此,褪黑素可抑制UVB诱导的HaCaT细胞黑色素水平升高。
|
注:1.未处理组;2.褪黑素处理组;3.UVB照射组;4.褪黑素+UVB组。a与未处理组比较,t=50.23、4.58、32.94、10.58,P<0.05;b与UVB照射组比较,t= 56.65、13.39,P<0.05 图 1 80 mJ/cm2UVB照射褪黑素处理的HaCaT细胞后48 h(A)和72 h(B)黑色素水平变化 Figure 1 The changes of melanin levels in HaCaT cells treated with melatonin at 48 h(A) and 72 h(B) after 80 mJ/cm2 UVB irradiation |
2. 褪黑素抑制UVB诱导的HaCaT细胞黑色素水平升高由TYR所介导:80 mJ/cm2 UVB照射褪黑素处理的HaCaT细胞后72 h,结果如图 2所示,与未处理组相比,UVB照射后TYR蛋白表达增加(t=10.47,P<0.05);与未处理组相比,褪黑素+UVB组的TYR蛋白表达减少(t=16.24,P<0.05);与UVB照射组比,褪黑素+UVB组TYR蛋白表达为UVB照射组的50%(t=16.46,P<0.05)。提示褪黑素通过抑制UVB诱导的TYR表达增加,降低HaCaT细胞黑色素水平。

|
注:1.未处理组;2.褪黑素处理组;3.UVB照射组;4.褪黑素+UVB组。a与未处理组比较,t=10.47、16.24,P<0.05;b与UVB照射组比较,t= 16.46,P < 0.05 图 2 褪黑素对UVB诱导的TYR表达的影响 A. TYR蛋白表达;B. TYR蛋白表达定量分析 Figure 2 The protein expression of TYR in HaCaT cells treated with melatonin at 72 h after UVB irradiation A. Western blot assay of TYR protein; B. The quantitative analysis of abundance of TYR protein |
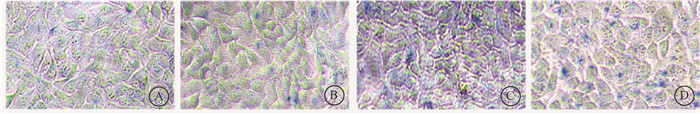
3. 褪黑素可抑制UVB诱导的HaCaT细胞早衰:结果如图 3所示,未处理组、褪黑素处理组、UVB照射组和褪黑素+UVB组的A/ARE均值依次为0.04、0.05、2.75和1.01。与未处理组相比,UVB照射组早衰阳性细胞比例显著增加(t=14.72, P<0.05);与UVB照射组相比,褪黑素+UVB组早衰阳性细胞比例显著减少,差异均有统计学意义(t=6.37, P<0.05)。结果表明,褪黑素可抑制UVB诱导的HaCaT细胞早衰比例增加。
|
图 3 褪黑素调控UVB诱导的HaCaT细胞早衰的β-半乳糖苷酶染色×200 A.未处理组;B.褪黑素处理组;C.UVB照射组;D.褪黑素+UVB组 Figure 3 The proportion of premature senescence detected by β-galactosidase staining in HaCaT cells treated with melatonin at 72 h after UVB irradiation ×200 A. Untreated group; B. Melatonin group; C. UVB group; D. Melatonin + UVB group |
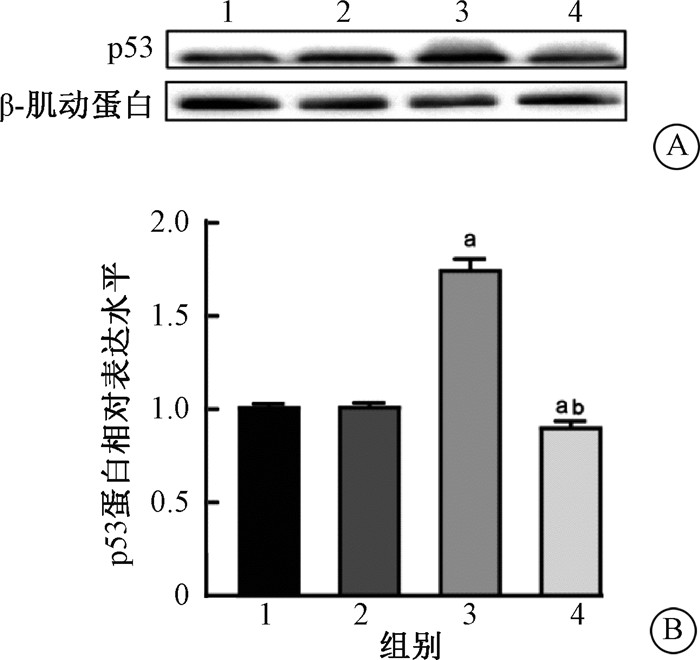
4. 褪黑素可抑制UVB照射后p53介导的HaCaT细胞早衰的发生:结果如图 4所示,与未处理组相比,UVB照射组p53蛋白表达增加(t=21.55, P<0.05);与UVB照射组相比,褪黑素+UVB组p53蛋白表达减少,差异均有统计学意义(t=19.08, P<0.05)。提示褪黑素可通过抑制UVB诱导的p53表达增加,减少HaCaT细胞p53介导的早衰。
|
注:1.未处理组;2.褪黑素处理组;3.UVB照射组;4.褪黑素+UVB组。a与未处理组比较,t=21.55、5.64,P<0.05;b与UVB照射组比较,t=19.08,P<0.05 图 4 褪黑素对UVB诱导的p53表达的影响 A. p53蛋白表达;B. p53蛋白表达定量分析 Figure 4 Influence of melatonin of the expression of p53 in HaCaT cells at 72 h after UVB irradiation A. Western blot assay of p53 protein; B. The quantitative analysis of abundance of p53 protein |
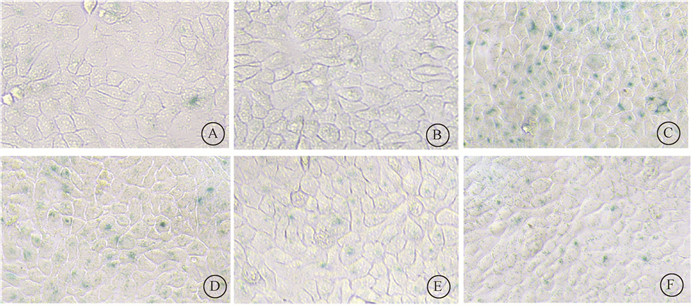
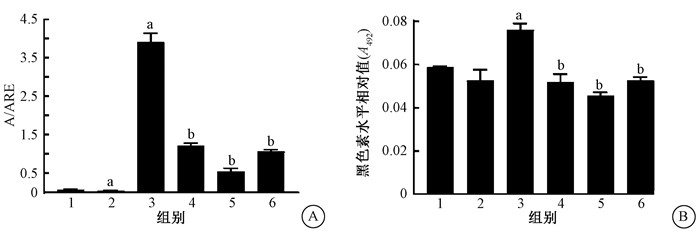
5. 褪黑素通过抑制p53介导的细胞早衰进而降低UVB照射后HaCaT细胞黑色素水平:UVB照射前分别抑制细胞早衰、抑制p53介导的早衰、褪黑素处理,检测调控细胞早衰后UVB对细胞黑色素水平的影响。细胞早衰的β-半乳糖苷酶染色结果如图 5所示,细胞早衰阳性比例如图 6A所示,NaOH法检测细胞黑色素水平结果如图 6B所示。与UVB组相比,UVB+ATMi+ATRi组的早衰阳性比例减少了86.15%(t=28.84,P<0.05),细胞黑色素水平下降了39.47%(t=13.88, P<0.05),说明抑制细胞早衰可以抑制UVB诱导的黑色素水平升高;与UVB组相比,UVB+PFT-α组的早衰阳性比例减少了68.97%(t=21.48,P<0.05),细胞黑色素水平下降了31.58%(t=7.86, P<0.05),表明抑制p53介导的细胞早衰可以抑制UVB诱导的黑色素水平升高;此外,与UVB组相比,UVB+MT组的早衰阳性比例减少了72.56%(t=18.08,P<0.05),细胞黑色素水平下降了30.26%(t=8.96,P<0.05),表明褪黑素通过抑制细胞早衰进而抑制UVB诱导的黑色素水平升高。综上,UVB+PFT-α组和UVB+MT组的细胞早衰减少及黑色素水平下降的百分比相近,提示褪黑素可能通过抑制p53介导的细胞早衰进而抑制UVB诱导的黑色素合成。
|
图 5 UVB照射后不同处理调控细胞早衰的β-半乳糖苷酶染色×200 A. 未处理组;B. PFT-α组;C. UVB组;D. UVB+PFT-α组;E. UVB+ATMi+ATRi组;F. UVB+MT组 Figure 5 β-galactosidase staining of premature senescence in HaCaT cells at 72 h after UVB irradiation ×200 A. Untreated group; B. PFT-α group; C. UVB group; D. UVB+PFT-α group; E. UVB+ ATMi+ATRi group; F. UVB+MT group |
|
注:1.未处理组;2.PFT-α组;3.UVB组;4.UVB+PFT-α组;5.UVB+ATMi+ATRi组;6.UVB+MT组。图A:a与未处理组比较,t=7.33、28.93,P<0.05;b与UVB照射组比较,t= 21.48、28.84、18.08,P<0.05;图B:a与未处理组比较,t=11.93,P<0.05;b与UVB照射组比较,t=7.86、13.88、8.96,P<0.05 图 6 UVB照射后通过调控细胞早衰对细胞黑色素水平产生影响 A.细胞早衰阳性电例分析;B.细胞黑色素水平 Figure 6 Regulation of premature senescence on melanin production in HaCaT cells at 72 h after UVB irradiation A. The proportion of the premature senescence; B. The changes of the melanin levels |
讨论
褪黑素是一种临床上用来治疗失眠、抗氧化和抗衰老的安全药物[4]。在不同细胞类型中,褪黑素对黑色素的影响是不同的。在人SK-MEL-1黑色素瘤细胞中,褪黑素促进黑色素的生成[10];在哺乳动物离体的毛囊,啮齿动物黑色素瘤细胞和人MNT-1黑色素瘤细胞中,褪黑素抑制黑色素的生成[11-12]。然而,褪黑素对皮肤细胞中黑色素的影响,目前尚未有相关研究。本研究发现,褪黑素可抑制HaCaT细胞中黑色素水平,同时,可抑制UVB诱导的黑色素水平增加,提示褪黑素在改善皮肤衰老相关色素沉着方面发挥一定作用。进一步检测黑色素合成关键酶TYR的表达变化,发现褪黑素抑制UVB诱导的TYR表达增加,提示褪黑素通过调控HaCaT细胞中TYR的表达影响UVB作用后黑色素的生成。这与Kim等[6]报道的褪黑素通过抑制UVB照射后的黑素细胞中酪氨酸酶活性,进而抑制黑色素合成的结果一致。
前期研究发现,UVB可诱导HaCaT细胞发生早衰[3]。有研究表明,褪黑素可保护HaCaT细胞和黑素细胞免受UVB诱导的氧化应激损伤[13-14],但褪黑素对UVB引起的细胞早衰的作用尚未阐明。本研究表明,褪黑素可缓解UVB诱导的HaCaT细胞发生早衰。进一步对早衰相关蛋白p53蛋白表达水平进行检测,发现褪黑素可抑制UVB照射后的p53表达增加,提示褪黑素可抑制UVB照射后p53介导的细胞早衰增加。
以往研究报道UVB可诱导p53表达增加,已知p53可直接结合于TYR的启动子上,启动TYR基因的表达,进而促进黑素细胞黑色素合成[15]。本课题组正在进行的另一项研究中使用黑素细胞模型,也初步验证了UVB诱导的p53表达正调控TYR的表达,并发现褪黑素抑制UVB诱导的p53表达,进而抑制了TYR的表达。本研究结果表明,在HaCaT细胞中,褪黑素抑制UVB诱导的p53表达增加,同时抑制TYR表达增加及黑色素水平升高;进一步研究发现,抑制细胞早衰、抑制p53介导的早衰和褪黑素处理均可以抑制UVB诱导的HaCaT细胞黑色素水升高,且褪黑素的效应和p53抑制剂的效应程度相当。因此,提示褪黑素通过抑制p53介导的细胞早衰进而抑制UVB诱导的TYR介导的黑色素合成。本研究未在HaCaT细胞中验证UVB诱导的p53表达对TYR表达的直接调控作用,进一步的研究将探索p53和TYR之间的具体调控机制,同时,进一步在黑素细胞中探索和验证本研究报道的褪黑素在皮肤细胞中的调控作用。总体可见,褪黑素在HaCaT细胞中通过p53早衰信号通路发挥抗衰老和减少色素沉着的积极作用。
利益冲突 无
作者贡献声明 马丽萍负责实验和论文撰写; 刘青杰、田梅指导论文修改; 田雨汀参与实验设计; 刘方、高玲提供研究思路和指导论文修改
| [1] |
闫娟, 刘青杰, 田梅, 等. 中波紫外线照射后HaCaT细胞早衰和P53、P16表达研究[J]. 中华放射医学与防护杂志, 2020, 40(4): 284-289. Yan J, Liu QJ, Tian M, et al. Premature senescence and the protein expressions of P53 and P16 in HaCaT cells after UVB exposure[J]. Chin J Radiol Med Prot, 2020, 40(4): 284-289. DOI:10.3760/cma.j.issn.0254-5098.2020.04.007 |
| [2] |
何艳, 刘静. 细胞衰老及其在抗肿瘤研究中的应用[J]. 生命科学, 2010, 22(5): 411-415. He Y, Liu J. Cell senescence and its critical role in antitumor research[J]. Chin Bull Life Sci, 2010, 22(5): 411-415. DOI:10.13376/j.cbls/2010.05.003 |
| [3] |
Choi SY, Bin BH, Kim W, et al. Exposure of human melanocytes to UVB twice and subsequent incubation leads to cellular senescence and senescence-associated pigmentation through the prolonged p53 expression[J]. J Dermatol Sci, 2018, 90(3): 303-312. DOI:10.1016/j.jdermsci.2018.02.016 |
| [4] |
Lerner AB, Lerner MR. Congenital and hereditary disturbances of pigmentation[J]. Bibl Paediatr, 1958(66): 308-313. |
| [5] |
Liao N, Shi Y, Zhang C, et al. Antioxidants inhibit cell senescence and preserve stemness of adipose tissue-derived stem cells by reducing ROS generation during long-term in vitro expansion[J]. Stem Cell Res Ther, 2019, 10(1): 306. DOI:10.1186/s13287-019-1404-9 |
| [6] |
Kim TK, Lin Z, Tidwell WJ, et al. Melatonin and its metabolites accumulate in the human epidermis in vivo and inhibit proliferation and tyrosinase activity in epidermal melanocytes in vitro[J]. Mol Cell Endocrinol, 2015, 404: 1-8. DOI:10.1016/j.mce.2014.07.024 |
| [7] |
Bastiaens M, Hoefnagel J, Westendorp R, et al. Solar lentigines are strongly related to sun exposure in contrast to ephelides[J]. Pigment Cell Res, 2004, 17(3): 225-229. DOI:10.1111/j.1600-0749.2004.00131.x |
| [8] |
Imhof L, Dummer R, Dreier J, et al. A prospective trial comparing Q-switched Ruby laser and a triple combination skin-lightening cream in the treatment of solar lentigines[J]. Dermatol Surg, 2016, 42(7): 853-857. DOI:10.1097/DSS.0000000000000793 |
| [9] |
Barysch MJ, Braun RP, Kolm I, et al. Keratinocytic malfunction as a trigger for the development of solar lentigines[J]. Dermatopathology (Basel), 2019, 6(1): 1-11. DOI:10.1159/000495404 |
| [10] |
Kleszczyński K, Kim TK, Bilska B, et al. Melatonin exerts oncostatic capacity and decreases melanogenesis in human MNT-1 melanoma cells[J]. J Pineal Res, 2019, 67(4): e12610. DOI:10.1111/jpi.12610 |
| [11] |
Slominski A, Pruski D. Melatonin inhibits proliferation and melanogenesis in rodent melanoma cells[J]. Exp Cell Res, 1993, 206(2): 189-194. DOI:10.1006/excr.1993.1137 |
| [12] |
Perdomo J, Quintana C, González I, et al. Melatonin induces melanogenesis in human SK-MEL-1 melanoma cells involving glycogen synthase kinase-3 and reactive oxygen species[J]. Int J Mol Sci, 2020, 21(14): 4970. DOI:10.3390/ijms21144970 |
| [13] |
Janjetovic Z, Nahmias ZP, Hanna S, et al. Melatonin and its metabolites ameliorate ultraviolet B-induced damage in human epidermal keratinocytes[J]. J Pineal Res, 2014, 57(1): 90-102. DOI:10.1111/jpi.12146 |
| [14] |
Janjetovic Z, Jarrett SG, Lee EF, et al. Melatonin and its metabolites protect human melanocytes against UVB-induced damage: Involvement of NRF2-mediated pathways[J]. Sci Rep, 2017, 7(1): 1274. DOI:10.1038/s41598-017-01305-2 |
| [15] |
Khlgatian MK, Hadshiew IM, Asawanonda P, et al. Tyrosinase gene expression is regulated by p53[J]. J Invest Dermatol, 2002, 118(1): 126-132. DOI:10.1046/j.0022-202x.2001.01667.x |
 2021, Vol. 41
2021, Vol. 41


