2. 吉林大学中日联谊医院核医学科, 长春 130033;
3. 中国疾病预防控制中心辐射防护与核安全医学所 辐射防护与核应急中国疾病预防控制中心重点实验室, 北京 100088
2. Department of Nuclear Medicine, China-Japan Union Hospital of Jilin University, Changchun 130033, China;
3. Key Laboratory of Radiological Protection and Nuclear Emergency, China CDC, National Institute for Radiological Protection, Chinese Center for Disease Control and Prevention, Beijing 100088, China
甲状腺癌是常见的内分泌和头颈部的恶性肿瘤,在过去几十年中,除受诊断技术条件限制的国家,甲状腺癌的发病率在世界各地呈逐年上升趋势[1-2]。甲状腺癌是我国女性30岁前最常见的癌症之一,且其发病率为我国癌症发病率增幅最大的疾病之一[3]。其中分化型甲状腺癌(differentiated thyroid cancer,DTC)约占所有甲状腺恶性肿瘤的90%以上[4-5]。目前,对于分化型甲状腺癌的治疗方式主要包括甲状腺切除术、131I放射性治疗及促甲状腺激素抑制治疗3种[6]。131I放射性治疗作为DTC患者术后重要的综合治疗措施之一,能有效降低患者疾病的复发率和肿瘤相关死亡风险,提高大部分患者生存率并改善其生活质量[7-9]。但131I是一种对医务人员、公众及患者家属可能带来危害的非密封放射性核素,患者给药治疗后131I在其体内释放γ射线和β射线,且其物理半衰期相对较长,会对周围人群产生外照射,同时服药后患者的唾液、汗液、大小便均存在放射性,可对周围环境造成污染[10-11]。为了避免患者对周围人群及环境造成辐射危害,131I治疗后的DTC患者需住院隔离,而患者体内剩余放射性活度、周围剂量当量率高低以及接触人群所受辐射剂量等因素决定了患者需住院隔离时间的长短。
本研究通过测量131I治疗DTC患者的体内放射性活度和周围剂量当量率,分析测量结果及二者之间的关系,以400 MBq为节点比较点源模型估算的患者剂量当量率与实际测量结果的差异并且估算人体自身对剂量当量率影响的修正因子,以期为评估DTC患者住院隔离时间及对周围接触人群和环境的剂量影响提供参考。
资料与方法1. 患者资料:研究对象为2020年7月至2020年8月期间在吉林省某三甲医院核医学科接受131I辅助治疗的43例DTC患者。全部患者均为甲状腺全切术后,首次行131I“清甲”治疗,其中男8例,女35例,年龄为18~68岁,平均年龄(43±11)岁。口服131I活度为1 850~3 700 MBq,平均服药量(2 405±777)MBq,其中服1 850 MBq者27例,2 960 MBq者7例,3 700 MBq者9例。所有患者均签署了知情同意书。
2. 体内放射性活度的测定方法:分别于患者服131I后的2、6、20、22、24、27、30、44、46、48、54、68及72 h,呼叫患者到专门的活度测量室,利用北京格物时代科技发展有限公司生产的Explore WB Scan全身动态辐射监测系统,对其进行体内剩余放射性活度的测定,测量下限为37 MBq。患者到活度测量室后,位于操作间的实验人员通过监控与语音指导患者,当患者立于探测器前端,远程对患者进行图像采集,系统通过前期的刻度,自动完成对图像信号的计算和分析,获得患者全身存留的131I活度(MBq)。
3. 周围剂量当量率的测定方法:在患者服131I后的2、6、20、22、24、27、30、44、46、48、54、68及72 h,呼叫患者到测量室,测量时将BH-3103B型便携式X-γ剂量率仪[中核(北京)核仪器厂生产]置于患者颈部前方正中线上0.3、1及3 m处,测量其剂量当量率(μSv/h),连续测量3次,取平均值。测量使用的BH-3103B型便携式X-γ剂量率仪量值可追溯至国家基准。
4. DTC患者131I治疗后剂量当量率的估算及修正方法:将131I治疗后的DTC患者视为点源,在患者服药后某个时刻,距离患者R处的剂量当量率的计算公式如下:
| $ \dot H = A \cdot \mathit{\Gamma }/{R^2} $ | (1) |
式中,Ḣ为距离患者R处的剂量当量率,μSv/h;A为患者服药后某个时刻的活度,MBq;Γ为131I的空气比释动能率常数,Gy·m2·Bq-1·s-1;R为距患者的距离,m。通过不同时间点对43名DTC患者的活度与周围剂量当量率的监测,收集到不同患者活度在(400±400×10%)MBq时所对应的距患者前部体表 0.3、1及3 m处的剂量当量率,将这些不同距离处所测得的剂量当量率的均值作为实际测量值结果。利用(1)式对患者进行剂量当量率的估算,将所有活度范围在400(1±10%)MBq内的患者的实际活度值带入(1)式,所求得的剂量率平均值作为模型估算结果。通过将患者不同距离处剂量当量率的实际测量值与点源模型估算值进行对比,对模型估算进行修正。
5.统计学处理:实验数据使用Origin及SPSS 24.0进行统计分析。正态分布资料采用Pearson相关分析,非正态分布资料采用Spearman相关分析,回归采用线性回归分析。P<0.05为差异有统计学意义。
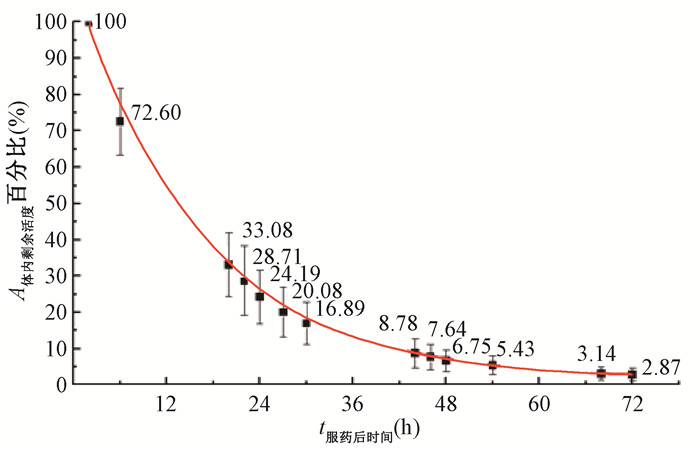
结果1.DTC患者131I治疗后体内放射性活度变化:43名DTC患者口服131I后体内剩余放射性活度随时间逐渐减少,患者服药后2、6、20、22、24、27、30、44、46、48、54、68、72 h的体内剩余131I活度分别占口服131I总活度的100%、72.60%、33.08%、28.71%、24.19%、20.08%、16.89%、8.78%、7.64%、6.75%、5.43%、3.14%、2.87%。患者口服131I后24 h内的活度下降幅度最快,20 h时患者体内存留的放射性活度降至33.08%,已低于服131I总活度的50%,24 h时剩余24.19%。之后24至48 h体内活度的下降幅度较前24 h相对缓慢,但48 h后体内剩余放射性活度也明显减少,降至6.75%。48至72 h体内活度下降幅度趋于平缓,72 h时体内活度仅剩2.87%。
患者服131I后的体内剩余放射性活度随时间变化经函数拟合得到式(2):
| $ A = {A_0}(1.033\;16{{\rm{e}}^{ - 0.062\;4t}} + 0.017\;17) $ | (2) |
式中,A0为DTC患者服药的总活度,MBq;t为服药的时间,h;A为DTC患者服药t小时后体内的放射性活度,MBq。式(2)的R2值为0.999。由此可见,DTC患者服用131I后的体内剩余放射性活度随时间呈指数衰减。DTC患者服用131I后剩余放射性活度百分比随时间变化趋势见图 1。
|
图 1 分化型甲状腺癌患者服131I后体内放射性活度残留百分比随时间变化 Figure 1 Variation with time in percent of residual activity in body of patients with differentiated thyroid cancer after intaking 131I |
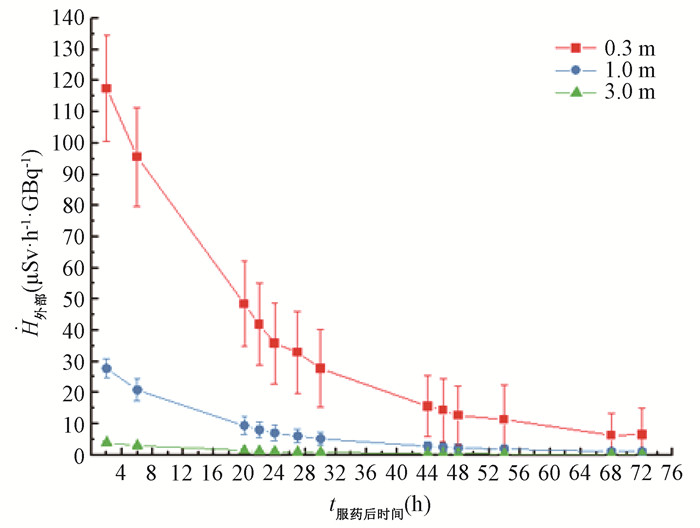
2.DTC患者131I治疗后不同距离处剂量当量率随时间的变化:由于43名DTC患者给药活度的不同,故将各个时间点测定的距患者不同距离处的剂量当量率归一化处理,换算为单位给药活度(每GBq)所产生的剂量当量率(μSv·h-1·GBq-1)。DTC患者服用131I后距其0.3、1及3 m的标准化剂量当量率随时间变化经函数拟合分别得到如式(3)~(5):
| $ {{\dot H}_{0.3}} = 127.220\;7{{\rm{e}}^{ - 0.054\;8t}} + 3.765\;71 $ | (3) |
| $ {{\dot H}_1} = 30.225\;8{{\rm{e}}^{ - 0.064\;4t}} + 0.824\;67 $ | (4) |
| $ {{\dot H}_3} = 4.161\;9{{\rm{e}}^{ - 0.061\;5t}} + 0.167\;97 $ | (5) |
式中,Ḣ0.3、Ḣ1、Ḣ3分别为距离患者0.3、l和3 m处的标准化剂量当量率,μSv·h-1·GBq-1;t为患者服用131I的时间,h。拟合式(3)~(5)的R2值分别为0.999、0.999和0.998。由此可见,DTC患者服用131I后的标准化剂量当量率也随着时间呈指数衰减。DTC患者131I治疗后距其不同距离处的标准化剂量当量率随时间变化趋势见图 2所示。
|
图 2 分化型甲状腺癌患者服131I后不同距离处的标准化剂量当量率随时间的变化趋势 Figure 2 Variation with time in standardized dose equivalent rate at different distances from patients with differentiated thyroid cancer after administration of 131I |
3.DTC患者131I治疗后体内剩余放射性活度与剂量当量率的对应关系:通过拟合患者体内剩余131I活度与所对应的剂量当量率的函数方程,得出43名DTC患者服用131I后不同时间体内放射性活度与其相应的0.3、1及3 m处的剂量当量率均呈线性正相关(r=0.953、0.982、0.984,P < 0.05),线性回归方程如下式(6)~(8):
| $ {{\dot H}_{0.3}} = 0.103\mathit{A} + 17.239 $ | (6) |
| $ {{\dot H}_1} = 0.025\mathit{A} + 1.245 $ | (7) |
| $ {{\dot H}_3} = 0.003\mathit{A} + 0.396 $ | (8) |
式中,Ḣ0.3、Ḣ1、Ḣ3分别为距离患者0.3、1和3 m处的剂量当量率,μSv/h;A为患者体内剩余放射性活度,MBq。
4.DTC患者131I治疗后剂量当量率的估算及修正:通过比较患者不同距离处剂量当量率的实际测量值与点源模型估算值的切合程度,发现使用点源模型估算即将出院的患者周围辐射水平时,会造成高估的情况,所以点源模型应采用一定的刻度修正。符合出院标准要求的DTC患者距其体表不同距离处的剂量当量率估算值与实测值的对比结果及患者人体吸收影响的修正因子,见表 1。
|
|
表 1 患者体表不同距离处的剂量当量率估算结果与实际测量结果的比较及修正因子 Table 1 Comparison of estimated results of dose equivalent rate at different distances from patient′s body surface with actual measurement results and correction factors for effect of human body self-absorption |
讨论
目前,大部分国家通常以活度限值作为放射性131I治疗患者隔离解控的标准。我国核医学放射防护标准要求规定,接受131I治疗的患者体内的放射性活度水平降至400 MBq方可出院[12]。理论上,患者体内的放射性核素131I是造成其周围接触人群受到辐射的根本原因,所以通过测定患者体内剩余131I活度的大小,来决定其出院时间是最合理的方式。Guiu-Souto等[13]通过建立131I在甲状腺癌患者体内的生物代谢模型,发现80%的131I会通过尿液排出患者体外。因此,许多研究者通过测量患者尿液中的131I活度,间接估算患者体内残留的放射性活度。其中汤敏敏等[14]通过尿排法估算“清甲”治疗的DTC患者服药24 h后体内残留131I活度占服131I总活度的25.1%;易艳玲等[15]通过日尿排131I值估算DTC患者服药后第1天尿排泄131I活度分数为58.2%;Kusakabe等[16]报道131I治疗后第1天50%~80%的131I便由尿液排出体外。本研究采用直接测定患者体内放射性活度的方法,结果显示DTC患者服药后第1天体内剩余的131I活度占总活度的24.19%,接近或低于尿排法估算的患者体内残留放射性活度。而季艳会等[17]与本研究同样使用全身动态辐射监测系统其结果显示,24 h时残留的体内放射性活度也均低于尿排法估算的结果。可能使用尿排法估算患者体内剩余的放射性活度忽略了131I除尿液以外的其他途径的排泄和衰变,所以造成其结果高估了体内实际残留的131I活度。但两种测量方法得到的结果均显示,DTC患者在服药后的第1天体内放射性活度的下降速度最快。
国际放射防护委员会(ICRP)第94号出版物中报道甲状腺癌患者用放射性碘治疗后测得的活度排放情况,发现给药活度的55%是在治疗后最初24 h排出的[11]。本研究根据所拟合的患者服131I后的体内剩余放射性活度随时间变化的函数A=A0(1.033 16e-0.062 4 t+0.017 17),可估算出DTC患者的有效半减期为12.19 h,即患者体内放射性活度降为服药总活度的50%所需要的时间。并且假如DTC患者“清甲”治疗需服用1 850~3 700 MBq的131I,可估算其降至出院的标准要求400 MBq仅需26.4~38.9 h。王任飞等[18]估算服1.85~3.70 GBq药量的清甲组患者达到400 MBq的时间大约需22.3~33.4 h,本研究结果与之相差不大。且ICRP 94号出版物中提到对于甲状腺已切除的甲状腺癌患者,施予放射性碘的绝大部分在治疗后的最初2 d内已随尿排出[10]。说明口服131I药量在3 700 MBq以下的DTC患者仅需住院两日便可达到出院标准。
本研究可知, 131I在患者体内清除很快,患者不同距离处的剂量当量率随着时间呈指数衰减,剂量当量率在服药后的24 h内下降速率最快,24 h至48 h内下降幅度较前24 h减慢,但亦非常明显,随后下降幅度趋于平缓,但至72 h时已处于很低水平,甚至3 m处的剂量当量率接近本底水平。患者周围剂量当量率随距患者体表距离的增加显著减少,且距患者体表 0.3 m处的剂量当量率偏差较大,明显高于距体表 1和3 m处的剂量当量率的偏差。这表明距离患者越近的测量点,测量值可能越受患者体型、核素在体内分布情况等个体差异的影响。
患者周围辐射剂量率大小可以直接反映患者对周围人群及环境的辐射危害程度,我国标准规定距离患者体表 1 m处的周围剂量当量率不大于25 μSv/h方可出院[12]。本研究拟合了DTC患者体内剩余放射性活度与距患者不同距离处的剂量当量率的函数关系,当患者体内剩余活度分别为1 000、700和400 MBq时,则距患者1 m处的剂量当量率分别为26.2、18.7和11.2 μSv/h。王任飞等[18]按照体内活度 < 400 MBq作为出院标准,估算距患者1 m处剂量当量率为19.2 μSv/h可作为住院隔离观察限值。汤敏敏等[19]估算患者体内放射性活度达到400 MBq时,其对应的1 m处剂量当量率为8~10 μSv/h,本研究结果与之接近。本研究结果显示,当DTC患者体内活度降至400 MBq时,其1 m处的周围剂量当量率远 < 25 μSv/h。
利用点源模型计算体内放射性活度降至400 MBq左右的患者不同距离处的剂量当量率,结果发现不同距离处的估算结果均不同程度的高估了患者周围的辐射剂量水平,但随着距离患者的测量点越远,点源模型才更加贴近实际测量值。其主要原因可能是模型计算没有考虑人体对射线的吸收,且距离患者较近处,无法单纯的视患者为点源就会造成一定的误差。通过对点源模型的刻度修正,即得到0.3、1及3 m处剂量当量率的修正因子分别为0.25、0.49及0.70。赵萌[20]通过对给药活度为370 MBq的甲亢患者点源模型的计算结果与其实测值均值的比较分析,得到距患者体表 1 m的点源模型修正因子为0.51,与本研究估算的1 m处的修正因子相接近。本研究以活度为400 MBq左右的患者为研究对象,比较分析了点源模型计算值与实际测量值的差异,通过对点源模型的刻度修正得到0.3、1及3 m处的修正因子。但对于不同活度的患者此修正因子是否适用,还需进一步探讨。由于点源模型具有简便且计算速度快的优点,在进行屏蔽计算或患者体外辐射水平估算时经常被使用,但估算距患者体表较近处的辐射水平时,点源模型误差较大。当计算达到出院标准的患者归家后对其周围人群的辐射水平时,单纯利用点源公式去估算难免造成高估的情况,因此在应用点源模型时若能采用人体自吸收影响的修正因子,其结果会更加贴近实际情况。同时,在放射防护的屏蔽设计中,利用点源模型估算屏蔽设施厚度也可采用此修正因子,避免造成资源浪费,实现放射防护最优化的原则。因此,对于使用点源模型估算患者周围辐射水平时使用的修正因子有待进一步的研究。
利益冲突 无
作者贡献声明 韩瑜芙负责数据的采集、分析和论文的撰写;温强负责现场实验的指导;王华林、李思佳负责数据的采集和记录;侯长松、孙全富提供资料及参与实验方案的制订;陈大伟、杨湘山负责实验方案的确定及论文撰写的指导
| [1] |
Du L, Zhao Z, Zheng R, et al. Epidemiology of thyroid cancer: incidence and mortality in China, 2015[J]. Front Oncol, 2020, 10: 1702. DOI:10.3389/fonc.2020.01702 |
| [2] |
Du L, Wang Y, Sun X, et al. Thyroid cancer: trends in incidence, mortality and clinical-pathological patterns in Zhejiang province, southeast China[J]. BMC Cancer, 2018, 18(1): 291. DOI:10.1186/s12885-018-4081-7 |
| [3] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [4] |
Mao Y, Xing M. Recent incidences and differential trends of thyroid cancer in the USA[J]. Endocr Relat Cancer, 2016, 23(4): 313-322. DOI:10.1530/ERC-15-0445 |
| [5] |
Lim H, Devesa SS, Sosa JA, et al. Trends in thyroid cancer incidence and mortality in the United States, 1974-2013[J]. JAMA, 2017, 317(13): 1338-1348. DOI:10.1001/jama.2017.2719 |
| [6] |
易于颦, 胡凤琼. 甲癌患者131I治疗出院标准及时间研究进展[J]. 辐射防护通讯, 2019, 39(2): 43-48. Yi YP, Hu FQ. Progress in discharge criteria & time for 131I treatment of thyroid cancer patients[J]. Radiat Prot Bull, 2019, 39(2): 43-48. |
| [7] |
林岩松, 李娇. 2015年美国甲状腺学会《成人甲状腺结节与分化型甲状腺癌诊治指南》解读: 分化型甲状腺癌131I治疗新进展[J]. 中国癌症杂志, 2016, 26(1): 1-12. Lin YS, Li J. The interpretation of 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Carcinoma: New progress in radioactive iodine therapy of differentiated thyroid carcinoma[J]. China Oncol, 2016, 26(1): 1-12. DOI:10.3969/j.issn.1007-3969.2016.01.001 |
| [8] |
Stefanoyiannis AP, Ioannidou SP, Round WH, et al. Radiation exposure to caregivers from patients undergoing common radionuclide therapies: a review[J]. Radiat Prot Dosim, 2015, 167(4): 542-551. DOI:10.1093/rpd/ncu338 |
| [9] |
孔宪荣, 秦春元, 刘于. DTC患者131I治疗后体内残留辐射剂量影响因素的研究[J]. 当代医学, 2020, 26(8): 29-32. Kong XR, Qin CY, Liu Y. Study on influencing factors of residual radiation dose in patients with DTC after 131I treatment[J]. Contemp Med, 2020, 26(8): 29-32. DOI:10.3969/j.issn.1009-4393.2020.08.010 |
| [10] |
International Commission on Radiological Protection. ICRP Publication 94. Release of patients after therapy with unsealed radionuclides[R]. Netherlands: Elsevier, 2004.
|
| [11] |
Karo C, Ideguchi R, Nishi K, et al. Radiation monitoring of an isolation room for 131I therapy after the patients were released[J]. Health Phys, 2019, 117(4): 419-425. DOI:10.1097/HP.0000000000001063 |
| [12] |
国家卫生健康委员会. GBZ 120-2020核医学放射防护要求[S]. 北京: 中国标准出版社, 2020. National Health Commission of the People's Republic of China. GBZ 120-2020 Requirements for radiological protection in nuclear medicine[S]. Beijing: Standards Press of China, 2020. |
| [13] |
Guiu-Souto J, Neira-Castro S, Sánchez-García M, et al. Adaptive biokinetic modelling of iodine-131 in thyroid cancer treatments: implications on individualised internal dosimetry[J]. J Radiol Prot, 2018, 38(4): 1501-1511. DOI:10.1088/1361-6498/aae44e |
| [14] |
汤敏敏, 刘建中, 武志芳, 等. 日尿排泄131I值估算甲状腺癌患者体内残留活度[J]. 中国医疗前沿, 2013, 8(6): 8-9. Tang MM, Liu JZ, Wu ZF, et al. Estimation the daily urinary excretion131I radioactivity of thyroid cancer in patients with residual activity[J]. Natl Med Front China, 2013, 8(6): 8-9. DOI:10.3969/j.issn.1673-5552.2013.06.0004 |
| [15] |
易艳玲, 石洪成, 顾宇参, 等. 分化型甲状腺癌患者日尿排泄131I活度分数估算[J]. 国际放射医学核医学杂志, 2010, 34(4): 226-229. Yi YL, Shi HC, Gu YS, et al. Estimation the daily urinary excretion 131I radioactivity of patients with differentiated thyroid carcinoma[J]. Int J Radiat Med Nucl Med, 2010, 34(4): 226-229. DOI:10.3760/cma.j.issn.1673-4114.2010.04.010 |
| [16] |
Kusakabe K, Yokoyama K, Ito K, et al. Thyroid remnant ablation using 1, 110 MBq of I-131 after total thyroidectomy: regulatory considerations on release of patients after unsealed radioiodine therapy[J]. Ann Nucl Med, 2012, 26(4): 370-378. DOI:10.1007/s12149-012-0590-7 |
| [17] |
季艳会, 郑薇, 谭建, 等. 分化型甲状腺癌患者131I治疗后体内放射性残留活度变化趋势及影响因素分析[J]. 中华核医学与分子影像杂志, 2020, 40(12): 721-725. Ji YH, Zheng W, Tan J, et al. Residual radioactivity and its influencing factors in patients with differentiated thyroid carcinoma after 131I therapy[J]. Chin J Nucl Med Mol Imaging, 2020, 40(12): 721-725. DOI:10.3760/cma.j.cn321828-20191016-00224 |
| [18] |
王任飞, 谭建, 张桂芝, 等. 分化型甲状腺癌患者131I治疗后外部剂量当量率与体内放射性活度残留量的相关性[J]. 中华核医学与分子影像杂志, 2016, 36(5): 394-397. Wang RF, Tan J, Zhang GZ, et al. Correlation between external dose equivalent rate and residual radioactivity in patients with differentiated thyroid carcinoma after 131I therapy[J]. Chin J Nucl Med Mol Imaging, 2016, 36(5): 394-397. DOI:10.3760/cma.j.issn.2095-2848.2016.05.004 |
| [19] |
汤敏敏, 刘建中, 武志芳, 等. 分化型甲状腺癌患者131I治疗后体内残留放射性活度的评估[J]. 中华放射医学与防护杂志, 2015, 35(4): 299-302. Tang MM, Liu JZ, Wu ZF, et al. Estimation of residual activity in patients with differentiated thyroid cancer after administration of 131I for therapy[J]. Chin J Radiol Med Prot, 2015, 35(4): 299-302. DOI:10.3760/cma.j.issn.0254-5098.2015.04.016 |
| [20] |
赵萌. 接受放射性药物诊断与治疗人员对公众影响的防护要求[D]. 衡阳: 南华大学, 2014. Zhao M. The public radiation influencing protection requirements of diagnosis and treatment for patients using radiopharmaceuticals[D]. Hengyang: University of South China, 2014. |
 2021, Vol. 41
2021, Vol. 41


