2. 北京大学肿瘤医院暨北京市肿瘤防治研究所放疗科 恶性肿瘤发病机制及转化研究教育部重点实验室 100142
2. Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education/Beijing), Department of Radiotherapy, Peking University Cancer Hospital & Institute, Beijing 100142, China
容积调强放射治疗(VMAT)是放疗的重要技术手段之一[1-2]。VMAT计划设计是一个多参数寻优的过程,需耗费物理师的大量时间和精力,并且依赖于物理师的计划设计经验,其中的难点在于初始优化参数(initial objective parameters,IOPs)的设置以及优化过程中各参数(objective parameters,OPs)的交互调整。为降低物理师计划设计过程中对经验的依赖,同时提高计划设计效率、质量和一致性,有研究利用既往放疗计划数据训练深度神经网络模型来预测放疗计划的OPs [3]、剂量体积直方图[4]以及三维剂量分布[5-6],用以指导物理师设置和调整优化参数[7]。本研究在Eclipse15.6计划系统平台上设计一种联合剂量预测和参数迭代优化算法(protocol-based automatic iterative optimization,PBAIO)的VMAT自动计划方法,并利用既往治疗后的直肠癌病例数据验证了该方法的可行性。
资料与方法 1、病例资料选择2018年6月至2021年1月于北京大学肿瘤医院已完成治疗的165例直肠癌术前放疗病例,临床处方剂量标准为计划肿瘤靶区(PGTV) 50.6 Gy/22次, 计划靶区(PTV) 41.8 Gy/22次。所有患者均采用仰卧位、热塑膜固定,CT扫描范围为第二腰椎上缘至会阴,扫描层厚为5 mm。勾画信息主要分为两类,一类是靶区为肿瘤靶区(GTV)、临床靶区(CTV),PGTV和PTV分别由GTV和CTV外扩5 mm得到,PTV control定义为PTV内且不含PGTV外扩15 mm的范围;另一类是危及器官为股骨头、膀胱,以及用于控制小肠及靶区外剂量的辅助结构(Avoidance)。Avoidance定义为PTV前侧和后侧凹型区域,可用于控制小肠的剂量,减小因小肠位置不确定性导致的剂量误差等[8]。将所有数据分为训练集(125例)、验证集(20例)和测试集(20例),其中训练集和验证集用于训练剂量预测模型,测试集用于验证自动计划的可行性。
2、剂量预测模型的构建及训练基于深度学习的剂量预测模型使用全卷积CNN网络结构,U-Res-Net网络结构在放疗计划剂量预测任务中表现优异[9-10],该网络由编码器和解码器两部分组成,先通过编码器不断减小数据尺寸以提取多维度特征,然后使用解码器还原数据尺寸,同时使用跃层连接整合信息。编码部分主要由卷积模块和下采样层构成,下采样层通过卷积核为2×2×2,步长为2×2×2的卷积层实现。解码部分主要由反卷积层和一致模块构成,反卷积层可还原数据尺寸,卷积核为2×2×2,步长为2×2×2。卷积层的卷积核为3×3×3,步长为1×1×1,所有卷积层、下采样层和反卷积层后均使用批标准化和修正线性单元操作,具体网络结构见图 1。
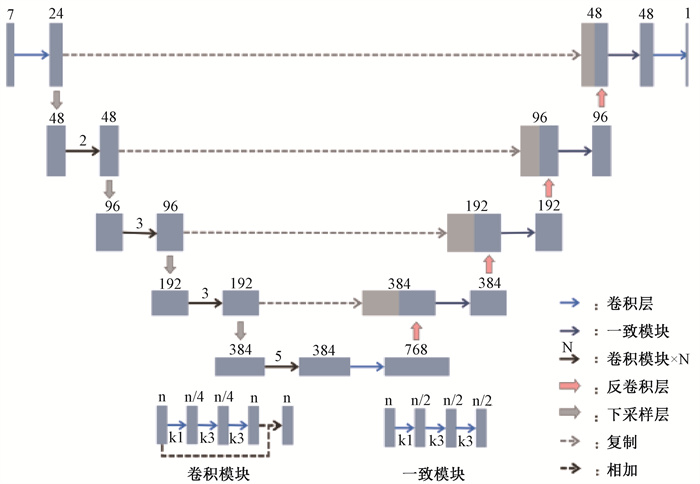
|
图 1 剂量预测模型的网络结构图 Figure 1 Network structure of the dose prediction model |
训练数据包括:CT图像、勾画信息(PTV、PGTV、股骨头、膀胱、Avoidance、外轮廓)和剂量分布信息,其中勾画信息分别用1~6标记并归至0~1内,三维剂量信息归为处方剂量的百分比,所有信息使用三维矩阵存储,网格分辨率为2.5 mm × 2.5 mm × 2.5 mm。优化器使用Adam优化器,初始学习率为0.001,采用固定步长衰减的方法调整学习率,为防止过拟合,在训练过程中随机对数据进行平移和翻转操作实现数据增强。根据所需预测的危及器官,定义损失函数为ΣaMSE(a),a∈ [股骨头、膀胱、Avoidance],MSE(a)为结构a内所有体素的参考剂量值和预测剂量值的均方误差。训练结束后,使用模型预测危及器官的剂量分布,并提取关键DVH值作为IOPs。
3、参数迭代优化算法(PBAIO)本研究提出的PBAIO算法属于基于规则的自动迭代优化算法[11],该算法可根据计划系统的优化结果自动对OPs进行调整,具体实施如下:在第i次迭代优化时(i>0),设优化目标Ik的剂量目标值为
| $ {\rm{Diff}}_{{I_k}}^{^i} = \alpha \times \left( {AD_{_{{I_k}}}^{^i} - SD_{_{{I_k}}}^{^i}} \right) $ | (1) |
当Ik对应的目标函数类型为Point(Lower)时,α=-1,否则α=1。
Ik的累计调整收益率
| $ {\rm{CRR}}_{_{{I_k}}}^{^i} = \left\{ {\begin{array}{*{20}{l}} 1&{k = 1, 2, 4, 5}\\ {{\prod ^i}_{i = 1}R{R^i}_{{I_k}}}&{k = 6, 7, 8} \end{array}} \right. $ | (2) |
式中,
| $ RR_{{I_k}}^{^i} = {\rm{Max}}\left( {{\rm{tanh}}\left( {2 \times \frac{{AD_{{I_k}}^{^i} - AD_{_{{I_k}}}^{i - 1}}}{{SD_{_{{I_k}}}^{^i} - SD_{_{{I_k}}}^{^{i - 1}}}}} \right), \frac{1}{2}} \right), i > 1 $ | (3) |
Ik调整值
| $ M_{{I_k}}^{^i} = \left\{ {\begin{array}{*{20}{l}} {{A_{{I_k}}} \times {\rm{CRR}}_{{I_k}}^{^i}}&{{\rm{Diff}}_{{I_k}}^{^i} \le 0}\\ {{A_{{I_k}}} \times {\rm{CRR}}_{{I_k}}^{^i}\left( {\frac{{{\rm{Diff}}_{{I_k}}^{^i} - {e_{{I_k}}}}}{{|{e_{{I_k}}}|}}} \right)}&{{\rm{Diff}}_{{I_k}}^{^i} > 0} \end{array}} \right. $ | (4) |
式中AIk为初始调整幅度;eIk为制衡因子,可用于调整结构之间的制衡关系,使用的参数具体值可见表 1。
|
|
表 1 直肠癌患者VMAT自动计划初始优化参数模板 Table 1 Initial objective parameters of automatic VMAT planning for rectal cancer patients |
对于靶区(PTV/PGTV)的OPs,调整其权重设置值
| $ P_{_{{I_k}}}^{^{i + 1}} = P_{_{{I_k}}}^{^i} + M_{_{{I_k}}}^{^i}, k = 1, 2, 4, 5 $ | (5) |
| $ SD_{_{{I_k}}}^{^{i + 1}} = SD_{_{{I_k}}}^{^i} + M_{_{{I_k}}}^{^i}, k = 6, 7, 8 $ | (6) |
收敛指标Gi用于终止迭代优化过程,当其收敛时,则调整结束。Gi定义为:
| $ {G^i} = {\Sigma _{{I_k}}}\frac{{M_{_{{I_k}}}^{^i}}}{{{A_{{I_k}}}}}, k \ne 3, 9 $ | (7) |
自动计划均采用两弧照射方式,在临床医生勾画靶区和危及器官后,自动计划使用API函数创建放疗计划、添加射野、生成辅助结构和调用剂量预测模型预测IOPs,最后基于参数迭代优化算法自动生成VMAT计划。直肠癌自动计划共设置了9个优化目标,对于IOPs的设置,靶区剂量下限按处方剂量的101%给定,上限按处方剂量106%给定,而危及器官(股骨头、膀胱、Avoidance)则使用由深度学习方法预测的剂量值,所有权重参数初始值调用模板,另外AutoNTO目标由Eclipse 15.6提供,用于控制靶区外剂量跌落速度,其初始优化参数模板见表 1。
5、评价标准通过与人工计划比较对自动计划的质量进行评估,靶区的剂量学评价指标包括D99、D95、D1、靶区适形性指数[12](conformityindex,CI)和靶区均匀性指数[13](homogeneityindex,HI),其中Dx为x%靶区体积接受的剂量;CI=(Vt, p/Vt)×(Vt, p/Vp),Vt, p为处方剂量覆盖的靶区体积,Vt为靶区体积,Vp为处方剂量覆盖的体积;HI=|D2-D98|/Dp,D2、D98分别为2%和98%靶区体积所接受的最小剂量,Dp为靶区的处方剂量。危及器官的剂量学评价指标包括Dmean、V40、V30和V20,其中Dmean为平均剂量;Vx为危及器官内大于x Gy部分的体积占比。
6、统计学处理使用SPSS 22.0软件对数据进行统计学处理,数据符合正态分布,用x±s表示,比较自动VMAT计划与人工计划剂量学指标的差异,采用配对t检验。P < 0.05为差异有统计学意义。
结果 1、危及器官的预测结果选择20例测试病例,预测危及器官的剂量分布并从中提取IOPs的预测值,比较预测值与参考值(人工计划)的差异,股骨头、膀胱、Avoidance的平均剂量预测值分别为(10.22±1.26)、(17.42±3.06)和(16.40±1.74)Gy,参考值分别为(10.82±2.01)、(18.13±2.86)和(17.06±2.39)Gy,两者比较差异均无统计学意义(P> 0.05)。
2、自动计划结果比较选取20例测试病例实现VMAT自动计划,并使用配对t检验方法比较自动计划与人工计划在剂量学参数上的差异。从表 2可看到,所有的计划都满足临床处方剂量要求。自动计划与人工计划相比,PTV的D99和D95分别高0.45和0.11 Gy(t=-2.74、-2.31,P < 0.05),两种计划的CI差异无统计学意义(P> 0.05)。自动计划PGTV的D1和HI比人工计划分别高0.6 Gy和0.01(t=-7.05、-6.92,P < 0.05),D99、D95和CI则差异无统计学意义(P> 0.05)。在危及器官保护方面,相比于人工计划,自动计划的膀胱V30下降2.7 Gy(t=3.37,P < 0.05),股骨头和Avoidance的V20分别下降8.37和15.95 Gy(t=5.65、11.24,P < 0.05),并且膀胱、股骨头、Avoidance的平均剂量分别降低了1.91、4.01和3.88 Gy(t=9.29、2.80、10.23,P < 0.05)。
|
|
表 2 直肠癌患者VMAT自动计划与人工计划的剂量学参数比较(x±s) Table 2 Dosimetry comparison of automatic and manual VMAT plans for rectal cancer patients(x±s) |
3、自动计划时间
20例测试病例的自动计划平均时间为(71.82±25.48)min,其中包括危及器官剂量预测平均时间20 s。自动计划的PBAIO算法平均迭代次数为9次,单次迭代平均时间为(7.48±0.95)min。
讨论本研究联合剂量预测模型和自主设计的参数迭代优化算法设计了一种VMAT自动计划方法,并在直肠癌病例集中验证了该方法的可行性。基于深度学习的自动计划方法对训练数据集的质量要求很高,且不具备提升计划质量的能力,但该方法效率高,能基于训练数据集快速生成类似的计划[5, 10];而基于迭代优化的自动计划方法能自主探索优质计划,但初始计划参数难以确定,往往基于固定的模板,导致初始寻优过程会产生部分低效的探索[14-15]。本研究提出的自动计划结合了两种方法的优势,使用剂量预测模型快速生成较优的计划优化参数,从而减少自动计划的迭代寻优次数,提升自动计划效率,且自动计划的结果并不依赖于训练数据集的计划质量。
深度学习方法在三维剂量预测分布研究中具有可观的效果[5-7, 9-10, 16-18],但仅能预测剂量衰减的趋势,难以精细预测剂量分布信息,在低剂量区域剂量预测误差较大[7, 17]。本研究通过定制损失函数将全剂量分布预测任务简化为危及器官剂量预测任务,相比于Song等[7]和Xia等[19]的预测结果,将模型注意力转移至危及器官有助于提高危及器官关键DVH预测值的准确性(IOPs的预测值与参考值无统计学差异)。危及器官剂量预测模块对自动计划的贡献在于利用深度学习预测具备个体化差异的IOPs以减少OPs调整的迭代次数,相比于基于固定优化参数模板的自动计划[8](平均迭代次数为45次),本研究自动计划的平均迭代次数减少至9次。对于IOPs的设置,靶区的最优剂量可参考处方剂量设置为固定值,但危及器官的最优剂量无法明确,因此PBAIO算法选择优化靶区权重和危及器官的剂量值,危及器官的权重值设置为表 1中的固定值,这与Yang等[20]的策略一致。Song等[15]和Yang等[20]基于系统内部参数优化目标返回值(optimization objective value,OOV)构建了OPs调整模块,但Eclipse计划系统内的OOV参数定义与之不同,不适用于PBAIO算法,因此算法定义了
自动计划与参考人工计划的量化评估结果表明,对于靶区的剂量分布,自动计划与人工计划总体差异较小,且在临床可接受的范围内。在保护危及器官方面,自动计划在危及器官的重要剂量学参数指标上能保证与人工计划相当甚至更优,这揭示了自动计划具备提高计划质量的潜力,归因于自动计划设计没有时间和精力的限制,相比于人工计划,自动计划可在PBAIO算法的引导下探索更多的参数组合。
20例测试数据的自动计划平均时间为(71.49± 25.48)min,其中Eclipse计划系统的VMAT计划内部优化占用了大部分时间,但该自动计划全自动生成,无需人工干预,可不间断地使用计划系统并行处理多个计划,提高计划设计效率和临床资源的利用率。自动计划的局限性在于对不同处方剂量的病例和不同的病种需要重新设计,将在后续的研究中对其通用性进行改进。
利益冲突 所有作者声明不存在利益冲突
志谢 本项研究工作还得到北京市医管局培育计划(PX2019042)资助
作者贡献 刘嘉城负责数据采集分析和代码编写;王翰林、王清莹参与代码编写;姚凯宁、王美娇协助计划评价和论文撰写;岳海振、王若曦、杜乙指导代码编写和论文修改;吴昊负责方法学设计和指导研究
| [1] |
Palma D, Vollans E, James K, et al. Volumetric modulated arc therapy for delivery of prostate radiotherapy: comparison with intensity-modulated radiotherapy and three-dimensional conformal radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 72(4): 996-1001. DOI:10.1016/j.ijrobp.2008.02.047 |
| [2] |
Shi J, Yang F, Ju X, et al. Comparative study on dosimetry of VMAT and IMRT in assisted radiotherapy after radical resection of rectal cancer[J]. Oncol Lett, 2017, 13(5): 2971-2974. DOI:10.3892/ol.2017.5842 |
| [3] |
Chen JH, Bai PG, Zhang XC, et al. Automated intensity modulated radiation therapy treatment planning for cervical cancer based on convolution neural network[J]. Technol Cancer Res Treat, 2020, 19: 1533033820957002. DOI:10.1177/1533033820957002 |
| [4] |
Chen X, Men K, Zhu J, et al. DVHnet: a deep learning-based prediction of patient-specific dose volume histograms for radiotherapy planning[J]. Med Phys, 2021, 48(6): 2705-2713. DOI:10.1002/mp.14758 |
| [5] |
Fan J, Wang J, Chen Z, et al. Automatic treatment planning based on three-dimensional dose distribution predicted from deep learning technique[J]. Med Phys, 2019, 46(1): 370-381. DOI:10.1002/mp.13271 |
| [6] |
Nguyen D, Long T, Jia X, et al. A feasibility study for predicting optimal radiation therapy dose distributions of prostate cancer patients from patient anatomy using deep learning[J]. Sci Rep, 2019, 9(1): 1076. DOI:10.1038/s41598-018-37741-x |
| [7] |
Song Y, Hu J, Liu Y, et al. Dose prediction using a deep neural network for accelerated planning of rectal cancer radiotherapy[J]. Radiother Oncol, 2020, 149(1): 111-116. DOI:10.1016/j.radonc.2020.05.005 |
| [8] |
王翰林, 刘嘉城, 姚凯宁, 等. 基于优化参数树搜索算法的直肠癌调强放疗自动计划[J]. 中华放射医学与防护杂志, 2021, 41(1): 66-73. Wang HL, Liu JC, Yao KN, et al. Automatic planing of IMRT for rectum cancer based on optimization parameters tree search algorithm[J]. Chin J Radiol Med Prot, 2021, 41(1): 66-73. DOI:10.3760/cma.j.issn.0254-5098.2021.01.014 |
| [9] |
Liu Z, Fan J, Li M, et al. A deep learning method for prediction of three-dimensional dose distribution of helical tomotherapy[J]. Med Phys, 2019, 46(5): 1972-1983. DOI:10.1002/mp.13490 |
| [10] |
Zhou J, Peng Z, Song Y, et al. A method of using deep learning to predict three-dimensional dose distributions for intensity-modulated radiotherapy of rectal cancer[J]. J Appl Clin Med Phys, 2020, 21(5): 26-37. DOI:10.1002/acm2.12849 |
| [11] |
Hussein M, Heijmen B, Verellen D, et al. Automation in intensity modulated radiotherapy treatment planning-a review of recent innovations[J]. Brit J Radiol, 2018, 91(1092): 1-20. DOI:10.1259/bjr.20180270 |
| [12] |
van't Riet A, Mark ACA, Moerland MA, et al. A conformation number to quantify the degree of conformality in brachytherapy and external beam irradiation: application to the prostate[J]. Int J Radiat Oncol Biol Phys, 1997, 37(3): 731-736. DOI:10.1016/s0360-3016(96)00601-3 |
| [13] |
Lauve A, Morris M, Schmidt-Ullrich R, et al. Simultaneous integrated boost intensity-modulated radiotherapy for locally advanced head-and-neck squamous cell carcinomas: Ⅱ-clinical results[J]. Int J Radiat Oncol Biol Phys, 2004, 60(2): 374-387. DOI:10.1016/j.ijrobp.2004.03.010 |
| [14] |
Wang HL, Wang RX, Liu JC, et al. Tree-based exploration of the optimization objectives for automatic cervical cancer IMRT treatment planning[J]. Brit J Radiol, 2021, 94(1123): 1-2. DOI:10.1259/bjr.20210214 |
| [15] |
Song Y, Wang Q, Jiang X, et al. Fully automatic volumetric modulated arc therapy plan generation for rectal cancer[J]. Radiother Oncol, 2016, 119(3): 531-536. DOI:10.1016/j.radonc.2016.04.010 |
| [16] |
Chen X, Men K, Li Y, et al. A feasibility study on an automated method to generate patient-specific dose distributions for radiotherapy using deep learning[J]. Med Phys, 2019, 46(1): 56-64. DOI:10.1002/mp.13262 |
| [17] |
Kearney V, Chan JW, Haaf S, et al. DoseNet: a volumetric dose prediction algorithm using 3D fully-convolutional neural networks[J]. Phys Med Biol, 2018, 63(23): 235022. DOI:10.1088/1361-6560/aaef74 |
| [18] |
Nguyen D, Jia X, Sher D, et al. 3D radiotherapy dose prediction on head and neck cancer patients with a hierarchically densely connected U-net deep learning architecture[J]. Phys Med Biol, 2019, 64(6): 065020. DOI:10.1088/1361-6560/ab039b |
| [19] |
Xia X, Wang JZ, Li YJ, et al. An artificial intelligence-based full-process solution for radiotherapy: a proof of concept study on rectal cancer[J]. Front Oncol, 2021, 10(1): 1-8. DOI:10.3389/fonc.2020.616721 |
| [20] |
Yang Y, Shao K, Zhang J, et al. Automatic planning for nasopharyngeal carcinoma based on progressive optimization in RayStation treatment planning system[J]. Technol Cancer Res T, 2020, 19(1): 1-8. DOI:10.1177/1533033820915710 |
 2021, Vol. 41
2021, Vol. 41


