2. 北京大学肿瘤医院暨北京市肿瘤防治研究所放疗科恶性肿瘤发病机制及转化研究教育部重点实验室 100142
2. Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education/Beijing), Department of Radiotherapy, Peking University Cancer Hospital & Institute, Beijing 100142, China
随着调强放疗的普及,如何客观、准确地评估患者治疗计划的质量成为临床上特别关注的问题。在评估治疗计划时,医师和物理师的临床经验、技能水平差异会导致质量评价出现主观偏差,因此,需要对治疗计划进行更结构化的分析与定量评估[1-2]。目前针对同步推量调强放射治疗(simultaneous modulated accelerated radiotherapy,SMART)计划质量评价指数的研究较少,常用的几种剂量分布评价指数,如适形指数(conformity index, CI)[3-5]、均匀性指数(homogeneity index, HI)[6-8]和梯度指数(gradient index, GI)[9-10]等,并不足以应对现阶段的需求。现行的临床计划评价体系通常基于计划所对应的剂量-体积直方图(dose volume histogram, DVH)[11],由于DVH失去了剂量分布的空间信息,所以在精准评估计划质量方面仍存在一定的局限性。而γ分析作为比较剂量分布的传统工具,也存在指数混合信息,解释性不强的缺点[12]。
为较好地实现对多处方计划质量评价,本研究尝试利用结构相似性指数(structural similarity index measure, SSIM)[13]构建一种包含剂量分布中几何信息并能够反映具体位置信息的放疗计划评价指数。近年来SSIM指数已被用于放射治疗领域中协助伽马分析的剂量变化检测工具[14-17],研究表明SSIM指数具有揭示两种剂量分布之间不同类型误差的能力。本研究将SSIM指数引入放疗计划质量评价领域,形成SSIM评价指数模型,并分析SSIM指数与以往评价指数的关系以及质量评价的效果。
资料与方法 1、患者资料选取2018年1月至2020年5月北京大学肿瘤医院放疗科已完成放疗的53例淋巴结转移同步推量宫颈癌病例,所有病例均采用容积旋转调强(VMAT)技术,临床分期采用2018年国际妇产科联盟(Federation International of Gynecology and Obstetrics, FIGO)标准分期,为Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期21例,其中Ⅰ~Ⅱ期患者在影像上存在可疑淋巴结。计划靶区(PTV)处方剂量为45 Gy/25次,转移淋巴结与可疑淋巴结,统一简称PGTVnd,处方剂量为60 Gy/25次,PTV中位体积1 820.0 cm3(1 030.3~2 373.9 cm3),PGTVnd中位体积133.6 cm3(5.3~276.4 cm3)。
2、数据预处理将SSIM指数应用于评估剂量分布需要对剂量分布信息进行离散化处理,然后将理想剂量分布与实际计划剂量分布进行相似性分析,从而得出比较结果。其中理想剂量分布直接根据靶区处方剂量进行构建,以解决质量评估过程中无可用参考剂量分布的问题。而实际计划剂量则通过读取已完成计划所对应的三维剂量分布获得。该部分工作通过编写Python脚本完成。
理想剂量分布的具体构建方法如下:首先读取对应结构数据中的勾画信息,并根据各结构勾画信息生成各感兴趣区(ROI)的对应掩码;接下来将ROI掩码范围内的体素按处方剂量赋值,而所有ROI掩码外部分的处方剂量设置为0,从而生成对应处方限值的理想三维剂量分布。考虑到临床上危及器官的剂量限值一般为最大剂量,而理想的受照剂量应尽可能地低,常用的评价靶区剂量情况的指数并不适用,因此,本研究将SSIM指数评价计划质量仅限于PTV和PGTVnd的剂量分布。
本研究中选取的计划为PTV内有PGTVnd且同步推量的靶区,对PTV剂量分布直接进行均匀性评估并不合理。因此,分析SSIM指数评估均匀性效果时,数据范围限定为PGTVnd与PTV扣除PGTVnd(PTV-PGTVnd)两个区域,此时SSIM指数记为SSIMHI;当分析SSIM指数评估适形性效果时,为避免因理想剂量分布中PGTVnd边缘剂量跌落梯度过大而导致适形性评估失效的情况发生,将PGTVnd与高于PGTVnd处方剂量并集后再三维收缩0.25 cm的剂量分布,做为本研究所选定的数据范围。此时SSIM指数记为SSIMCI。最终将SSIMHI、SSIMCI分别与HI、CI进行相关性分析,HI与CI计算方法见公式(1)~(2)。
| $ {\rm{CI}} = \frac{{{V_{{\rm{T}}, {\rm{ref}}}}}}{{{V_{\rm{T}}}}} \times \frac{{{V_{{\rm{T, ref}}}}}}{{{V_{{\rm{ref}}}}}} $ | (1) |
| $ {\rm{HI}} = \frac{{{D_{2\% }} - {D_{98\% }}}}{{{D_{\rm{P}}}}} $ | (2) |
式中,VT, ref为接受剂量大于等于处方剂量的靶区体积;VT为靶区体积Vref为接受剂量大于等于处方剂量的体积;D2%、D98%分别为受照射剂量最高的2%和98%的靶区中最小剂量;DP为处方剂量。
在进行统计学分析之前,选取上述样本库中两例病例,人为设计引入两种质量缺陷与无缺陷的临床实际计划。两种质量缺陷分别为存在局部高量和高剂量区外剂量跌落缓慢。该对比旨在展示不同的剂量分布缺陷在SSIM指数分布上对应不同的图像模式。
3、SSIM评价指数模型实现流程SSIM指数通过比较实际计划剂量分布与理想剂量分布之间的差异进行打分。由于以体素为单位进行SSIM指数评价时受噪声影响较大,因此考虑引入窗函数以缓解噪声带来的影响。本研究所用到的剂量数据分辨率为0.25 cm×0.25 cm×0.5 cm,选取3×3×3体素形成的立方体作为窗口。通过对计划剂量分布与处方剂量分布数据进行SSIM指数分析,可以获得亮度函数、对比度函数、结构函数,见公式(3~5),上述3种函数可分别代表相似性的亮度参数(luminance)、对比度参数(contrast)、结构参数(structure)分布,三者的乘积对应SSIM指数分布,见公式(6)。公式(7)为SSIM指数最终形式[14]。图 1展示了掩盖PTV之外数据后的SSIM评价过程,通过公式(8)将感兴趣区中所有体素对应的SSIM数值的平均值作为计划的最终质量评分。当SSIM指数取值为1时,表示实际计划剂量分布越接近理想剂量分布。
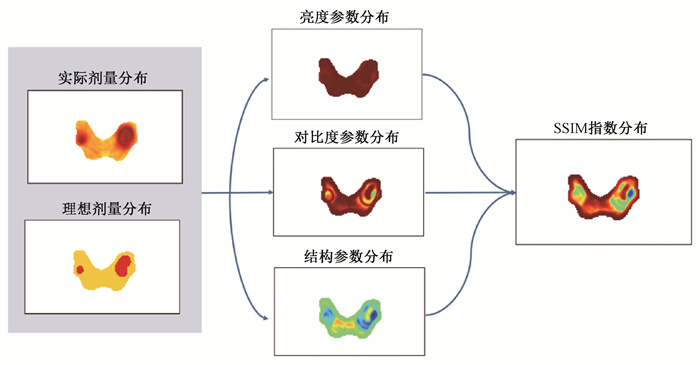
|
图 1 结构相似性指数(SSIM)模型评价放疗计划中剂量分布质量流程图 Figure 1 Flow chart of the quality assessment of dose distribution in radiotherapy plans using a SSIM model |
| $ l\left( {x, y} \right) = \frac{{2{\mu _x}{\mu _y} + {C_1}}}{{\mu _{_x}^2 + \mu _{_y}^2 + {C_1}}} $ | (3) |
| $ c\left( {x, y} \right) = \frac{{2{\sigma _x}{\sigma _y} + {C_2}}}{{\sigma _{_x}^2 + \sigma _{_y}^2 + {C_2}}} $ | (4) |
| $ s\left( {x, y} \right) = \frac{{{\sigma _{xy}} + {C_3}}}{{{\sigma _x}{\sigma _y} + {C_3}}} $ | (5) |
| $ {\rm{SSIM}}\left( {x, y} \right) = {\left[ {l\left( {x, y} \right)} \right]^\alpha }\left[ {c\left( {x, y} \right)} \right]{^\beta }\left[ {s\left( {x, y} \right)} \right]{^\gamma } $ | (6) |
| $ {\rm{SSIM}}\left( {x, y} \right) = \frac{{(2{\mu _x}{\mu _y} + {C_1})(2{\sigma _{xy}} + {C_2})}}{{(\mu _x^2 + \mu _y^{^2} + {C_1})(\sigma _{_x}^2 + \sigma _y^2 + {C_2})}} $ | (7) |
| $ {\rm{MSSIM}}\left( {X, Y} \right) = \frac{1}{M}\sum\limits_{j = 1}^M {{\rm{SSIM}}\left( {{x_j}, {y_j}} \right)} $ | (8) |
式中,x, y分别为计划剂量与处方剂量分布中的某一体素;μx、μy、σx、σy、σxy分别为以x或y为中心的窗口选中区域的局部均值、标准差和协方差;α、β、γ为权重,此处均设定为1;C1、C2、C3为常数;M为剂量分布中体素总数目。在模型实现中,为保证数值计算的稳定性,引入常数k1=0.01,C1=(k1L)2,k2=0.03,C2=(k2L)2,C3=C2/2。对于L,此处令其为计划给定的最大的处方剂量值。
4、统计学处理采用R统计分析软件3.6.2版进行数据处理,对各个病例的SSIMHI、SSIMCI及其子参数与HI、CI绘制散点图。采用Spearman法计算相关系数(R)及P值,R越接近1,认为正相关性越强;R取值为0,认为没有相关性;R越接近-1,则负相关性越强。P < 0.05为差异具有统计学意义。
结果 1、识别局部高量对同一病例设计含有与未含有局部高量的两种计划,展示SSIM指数识别局部高量的效果。图 2为掩盖PTV外数据后选取剂量分布中某一层面所得的SSIM指数图,可以看出SSIM指数在局部高量边缘处的数值较低,说明SSIM指数可以通过捕捉剂量跌落的异常来识别出处方剂量中不存在的局部高量。
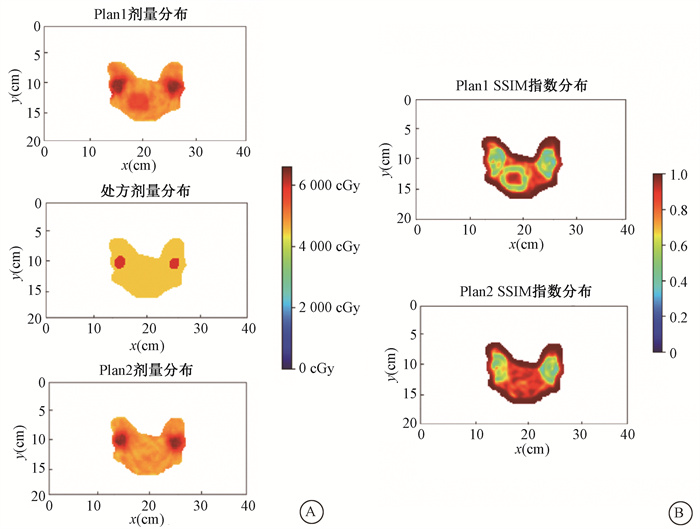
|
图 2 放疗计划中剂量分布含有局部高量(A)与不含有局部高量(B)的平面剂量分布图与对应的结构相似性(SSIM)指数质量评价分布图 Figure 2 Diagrams of dose distribution in radiotherapy plans with and without local high dose (A, B) and corresponding SSIM-based quality assessment diagrams |
2、比较高剂量区外剂量跌落程度
对同一病例设计高剂量区外剂量跌落速度慢与快的两种计划。掩盖PTV外数据后,观察某一平面的SSIM指数分布图,发现剂量跌落异常点的SSIM指数数值均较低,见图 3。
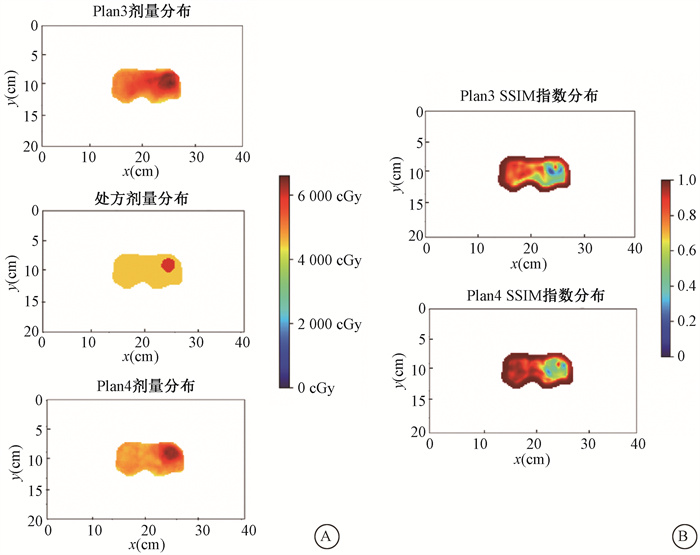
|
图 3 放疗计划的剂量分布中PGTVnd外同等距离剂量跌落慢(A)与跌落快(B)的平面剂量分布与对应的结构相似性(SSIM)指数质量评价分布图 Figure 3 Diagrams of dose distribution in radiotherapy plans with slow (A) and quick (B) dose fall-off (Plan3, Plan 4) at the same distance outside the PGTVnd and corresponding SSIM-based quality assessment diagrams |
3、SSIM指数与HI、CI相关性分析
对53例宫颈癌患者的SSIM指数与HI、CI进行相关性分析。通过计算Spearman相关系数可以发现,在PGTVnd中SSIMHI及子参数与HI不存在相关性,在PTV-PGTVnd中SSIMHI与HI存在显著的负相关(R=-0.86,P < 0.01)。在评价PGTVnd的适形性中,SSIMCI与CI存在显著的正相关(R=0.83,P < 0.01)。为进一步探讨在PGTVnd中HI与SSIMHI不相关的原因,选取PGTVnd中HI值差异微小的4个计划Plan A~D进行分析。表 1展示了Plan A~D中PGTVnd的剂量学参数、HI与SSIMHI。可以看出对于剂量学参数存在差异的计划,HI差异微小,并且会出现HI值相同的情况,如PlanA与PlanB,相较于HI的差异,SSIMHI差异更为显著。
|
|
表 1 4例宫颈癌患者不同放疗计划的剂量学参数及HI、SSIM指数的比较 Table 1 Comparison of dosimetry parameters, HI, and SSIM in radiotherapy plans of four cervical cancer cases |
讨论
本研究将SSIM指数应用于放疗计划的质量评价,通过分析实际与理想三维剂量数据并结合其空间位置信息给出质量评分。为展现SSIM指数质量评价结果具有可视化的图像模式,本研究对人工引入质量缺陷的计划进行质量评价,并选取三维结果中某一层面数据进行展示。采用统计学分析SSIM指数与常用的均匀性指数、适形性指数的相关性,探究SSIM指数能否反映出有关均匀性与适形性的信息。
以往评价指数,如Dmax/Dp,D5/D95,(D2-D98)/Dp,最主要的缺陷为仅基于DVH上部分点数据,未考虑完整剂量分布的信息[3, 7-8]。Mambretti等[18]针对SMART计划构建的gUDI本质上为CI、HI与GI的组合,仍未摆脱上述问题。Yoon等[19]提出的S-index虽考虑到了完整DVH的信息,但计划与理想DVH的偏差仍然未知。随着处方剂量数目的增加,计划质量评价会更为复杂,Yan等[20]提出的new HI针对具有多个处方剂量的计划质量评价准确度较高,但其数据参考为DVH,未包含空间位置信息,因此面对结构较为复杂的计划时,仍存在质量评价失效的情况。
本研究首先通过对局部高量和高剂量区外剂量跌落速度的测试发现,SSIM指数能够精准的反馈存在问题的空间位置,此种信息反馈会对计划优化提供指导性建议。随后针对评价同样剂量分布质量的SSIM指数与常用的HI、CI指数进行了相关性分析。其中在剂量极差相对小的区域(如PGTVnd)时HI对DVH差异的敏感性下降,而SSIM指数子参数的共同作用使敏感性增强,仍能识别出剂量分布的差异,这使得SSIM指数与HI未表现出相关性;在剂量极差相对大的区域(如PTV-PGTVnd),HI与SSIM指数相关性显著。本研究针对PGTVnd选取符合CI算法的数据范围,所得SSIM指数具有反映适形性信息的性能。因此,选取不同的数据掩盖方式能够使SSIM指数实现不同剂量学参数(HI、CI)的功能。针对SSIM指数及子参数计算时简单加窗可能会导致不良“分块”效应的问题[14],研究发现计算过程中由于窗口尺寸较小导致是否采用标准差为1.5的圆对称高斯加权函数(circular-symmetric Gaussian weighting function, CSGW)作为加权窗口来消除“分块”效应并不影响SSIM指数与HI、CI的相关性结论,并且未采用CSGW的数据结果与HI、CI存在的相关性会更加显著,同时数据结果的差异会随评价区域与窗口体积之比增大而减小,因此在计算过程中未采用CSGW。
SSIM指数在计划质量评估领域提供了更为丰富的信息,但该指数中存在冗余的信息。当评价的区域剂量极差较小时,亮度参数与对比度参数从理论上都在反映剂量的均匀性,剂量的结构等问题容易被SSIM指数忽视。因此,深入分析子参数之间的关联性、在子参数中剔除重复信息可作为后续研究内容,有助于保持计划质量的一致性。
利益冲突 所有作者声明不存在利益冲突
作者贡献 王清莹负责数据采集分析和论文起草;刘嘉城、王翰林参与代码编写和调试;姚凯宁协助论文撰写与修改;尤静、李小凡负责临床方案设计的审核与数据审核;王若曦、马超琼指导代码编写与论文修改;吴昊指导和设计研究项目
| [1] |
Ruan D, Shao W, Demarco J, et al. Evolving treatment plan quality criteria from institution-specific experience[J]. Med Phys, 2012, 39(5): 2708-2712. DOI:10.1118/1.4704497 |
| [2] |
Nelms BE, Robinson G, Markham J, et al. Variation in external beam treatment plan quality: an inter-institutional study of planners and planning systems[J]. Pract Radiat Oncol, 2012, 2(4): 296-305. DOI:10.1016/j.prro.2011.11.012 |
| [3] |
Shaw E, Kline R, Gillin M, et al. Radiation Therapy Oncology Group: radiosurgery quality assurance guidelines[J]. Int J Radiat Oncol Biol Phys, 1993, 27(5): 1231-1239. DOI:10.1016/0360-3016(93)90548-A |
| [4] |
Riet A, Mak Ad, Moerland MA, et al. A conformation number to quantify the degree of conformality in brachytherapy and external beam irradiation: application to the prostate[J]. Int J Radiat Oncol Biol Phys, 1997, 37(3): 731-736. DOI:10.1016/S0360-3016(96)00601-3 |
| [5] |
Feuvret L, Noël G, Mazeron JJ, et al. Conformity index: a review[J]. Int J Radiat Oncol Biol Phys, 2006, 64(2): 333-342. DOI:10.1016/j.ijrobp.2005.09.028 |
| [6] |
Kataria T, Sharma K, Subramani V, et al. Homogeneity index: an objective tool for assessment of conformal radiation treatments[J]. J Med Phys, 2012, 37(4): 207-213. DOI:10.4103/0971-6203.103606 |
| [7] |
Wu Q, Mohan R, Morris M, et al. Simultaneous integrated boost intensity-modulated radiotherapy for locally advanced head-and-neck squamous cell carcinomas. I: dosimetric results[J]. Int J Radiat Oncol Biol Phys, 2003, 56(2): 573-585. DOI:10.1016/S0360-3016(2)04617-5 |
| [8] |
Semerenko VA, Reitz B, Day E, et al. Evaluation of a commercial biologically based IMRT treatment planning system[J]. Med Phys, 2008, 35(12): 5851-5860. DOI:10.1118/1.3013556 |
| [9] |
Paddick I, Lippitz B. A simple dose gradient measurement tool to complement the conformity index[J]. J Neurosurg, 2006, 105(Suppl): 194-201. DOI:10.3171/sup.2006.105.7.194 |
| [10] |
Sung K, Choi YE. Dose gradient curve: a new tool for evaluating dose gradient[J]. PLoS One, 2018, 13(4): e0196664. DOI:10.1371/journal.pone.0196664 |
| [11] |
Clarke S, Goodworth J, Westhuyzen J, et al. Software-based evaluation of a class solution for prostate IMRT planning[J]. Rep Pract Oncol Radiother, 2017, 22(6): 441-449. DOI:10.1016/j.rpor.2017.08.001 |
| [12] |
Low DA, Harms WB, Mutic S, et al. A technique for the quantitative evaluation of dose distributions[J]. Med Phys, 1998, 25(5): 656-661. DOI:10.1118/1.598248 |
| [13] |
Wang Z, Bovik AC. A universal image quality index[J]. IEEE Signal Process Lett, 2002, 9(3): 81-84. DOI:10.1109/97.995823 |
| [14] |
Wang Z, Bovik AC, Sheikh HR, et al. Image quality assessment: from error visibility to structural similarity[J]. IEEE Trans Image Process, 2004, 13(4): 600-612. DOI:10.1109/tip.2003.819861 |
| [15] |
Peng J, Shi C, Laugeman E, et al. Implementation of the structural SIMilarity (SSIM) index as a quantitative evaluation tool for dose distribution error detection[J]. Med Phys, 2020, 47(4): 1907-1919. DOI:10.1002/mp.14010 |
| [16] |
Bawazeer O, Sarasanandarajah S, Herath S, et al. Sensitivity of electronic portal imaging device (EPID) based transit dosimetry to detect inter-fraction patient variations[J]. World Cong Med Phys Biomed Eng, 2019, 68(3): 477-480. DOI:10.1007/978-981-10-9023-3_86 |
| [17] |
Ma C, Wang R, Zhou S, et al. The structural similarity index for IMRT quality assurance: radiomics-based error classification[J]. Med Phys, 2021, 48(1): 80-93. DOI:10.1002/mp.14559 |
| [18] |
Mambretti M, Romanò C, Marvaso G, et al. A global Unified Dosimetry Index (gUDI) to evaluate simultaneous integrated boost radiotherapy plans in prostate cancer[J]. Radio Oncol, 2018, 128(2): 315-320. DOI:10.1016/j.radonc.2018.06.002 |
| [19] |
Yoon M, Park SY, Shin D, et al. A new homogeneity index based on statistical analysis of the dose-volume histogram[J]. J Appl Clin Med Phys, 2007, 8(2): 9-17. DOI:10.1120/jacmp.v8i2.2390 |
| [20] |
Yan L, Xu Y, Chen X, et al. A new homogeneity index definition for evaluation of radiotherapy plans[J]. J Appl Clin Med Phys, 2019, 20(11): 50-56. DOI:10.1002/acm2.12739 |
 2021, Vol. 41
2021, Vol. 41


