2. 中国科学技术大学物理学院, 合肥 230026
2. School of Physics, University of Science and Technology of China, Hefei 230026, China
近距离放疗是最早出现的肿瘤放疗技术,也是近年来国内放疗领域研究的热点,其中125I放射性粒子植入技术以半衰期短易于防护、单位质量活度高、永久植入无需取出等优点,广泛应用于前列腺癌、乳腺癌、软组织肿瘤、骨转移癌等肿瘤的临床治疗。
目前,临床常用的近距离放疗剂量计算方法[1-2]是将人体视为固定体积的均匀水介质,再利用剂量率计算公式进行剂量计算。由于125I放射源释放能量为低能γ光子,其与物质的相互作用方式以光电效应为主,能量沉积受组织成分和密度影响相对较大。因此,本研究拟通过蒙特卡罗方法建立125I放射源物理模型,对比其在人体不同组织(前列腺、乳腺、肌肉、骨)中的剂量分布情况,为临床粒子布源和剂量计算评估提供理论参考。
材料与方法 1、OncoSeed 6711型125I的蒙特卡罗模型本研究中使用的是美国Oncura公司生产的OncoSeed 6711型125I放射源[3],平均光子能量为28.39 keV,半衰期为59.4 d。粒子放射源总长度为4.55 mm,放射源内部包含一个圆柱型的银棒,银棒表面均匀镀AgBr和AgI混合形成的涂层,外层为钛包壳。
2、剂量计算相关参数及公式本研究主要涉及的剂量计算参数为剂量率常数和径向剂量函数。剂量率常数是描述放射性粒子源剂量特性的绝对量,是精确剂量计算的关键参数。剂量率常数Λ定义[5]如公式(1)所示,单位为cGy·h-1·U-1,其中1 U=1 cGy·cm2·h-1。
| $ \mathit{\Lambda } = \frac{{\dot D({r_0},{\theta _0})}}{{{S_k}}} $ | (1) |
式中,
| $ {S_k} = \dot K{_{{\rm{air}}}}\left( d \right){d^2} $ | (2) |
式中,
径向剂量函数定义如公式(3)所示,用于描述沿着放射源中垂线方向由于吸收和散射引起的剂量衰减情况。其中,GL(r, θ)为线源几何因子,代表源本身因几何形状和内部活性分布对射源周围剂量率的影响,定义如(4)式,式中,L为源有效活性长度,β为任意点对射源前后端的夹角。
| $ {g_L}\left( r \right) = \frac{{\dot D(r,{\theta _0})}}{{\dot D({r_0},{\theta _0})}}\cdot\frac{{\dot G{_L}({r_0},{\theta _0})}}{{{{\dot G}_L}(r,{\theta _0})}} $ | (3) |
| $ {G_L}\left( {r,\theta } \right) = \frac{1}{{{r^2} - \frac{{{L^2}}}{4}}}\left( {\theta = 0} \right) $ | (4) |
此外,本研究计算125I放射性粒子永久植入后各组织不同径向位置的吸收剂量。公式(5)是蒙卡计算结果转换成介质中吸收剂量的计算公式:
| $ D_{_{{\rm{tot}}}}^{^j} = {[{S_k}]_{{\rm{max}}}}\frac{{{{\bar D}^j}}}{{S_{_k}^{^{{\rm{hist}}}}}}\tau $ | (5) |
式中,
本研究使用的蒙特卡罗模拟软件是egs_brachy[4-5],该软件基于EGSnrc平台研发,是专用于近距离治疗剂量计算的快速蒙卡软件。模拟中使用的光子截面库为XCOM库,每次模拟的history数为109。计算剂量率常数时,建立125I放射源位于30 cm3立方水模体中心的物理计算模型,体元为0.01 cm;电子和光子截止能量分别设置为1.512 MeV和5 keV。计算介质吸收剂量率时,将放射源置于高30 cm,半径为15 cm的圆柱型均匀介质模体中心,电子和光子截止能量分别为1.512 MeV和1 keV。在距源不同位置划分不同大小体元,如在径向距离r < 1 cm,采用0.01 cm的体元;在1 cm≤r < 5 cm时,采用0.05 cm体元;在5 cm≤r < 10 cm时,采用0.1 cm体元;在r≥10 cm范围内,采用0.2 cm体元。模拟采用美国辐射防护与测量委员会(NCRP)58号[6]报告给出的125I放射源光子能谱,即发射的光子能量分别为3.770、27.202、27.472、31.000、35.492 keV,对应每次衰变发出的光子数分别为0.150、0.397、0.741、0.257、0.067。本研究模拟了多种组织模型,如水、前列腺、乳腺、肌肉、骨,其对应的元素成分及密度参考国际辐射测量与单位委员会(ICRU)44号报告[7]和文献[8]数据,见表 1。
|
|
表 1 模拟的人体组织元素组成及其密度(g/cm3) Table 1 Elemental composition and density (g/cm3) of different types of human simulated tissue |
结果 1、剂量率常数和水中径向剂量函数验证
首先,模拟得出水中参考位置处吸收剂量率,再利用模拟得到的源中垂线10cm处的光子能谱,经公式推导及单位转换,得出单位活度空气比释动能强度,最终研究得到的剂量率常数值为0.950 cGy·h-1·U-1,该值与国外研究结果0.942和0.932 cGy·h-1·U-1[3, 5]吻合较好,分别相差0.849%和1.931%。
将模拟计算得到放射源径向不同位置(0.05~10 cm)吸收剂量率,将其代入公式(3),得出由于吸收和散射造成沿放射源中垂线方向剂量衰减的径向剂量函数g(r)。表 2给出了本研究水中径向剂量函数和TG43U1报告[2]和Safigholi等[9]研究数据的对比情况,本研究径向剂量函数结果与文献报道的数据近似,二者最大相对误差 < 3%。
|
|
表 2 不同研究125I粒子源水中各径向位置处的径向剂量函数g(r) Table 2 Radial dose functiong(r)of 125I seeds in water at various radial positionsin different studies |
2、不同介质的径向剂量函数
根据表 1给出的各人体组织元素组成和密度表,本研究分别建立植入125I放射源的不同介质物理模型,图 1是计算得出的不同介质中125I的径向剂量分布函数情况,在骨介质中径向剂量函数跌落最为显著,径向距离1.5 cm内径向函数快速跌落,之后基本趋于恒定。观察其他介质,在近源位置处所有介质中的径向剂量函数有一波动,呈先上升后下降趋势,而当径向距离>1 cm后,在不同介质中的径向剂量函数出现更为明显差异。根据径向函数随距离变化幅度将介质排序,从大到小依次为骨、肌肉、前列腺、水、乳腺,其中前列腺、肌肉与水的径向剂量函数较为接近。
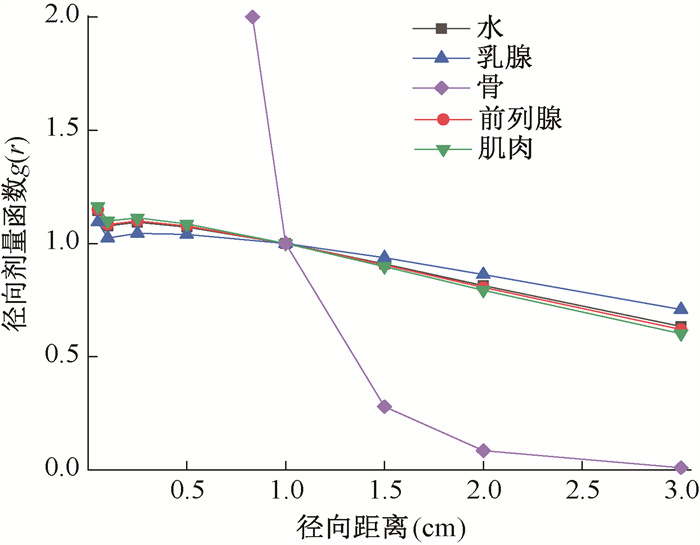
|
图 1 125I在不同介质中的径向剂量函数曲线 Figure 1 Radial dose function of 125I seeds in different tissue media |
3、不同介质的吸收剂量
为验证本研究吸收剂量计算准确性,参考杨瑞杰等[10]的研究报道,本研究将125I放射源强度初始强度设为100 U,计算水中不同位置吸收剂量与AAPM TG 43U1号报告[2]的参考数据作对比,结果见表 3。对比本研究计算剂量和报告参考值,在距离为0.5 cm时差异最小为-0.07%。在3 cm时差异最大为3.067%。当距源的径向距离>3 cm后,本研究结果与参考数据差异 < 2%。
|
|
表 3 不同研究的125I粒子源在水中各径向位置处的吸收剂量(Gy) Table 3 Absorbed dose of the 125I seeds in water at various radial positions in different studies (Gy) |
图 2给出了不同径向位置处,125I放射性粒子在各介质中吸收剂量曲线对比。结果显示,肌肉、前列腺与水的吸收剂量曲线非常接近,差异 < 5%。骨介质中吸收剂量曲线跌落最为显著,当径向距离 < 1 cm,骨中吸收剂量明显大于水中剂量;数据结果显示当距源0.05 cm处,骨中吸收剂量是水中的6.042倍。而乳腺吸收剂量始终小于水中,在径向距离1.7 cm内,乳腺与水中吸收剂量差异均>10%。
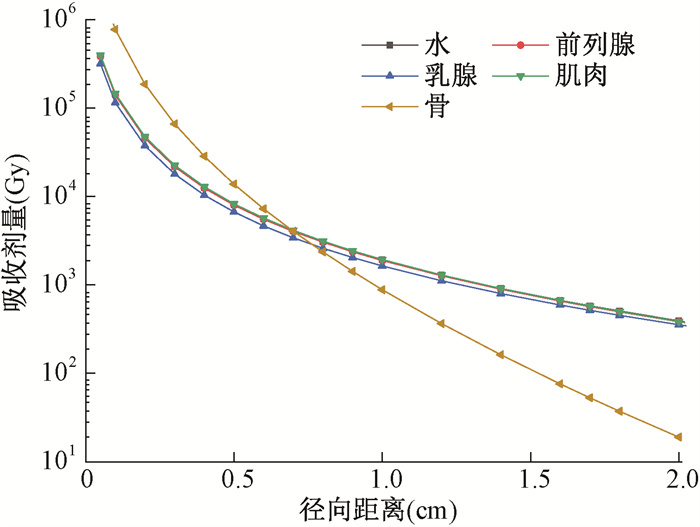
|
图 2 125I粒子在不同介质中吸收剂量曲线 Figure 2 Absorbed dose curves of 125I seeds in different tissue media |
讨论
放射性粒子永久植入是被证实非常有效的局部肿瘤治疗手段,近年来在我国得到了快速发展和广泛推广[11]。郭金和等[12]研究指出精确剂量计算是保证放射性粒子治疗肿瘤质量的关键环节,在此基础上才可顺利完成术前计划、术中/术后验证的标准化流程。临床治疗计划系统是假设人体为一定体积的纯水,忽略人体不同组织密度成分差异、忽略粒子源包壳成分等因素对剂量分布的影响。由于低能粒子源释放的射线能量较低,介质中辐射范围小,热释光探测器等常用实验测定元件使用受限。因此,通常使用剂量计算“黄金准则”蒙特卡罗方法对低能粒子剂量学进行模拟研究。Oliveira等[13]随机选取了100名前列腺粒子植入计划,利用肿瘤CT值转换为组织密度,并采用MCNP计算的靶区V150、D90等剂量评估参数分别比TG43U1公式法低13.0%和5.8%。随着粒子近距离精准治疗和消融技术的提出和推广,125I植入已不仅仅局限于传统前列腺癌的治疗,更开启了头颈部、胸部及腹部等全身各部位肿瘤治疗的新时代。因此,本研究采用蒙特卡罗方法对125I在不同组织中的剂量学参数和吸收剂量分布进行模拟计算。
本研究中,首先利用egs_brachy蒙特卡罗软件完成了OncoSeed 6711型125I粒子的精细几何结构模型建立,通过模拟计算得出光子通量谱和水中吸收剂量,经公式推导和单位转换,得出剂量率常数为0.950 cGy·h-1·U-1,同时本研究的水中径向剂量函数均与文献报道[2, 9]基本一致,验证了本研究所建立的物理计算模型的可靠性,进而保证后续不同介质中吸收剂量计算的准确。其次,125I粒子在不同介质的径向剂量函数分布情况显示,骨介质中径向剂量函数的快速跌落最为明显,原因在于径向剂量函数描述由于吸收和散射引起的剂量下降,而骨介质的有效原子序数、质能吸收系数均大于其他介质,使得光电效应导致的剂量沉积现象最为显著。其余介质的近源位置径向剂量函数呈先上升后下降的趋势,与孙吉宁等[14]研究结果吻合。总体来看,肌肉、前列腺的径向剂量函数大于乳腺,且与水接近。最后,本研究中125I粒子在不同介质中不同径向位置处吸收剂量数据表明,前列腺、肌肉与水中吸收剂量的差异 < 5%。而在近源位置(径向距离 < 0.6 cm),骨介质中吸收剂量迅速沉积,甚至是同样位置处水中剂量数倍,该差异不可忽视。同样,乳腺中吸收剂量要明显小于水中,在125I射线的平均穿透距离1.7 cm内[15],二者最小差异均>10%,在临床剂量计算及评估中需引起关注。
综上,本研究基于125I粒子植入的蒙卡计算模型,初步分析了不同组织和水中吸收剂量差异,明确了组织的元素成分及密度会对粒子植入治疗剂量分布的影响,为临床剂量评估提供一定参考。随着125I粒子植入技术在全身各部位肿瘤治疗中不断应用发展,将对剂量计算和评估的精确性提出更高要求,考虑组织非均匀性的125I粒子植入剂量计算研究前景广阔。
利益冲突 所有署名作者按以下贡献声明独立开展,未接受有关公司的任何赞助,不涉及各相关方的利益冲突
志谢 感谢中国科学技术大学基本科研业务费创新团队培育基金(WK2030040089)
作者贡献声明 吴爱林负责构思、模拟计算、论文撰写;姜潇负责英文摘要、图表修改;吴爱东、朱磊、杨益东负责论文修改;刘云琴、钱立庭负责病例选择、协助写作
| [1] |
Nath R, Anderson LL, Luxton G, et al. Dosimetry of interstitial brachytherapy sources: recommendations of the AAPM Radiation Therapy Committee Task Group No 43[J]. Med Phys, 1995, 22(2): 209-234. DOI:10.1118/1.597458 |
| [2] |
Rivard MJ, Coursey BM, DeWerd LA, et al. Update of AAPM Task Group No 43 report: a revised AAPM protocol for brachytherapy dose calculations[J]. Med Phys, 2004, 31(3): 633-674. DOI:10.1118/1.1646040 |
| [3] |
Dolan J, Li Z, Williamson JF. Monte Carlo and experimental dosimetry of an 125I brachytherapy seed[J]. Med Phys, 2006, 33(12): 4675-4684. DOI:10.1118/1.2388158 |
| [4] |
Chamberland MJP, Taylor REP, Rogers DWO, et al. egs_brachy: a versatile and fast Monte Carlo code for brachytherapy[J]. Phys Med Biol, 2016, 61(23): 8214-8231. DOI:10.1088/0031-9155/61/23/8214 |
| [5] |
Safigholi H, Chamberland MJP, Taylor REP, et al. Update of the CLRP TG-43 parameter database for low-energy brachytherapy sources[J]. Med Phys, 2020, 47(9): 4656-4669. DOI:10.1002/mp.14249 |
| [6] |
National Council on Radiation Protection and Measurements. NCRP Report No 58: a handbook of radioactivity measurements procedures, 2nd edition[R]. Bethesda: NCRP, 1985.
|
| [7] |
White DR, Booz J, Griffith RV, et al. ICRU Report No 44: Tissue substitutes in radiation dosimetry and measurement[R]. Oxford: Pergamon Press, 1989. DOI: 10.1093/jicru/os23.1.
|
| [8] |
Woodard HQ, White DR. The composition of body tissues[J]. Brit J Radiol, 1986, 59(708): 1209-1218. DOI:10.1259/0007-1285-59-708-1209 |
| [9] |
Safigholi H, Chamberland MJP, Taylor REP, et al. The CLRP TG-43 parameter database for brachytherapy, version 2[M/OL]. Ottawa: Carleton Laboratory for Radiotherapy Physics (CLRP) Press, 2020-05-05. https://physics.carleton.ca/clrp/seed_database.
|
| [10] |
杨瑞杰, 杨瑞学, 王俊杰. 放射性粒子植入计划系统剂量计算准确性验证[J]. 中华放射医学与防护杂志, 2011, 31(4): 493-495. Yang RJ, Yang RX, Wang JJ. Verification study the accuracy of dose calculation in the radioactive particle implantation planning system[J]. Chin J Radiol Med Prot, 2011, 31(4): 493-495. DOI:10.3760/cma.j.issn.0254-5098.2011.04.033 |
| [11] |
王俊杰. 放射性粒子近距离精准与消融治疗[J]. 中华放射医学与防护杂志, 2021, 41(1): 1-2. Wang JJ. The precision and ablation of radioactive seed interstitial brachytherapy[J]. Chin J Radiol Med Prot, 2021, 41(1): 1-2. DOI:10.3760/cma.j.issn.0254-5098.2021.01.001 |
| [12] |
郭金和, 胡效坤, 滕皋军. 放射性粒子治疗技术行业存在的问题和发展方向[J]. 中华医学杂志, 2017, 97(19): 1444-1445. Guo JH, Hu XK, Teng GJ. The industry problems and the direction for the brachytherapy[J]. Natl Med J China, 2017, 97(19): 1444-1445. DOI:10.3760/cma.j.issn.0376-2491.2017.19.002 |
| [13] |
Oliveira SM, Teixeira NJ, Fernandes L, et al. Tissue composition and density impact on the clinical parameters for 125I prostate implants dosimetry[J]. Phys Med, 2014, 30(7): 799-808. DOI:10.1016/j.ejmp.2014.06.042 |
| [14] |
孙吉宁, 樊铁栓, 杨元第, 等. 6711型125I种子源剂量学参量的蒙特卡罗模拟研究[J]. 中华放射医学与防护杂志, 2008, 28(2): 179-183. Sun JN, Fan TSH, Yang YD, et al. Monte Carlo determination of dosimetry parameters for model 6711 125I seed[J]. Chin J Radiol Med Prot, 2008, 28(2): 179-183. DOI:10.3760/cma.j.issn.0254-5098.2008.02.028 |
| [15] |
中国抗癌协会肿瘤微创治疗专业委员会粒子治疗分会. 放射性125I粒子病房辐射防护管理标准专家共识[J]. 中华医学杂志, 2017, 97(19): 1455-1456. Committee of Minimally Invasive Therapy in Oncology, Chinese Anti-Cancer Association. Standard for management of radiation protection in radioactive 125I seed wards[J]. Natl Med J China, 2017, 97(19): 1455-1456. DOI:10.3760/cma.j.issn.0376-2491.2017.19.006 |
 2021, Vol. 41
2021, Vol. 41


