放射性125I粒子植入能有效治疗肝细胞癌(HCC)原发灶及转移灶,从而改善HCC患者的生活质量,延长生存时间[1-2],125I粒子植入治疗已逐渐成为中晚期HCC综合治疗的重要手段之一。尽管125I粒子治疗HCC的分子机制已有报道[3],但是125I粒子对肝癌的新生血管形成的影响鲜有报道,分子机制仍需进一步探索。本研究通过观察125I粒子对移植瘤生长、微血管密度(MVD)及血管内皮生长因子-A(VEGF-A)、缺氧诱导因子1α(HIF-1α)表达的影响,探讨125I粒子治疗肝癌的潜在机制,为指导临床应用该技术提供一定的实验依据和理论参考。
材料与方法 1、材料及实验动物肝癌细胞株Huh7购自美国菌种保藏中心(美国ATCC公司),胎牛血清(美国Hyclone公司),DMEM培养液(美国Hyclone公司),4~6周龄健康雄性BALB/c裸鼠15只[SCXK(湘)-2019-0004](重庆恩斯维尔生物科技有限公司),体重20.0~24.0 g,饲养于第三军医大学第一附属医院动物实验中心SPF级动物房。本研究获得中国人民解放军第三军医大学伦理委员会批准(伦理号:AMUWEC20200407)。放射性125I粒子(北京智博高科技生物技术有限公司),活度为2.96×107Bq,半衰期59.6 d。
2、裸鼠皮下移植瘤模型的构建用含10%胎牛血清的DMEM培养液,37 ℃、5% CO2培养Huh7细胞。取对数生长期细胞,制成单细胞悬液,浓度调整为1×107/ml,取100 μl细胞悬液接种于裸鼠右后肢皮下,当移植瘤体积达250 mm 3左右时进行粒子植入手术。
3、实验分组、粒子植入及剂量计算从15只裸鼠中挑选移植瘤大小相当的12只裸鼠进行实验,随机数表法随机将其分为观察组和对照组,每组6只。观察组每个移植瘤内植入1枚活度为2.96×107Bq的125I粒子。对照组每个移植瘤内植入一枚无活度的空粒子。粒子植入后累计辐射剂量用治疗计划系统(TPS)计算。移植瘤第n(4、8、12、16、20、24、28)天累计接受的辐射剂量等于粒子植入后第0天时的D100(100%肿瘤体积接受的剂量)减去第n天时D100。完成125I粒子植入术后各组动物分笼饲养。在粒子植入过程中,做好辐射防护措施。
4、观察移植瘤生长、获取移植瘤组织标本粒子植入当天为第0天,粒子植入后每4天用游标卡尺测量移植瘤的长径(a)和短径(b),根据肿瘤体积计算公式(V)=a×b2/2计算移植瘤体积,观察并记录两组移植瘤体积曲线的变化趋势。随访28 d后将裸鼠处死、取移植瘤组织分成两部分,一部分用于做石蜡切片,一部分用于提取组织的RNA。
5、免疫组织化学法检测移植瘤MVD及VEGF-A、HIF-1α蛋白的表达用多聚甲醛对移植瘤组织进行固定,然后常规石蜡包埋、切片。依次进行二甲苯脱蜡、梯度乙醇脱水、过氧化氢阻断内源性酶活性、抗原修复、封闭,用磷酸盐缓冲液(PBS)洗涤切片后孵育一抗(CD31,1 ∶100,美国Abcam公司;VEGF-A、HIF-1α,1 ∶100,美国Affinity公司)4 ℃过夜;用PBS洗涤切片后孵育二抗1 h,然后进行二氨基联苯胺(DAB)染色、苏木精复染,中性树胶封片后在光学显微镜下观察、拍照。用Weidner方法来判断肿瘤微血管及计算MVD[4]。在微血管密集区,记录每高倍镜(×400)下微血管数目,每张切片取3个高倍视野,3个视野血管数目的平均值为微血管密度。用Image Pro Plus软件测量免疫组织化学染色图像的平均吸光度(A)值,每个组织一个切片,每张切片取5个视野的平均A值为该标本、该指标蛋白的相对表达量。
6、实时荧光定量聚合酶链反应(RT-PCR)检测血管生成因子mRNA的表达用TRIzol(美国Invitrogen公司)提取组织中总RNA。然后,反转录用Evo M-MLV RT Kit with gDNA Clean for qPCR试剂盒(长沙艾科瑞生物工程有限公司)反转录成cDNA。接下来以cDNA为模板,采用SYBR绿色荧光染色法进行扩增,反应体系及反应条件按试剂商提供的进行。用2-ΔΔCt相对定量法比较各基因表达差异。引物由美国Genecopoeia公司设计、合成,VEGF-A,正向引物:G G C A G A A T C A T C A C G A A G T G,反向引物:C G A T C T C A T C A G G G T A C T C C T;HIF-1α,正向引物:T G T A C C C T A A C T A G C C G A G G A A,反向引物:A T C A G C A C C A A G C A G G T C A T A G;内参GAPDH,正向引物:T C A A G A A G G T G G T G A A G C A G G,反向引物:A G C G T C A A A G G T G G A G G A G T G。
7、统计学处理采用GraphPad 8.0软件进行分析,计量资料符合正态分布,以x ±s表示,组间差异采用独立样本t检验。P < 0.05为差异有统计学意义。
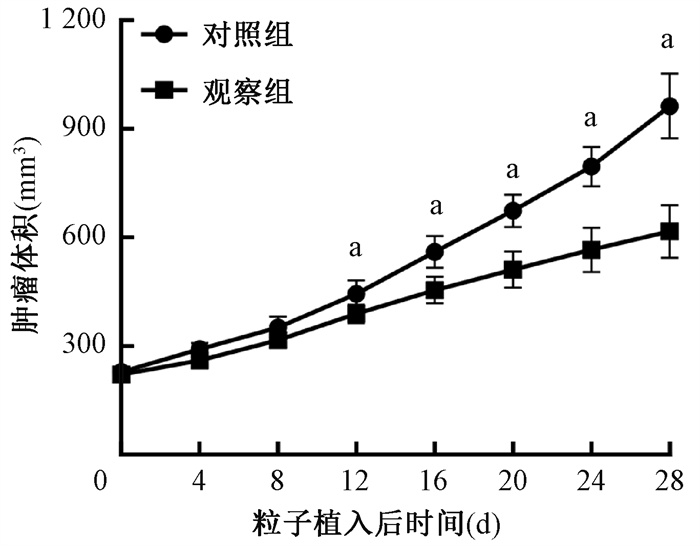
结果 1、125I粒子抑制肿瘤生长从图 1可以看出,观察组与对照组移植瘤体积均随时间延长而增加,但观察组肿瘤生长速度明显比对照组慢,在125I粒子植入后第12天,两组肿瘤体积比较差异有统计学意义(t=3.167, P < 0.05),而且,随着观察时间的延长,两组肿瘤体积的差距越来越增大。表明125I粒子可抑制肝癌细胞Huh7移植瘤的生长。
|
a与对照组比较,t=3.167、4.568、5.671、6.382、7.122,P < 0.05 图 1 粒子植入后两组裸鼠移植瘤生长曲线 Figure 1 Growth curve of transplanted tumor in nude mice of two indicated groups |
2、移植瘤增长速度与辐射剂量的关系
图 2显示,观察组移植瘤所受辐射剂量随时间延长逐渐增加,28 d后累计辐射剂量为(991.30±62.23)cGy。随辐射剂量的增加,观察组移植瘤在每个观察点前4 d体积的增加量先增加后逐渐减少,第8~12天体积增加量达最大,为(72.45±8.98)mm3。由此说明125I粒子植入后并不能立即表现出抑瘤作用,需要达到一定时间及一定辐射剂量后才开始显示抑瘤效果。

|
图 2 观察组移植瘤不同时间点累计辐射剂量和体积的增加量 Figure 2 The cumulative radiation dose and the volume of transplanted tumor in the observation group at different time points after 125I seed implantation |
3、125I粒子降低肿瘤MVD
CD31是血管内皮细胞特异表达的分子,可以通过检测CD31表达的多少来反映MVD。CD31在对照组和观察组切片中均有阳性表达,但观察组微血管密度(13.17±2.48)个/视野低于对照组(21.83±2.23)个/视野,差异有统计学意义(t=6.360,P < 0.05)。说明125I粒子可降低肝癌细胞HuH7移植瘤的微血管密度。
4、125I粒子抑制VEGF、HIF-1αmRNA的表达与对照组表达量比较,观察组裸鼠皮下移植瘤中、VEGF-A、HIF-1α mRNA相对表达量分别为(0.588 0±0.096 2)、(0.715 0±0.107 6),差异均有统计意义(t=10.480、6.414,P<0.05)。
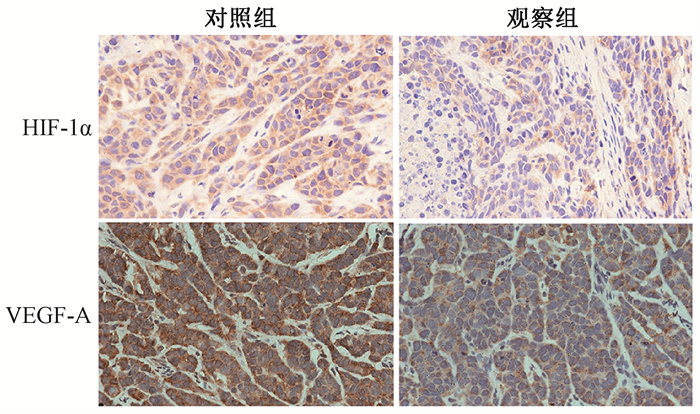
5、125I粒子抑制VEGF-A、HIF-1α蛋白表达VEGF-A、HIF-1α在对照组和观察组切片中均有阳性表达,但观察组VEGF-A、HIF-1α阳性表达水平(39.09±4.91)、(15.7±2.90)分别低于对照组(70.06±6.38)、(29.20±4.60),差异均有统计学意义(t=10.89、12.25,P < 0.05)。说明125I粒子可抑制VEGF-A、HIF-1α蛋白表达, 见图3。
|
HIF-1α.缺氧诱导因子1α;VEGF-A.血管内皮生长因子-A 图 3 两组裸鼠移植瘤HIF-1α和VEGF-A蛋白表达SP染色×400 Figure 3 Protein expression of HIF-1α and VEGF-A in the transplanted tumors of two groups SP staining ×400 |
讨论
肿瘤微血管形成是恶性肿瘤的十大特征之一[5]。肝癌是一种高血管化的肿瘤,其血管生成与疾病的复发、进展和转移密切相关[6]。低能、低剂量率的放射性125I粒子植入因靶区剂量高、周围剂量低的优点,逐渐成为于中晚期肝癌局部治疗的选择。既往研究表明,放射性125I粒子通过抑制细胞增殖、诱导细胞凋亡、阻滞细胞周期以及调控代谢等多种途径发挥抑瘤作用[7-8]。近年来,有研究表明抑制肿瘤血管形成也是125I粒子抑制肿瘤生长的重要机制之一[9]。然而,125I粒子对肝癌血管形成的影响及分子机制尚不完全清楚。
肿瘤血管不仅提供肿瘤生长所必须的物质,同时还为肿瘤细胞的侵袭及转移创造了条件[6]。辐射除了直接杀伤肿瘤细胞外,还可以通过影响肿瘤微血管形成来抑制肿瘤生长。Ma等[10]将125I粒子植入直肠癌HCT-8细胞裸鼠移植瘤模型后发现,与对照组相比,实验组肿瘤生长受到抑制,而且肿瘤组织中MVD明显减少。向桂玲等[11]在125I粒子植入对肺腺癌裸鼠移植瘤微血管生成影响的研究中发现,125I粒子明显降低了肺腺癌裸鼠移植瘤组织的MVD。本研究与既往研究结果一致,125I粒子植入使肝癌Huh7细胞移植瘤组织的MVD明显减少。
MVD的减少是破坏已形成的肿瘤微血管和抑制新生血管形成的共同结果。辐射通过诱导内皮细胞凋亡而破坏肿瘤血管[12],此外,辐射通过影响肿瘤微环境中多种细胞因子的表达来干扰新生血管形成。肿瘤新生血管形成受多种促血管生成因子和抑血管生成因子共同调控,其中,VEGF是促血管生成特性最强的细胞因子,主要是由肿瘤细胞分泌。既往研究表明,与邻近正常组织相比,肝癌组织中VEGF呈明显高表达,且与肝癌的发生、发展及预后密切先关[13]。VEGF通过与存在于血管内皮细胞表面受体(VEGF-R)结合,不仅促进血管生成,还可以增加血管通透性,从而有利于肿瘤细胞的侵袭及迁移。鉴于本研究的目的是探讨125I粒子对肝癌细胞的影响,所以主要观察VEGF-A表达水平的变化。吴立兵等[14]将125I粒子植入肺癌A549细胞裸鼠移植瘤模型后,发现肺癌肿瘤组织中VEGF的mRNA和其蛋白表达均较对照组明显减少。Zhang等[15]在125I粒子植入对胃癌移植瘤影响的研究中,同样发现125I粒子植入抑制胃癌抑制组织中VEGF的表达,本研究结果与既往研究一致,125I粒子通过降低VEGF的表达抑制肿瘤新生血管形成。
HIF-1α作为一种参与肿瘤基因低氧适应过程的转录因子,在人类癌症中常被上调。既往研究发现,HIF-1α与VEGF、MVD存在明显的相关性。而且,HIF-1α可以上调包括VEGF在内的多种与血管形成有关的基因表达,最终促进肿瘤血管形成。刘登尧等[16]的研究表明,125I粒子降低了人肺腺癌A549细胞移植瘤组织中HIF-1α mRNA及蛋白的表达。与本研究结果一致。此外,有研究发现粒子植入后肿瘤氧分压增加,并推测HIF-1α减低的原因除了与基因表达减低有关外,还可能与氧分压增加间接刺激HIF-1α的分泌减少有关[17]。也有研究显示125I粒子增加线粒体活性氧(ROS)的产生,从而上调人结直肠癌HCT116细胞中HIF-1α的表达[18]。导致此差异的具体原因尚不清楚,可能是不同细胞对125I粒子辐射的反应不同。
本研究通过对肝癌细胞裸鼠皮下移植瘤模型植入放射性125I粒子,模拟125I粒子治疗肝癌的作用,初步证实125I粒子通过抑制肝癌微血管形成,进而抑制肿瘤生长,其潜在的分子机制与VEGF-A、HIF-1α的表达减少有关。然而,本研究仅探讨了125I粒子对VEGF-A、HIF-1α的影响,其他血管形成因子是否受影响尚不清楚。此外,本研究发现随辐射剂量增加,移植瘤生长速度逐渐降低,而125I粒子对肝癌血管形成的影响是否具有剂量依赖性还有待研究。为此,本研究存在的不足之处将作为下一步研究的重点。
利益冲突 所有作者声明不存在利益冲突
作者贡献声明 杨崇双、黄学全负责论文的设计、撰写、修改;刘平平、肖云华负责实验的操作、数据的收集以及文章校正;刘鹤男李良山李廷源负责论文实验数据统计及分析
| [1] |
Zhu ZX, Wang XX, Yuan KF, et al. Transarterial chemoembolization plus iodine-125 implantation for hepatocellular carcinoma: a systematic review and meta-analysis[J]. HPB (Oxford), 2018, 20(9): 795-802. DOI:10.1016/j.hpb.2018.03.015 |
| [2] |
陈玉潇, 何闯, 杨丽, 等. CT引导下125I粒子植入治疗肝细胞癌脊柱转移的临床分析[J]. 第三军医大学学报, 2018, 40(12): 1130-1135. Chen YX, He C, Yang L, et al. Clinical analysis of CT guided ~(125) I seed implantation in the treatment of spinal metastasis of hepatocellular carcinoma[J]. J Third Milit Med Univ, 2018, 40(12): 1130-1135. DOI:10.16016/j.1000-5404.201803014 |
| [3] |
Zheng J, Luo J, Zeng H, et al. 125I suppressed the Warburg effect viaregulating miR-338/PFKL axis in hepatocellular carcinoma[J]. Biomed Pharmacother, 2019, 119: 109402. DOI:10.1016/j.biopha.2019.109402 |
| [4] |
Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J]. Breast Cancer Res Treat, 1995, 36(2): 169-180. DOI:10.1007/BF00666038 |
| [5] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [6] |
Zhang Q, Wu J, Bai X, et al. Evaluation of intra-tumoral vascularization in hepatocellular carcinomas[J]. Front Med (Lausanne), 2020, 7: 584250. DOI:10.3389/fmed.2020.584250 |
| [7] |
Wang C, Li TK, Zeng CH, et al. Inhibition of endoplasmic reticulum stress-mediated autophagy enhances the anticancer effect of iodine-125 seed radiation on esophageal squamous cell carcinoma[J]. Radiat Res, 2020, 194(3): 236-245. DOI:10.1667/RADE-20-00057.1 |
| [8] |
Zhang J, Zhu Y, Dong M, et al. Iodine-125 interstitial brachytherapy reduces tumor growth via Warburg effect inhibition in non-small cell lung cancer A549 xenografts[J]. Oncol Lett, 2018, 16(5): 5969-5977. DOI:10.3892/ol.2018.9346 |
| [9] |
Xiang GL, Zhu XH, Lin CZ, et al. 125I seed irradiation induces apoptosis and inhibits angiogenesis by decreasing HIF-1α and VEGF expression in lung carcinoma xenografts[J]. Oncol Rep, 2017, 37(5): 3075-3083. DOI:10.3892/or.2017.5521 |
| [10] |
Ma ZH, Yang Y, Yang G, et al. Iodine-125 induces apoptosis via regulating p53, microvessel density, and vascular endothelial growth factor in colorectal cancer[J]. World J Surg Oncol, 2014, 12: 222. DOI:10.1186/1477-7819-12-222 |
| [11] |
向桂玲, 朱新红, 林存智, 等. 放射性125I粒子植入对人肺腺癌裸鼠移植瘤微血管生成的影响[J]. 中华放射医学与防护杂志, 2017, 37(2): 96-101. Xiang GL, Zhu XH, Lin CZ, et al. Effect of radioactive 125I seed implantation on angiogenesis of human lung adenocarcinoma xenografts in nude mice[J]. Chin J Radiol Med Prot, 2017, 37(2): 96-101. DOI:10.3760/cma.j.issn.0254-5098.2017.02.003 |
| [12] |
Mao XW. A quantitative study of the effects of ionizing radiation on endothelial cells and capillary-like network formation[J]. Technol Cancer Res Treat, 2006, 5(2): 127-134. DOI:10.1177/153303460600500206 |
| [13] |
郑硕. 肝细胞肝癌患者组织中血管内皮生长因子表达与临床病理特征及预后的关系[J]. 临床合理用药杂志, 2021, 14(6): 153-155. Zheng S. Expression of vascular endothelial growth factor in hepatocellular carcinoma and its relationship with clinicopathological features and prognosis[J]. Chin J Clin Rational Drug Use, 2021, 14(6): 153-155. DOI:10.15887/j.cnki.13-1389/r.2021.06.061 |
| [14] |
吴立兵, 刘刚, 王卫民. 放射性125I粒子对肺癌A549细胞裸鼠移植瘤VEGF表达的影响[J]. 海南医学, 2016, 27(2): 183-185. Wu LB, Liu G, Wang WM. Effect of radioactive 125I seed on expression of VEGF in lung cancer A549 cell of nude mice[J]. Hainan Med J, 2016, 27(2): 183-185. DOI:10.3969/j.issn.1003-6350.2016.02.004 |
| [15] |
Zhang WF, Jin WD, Li B, et al. Effect of brachytherapy on NF-κB and VEGF in gastric carcinoma xenografts[J]. Oncol Rep, 2014, 32(2): 635-640. DOI:10.3892/or.2014.3255 |
| [16] |
刘登尧, 叶尓麦克·阿哈提, 李建邦, 等. 放射性125I粒子对肺腺癌A549细胞荷瘤裸鼠HIF-1α表达的影响[J]. 新疆医科大学学报, 2021, 44(2): 133-136. Liu DY, Ye EMK·AHT, Li JB, et al. Effect of radioactive 125I seed on expression of HIF-1α in lung cancer A549 cell of nude mice[J]. J Xinjiang Med Univ, 2021, 44(2): 133-136. DOI:10.3639/j.issn.1009-5551.2021.02.001 |
| [17] |
Cron GO, Beghein N, Crokart N, et al. Changes in the tumor microenvironment during low-dose-rate permanent seed implantation iodine-125 brachytherapy[J]. Int J Radiat Oncol Biol Phys, 2005, 63(4): 1245-1251. DOI:10.1016/j.ijrobp.2005.07.971 |
| [18] |
Hu L, Wang H, Huang L, et al. The protective roles of ROS-mediated mitophagy on 125I seeds radiation induced cell death in HCT116 cells[J]. Oxid Med Cell Longev, 2016, 2016: 9460462. DOI:10.1155/2016/9460462 |
 2021, Vol. 41
2021, Vol. 41


