放射治疗是胸部肿瘤治疗方式之一,但放疗可能引起放射性食管炎等不良反应。其中食管黏膜对电离辐射的炎性反应是放射性食管炎的病理基础,但目前仍缺乏有效的防治靶点[1-2]。尿苷化以转录后修饰的方式,在真核生物细胞中普遍存在,可影响RNA的成熟、稳定和翻译[3]。末端尿苷基转移酶家族(TUTases)是尿苷化的主要组成部分,这些酶也被称为poly U聚合酶,属于DNA聚合酶p (Pol B)样核苷基转移酶超家族,负责催化编码RNA和非编码RNA 3′端尿苷的非模板添加。其中尿甘基转移酶(TUT4)(ZCCHC11)可通过尿苷化特定miRNA的前体来控制miRNA的生物发生,改变其生物模式,加速衰变或促进降解,是重要的调节信号[4-5]。miR132和miR212基因具有相同的结构,在鼠和人的基因座中串联排列,且成熟体有相似的序列和相同的“种子区域”,因此被称为miR132/212基因簇。其可通过末端添加1~3个尿嘧啶进行修饰,而其尿苷化程度的不同可影响其对下游靶基因的调控[6]。本研究验证了TUT4通过调控miR132/212的尿苷化作用对食管上皮细胞的放射敏感性的影响,为减轻放射治疗胸部肿瘤的食管放射性损伤提供了研究依据。
材料与方法 1、细胞培养将人食管上皮细胞(HEEC)系(中国凯基生物公司),接种于含有10%胎牛血清和1%青链霉素双抗的DMEM培养基(美国GIBCO公司)的细胞培养皿中,置于5%CO2 37℃培养箱中培养。待细胞生长到70%~80%时传代培养,每2天用磷酸盐缓冲液(PBS)冲洗并更换培养基以保持细胞良好生长。
2、照射条件取汇合度达到70%~80%的对数生长期细胞,接种于6孔板中,采用德国西门子Primus-H型医用直线加速器6 MV X射线照射。源靶距(SSD)100 cm,分别照射2、4、6和8 Gy,吸收剂量率1 Gy/min。
3、实时荧光定量PCR测定TUT4的mRNA表达HEEC细胞接种于6孔板培养后待其汇合度达到70%~80%时予2、4、6和8 Gy剂量照射,并使用离心柱法RNA提取试剂盒(中国百泰克公司)分别提取不同剂量照射后0、6、18、24和48 h细胞的RNA,RNA的浓度和纯度使用酶标仪检测(美国BioTek公司)。按照PCR试剂盒(中国新贝生物公司)说明书步骤反转录后在ABI ViiA7系列PCR仪(美国ThermoFisher公司)中扩增,得到CT值后计算相对表达量。
4、TUT4慢病毒转染将细胞以1×105个/孔的密度接种于6孔板培养过夜,第2天将完全培养基换成含有5 μg/ml嘌呤霉素的慢病毒稀释液(中国吉玛公司)后放回5%CO2 37℃培养箱中继续培养,第3天弃浸染细胞的病毒液,持续用含嘌呤霉素的培养基培养以保持稳定筛选,存活细胞即为感染阳性的细胞,在荧光显微镜下观察侵染细胞荧光情况,并采用RT-PCR的方法验证目的基因表达下调。转染成功的细胞后续实验分为4组:阴性对照组、单纯下调TUT4表达组(shTUT4组)、单纯6 Gy照射组(6 Gy组)、下调TUT4表达细胞经6 Gy照射组(6 Gy+shTUT4组)。
5、克隆形成实验取对数生长期的细胞以每孔500、1 000、2 000、4 000和8 000个细胞梯度接种于6孔板中培养过夜后分别给予剂量为0、2、4、6和8 Gy的照射,继续培养12 d后用4%多聚甲醛固定、0.5%结晶紫染色细胞,记录含有50个以上细胞的集落数并计算克隆形成率。在Prism软件上应用单击多靶模型拟合生存曲线,计算相关的放射剂量学参数:D0 (平均致死剂量)、Dq (准阈剂量)、SF2 (经2 Gy照射后的细胞存活分数)、以及D0和Dq的放射增敏比(SER),SERD0、SERDq。
6、细胞增殖实验细胞以每孔1 000个接种于96孔板中,第2天6 Gy照射后别于照射后0、24、48和72 h每孔加入10 μl CCK-8(日本Dojindo公司)试剂在37℃培养箱中孵育2 h,用酶标仪测定450 nm波长处的吸光度(A)值。
7、细胞周期实验将细胞配成密度为2×105个/ml的细胞悬液,按照细胞周期试剂盒(日本Dojindo公司)的操作步骤,加入碘化丙啶(PI)荧光染料,混匀后在遮光条件下37℃培养15 min,过滤后用流式细胞仪分析各期细胞的比例。
8、线粒体膜电位检测实验线粒体膜电位检测试剂盒(日本Dojindo公司)中JC-1粉末加二甲基亚砜(DMSO)溶解后,加入培养基配置成工作液。接种于24孔板的细胞加入50 μl/孔工作液并在37℃培养箱中培养1 h,染料会伴随膜电位的聚集过程由绿色荧光变为红色荧光。清洗后加入200 μl Buffer缓冲液。在荧光显微镜下观察各组细胞红色荧光强度。线粒体膜电位荧光强度越低,说明线粒体损伤越严重。
9、活性氧自由基(ROS)检测实验ROS是在线粒体合成三磷酸腺苷(ATP)时产生的高活性氧簇。本实验按照高灵敏度活性氧检测试剂盒(日本Dojindo公司)中的说明书操作,将接种于24孔板的转染细胞经6 Gy照射后加入配置好的工作液(150 μl/孔),置于37℃培养箱内培养30 min,经磷酸盐缓冲液(PBS)清洗后置于荧光显微镜下观察,记录各组细胞绿色荧光强度。荧光强度越高,说明ROS产生越多。
10、实时荧光定量PCR测定miRNA表达提取6 Gy组和6 Gy+shTUT4组细胞的总RNA,按照前述PCR方法测定两组的miR132/212表达和miR132/212+UUU末端添加3个尿嘧啶的miR132/212表达。
11、MiRNA的慢病毒转染HEEC细胞转染过表达miRNA132/212和过表达miRNA132/212+UUU的慢病毒,操作按照前述转染方法进行,验证后得到稳定转染的两组HEEC细胞,分别为miRNA132/212组(上调miRNA132/212表达组)和miRNA132/212+UUU组(上调miRNA132/212+UUU表达组)。两组细胞分别照射0、2、4、6和8 Gy,按前述方法进行克隆形成实验并计算克隆形成率。将经6 Gy照射的6 Gy+miRNA132/212组和6 Gy+miRNA132/212+UUU组以阴性对照组细胞为对照, 按前述实验方法进行细胞增殖实验。
12、双重转染细胞的增殖实验将shTUT4组细胞分别转染过表达miRNA132/212和过表达miRNA132/212+UUU的慢病毒,操作按照前述转染方法进行,转染成功的细胞经6 Gy照射处理。将此时的细胞分为6 Gy+shTUT4+miRNA132/212组(下调TUT4表达且过表达miRNA132/212后经6 Gy照射组)和6 Gy+shTUT4+miRNA132/212+UUU组(下调TUT4表达且过表达miRNA132/212+UUU后经6 Gy照射组),按照前述方法进行增殖实验。
13、统计学处理采用GraphPad Prism7软件进行数据处理。所有数据经正态性检验数据均符合正态分布,数据以x±s表示,两组间比较采用组间t检验。两组以上的比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
结果 1、PCR检测不同剂量X射线照射后不同时间HEEC细胞中TUT4的表达图 1荧光定量PCR的结果显示了X射线照射后TUT4在HEEC中的表达变化,照射剂量 < 4 Gy时TUT4在HEEC中的表达随照射剂量增大而增多;照射剂量>4 Gy时TUT4表达较4 Gy时表达减少,照射6或8 Gy后48 h时TUT4表达量极低。经2、4、6、8 Gy照射的HEEC细胞48 h内的TUT4表达均值与0 Gy比较差异均有统计学意义(t=12.84、62.06、27.86、32.43,P < 0.05)。结果表明,HEEC中TUT4的表达与照射剂量和照射后时间密切相关,据此本研究后续实验选择TUT4表达相对稳定时对应的6 Gy剂量作为照射条件处理HEEC细胞。
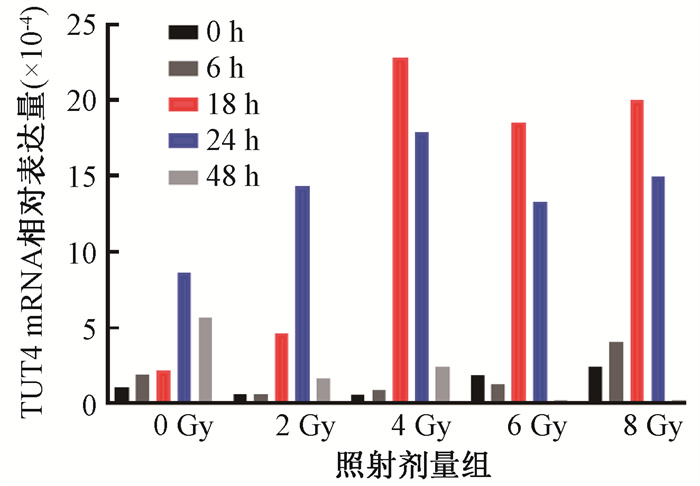
|
图 1 不同剂量照射后人食管上皮细胞不同时间TUT4的表达 Figure 1 The expression level of TUT4 in HEEC at different time of radiation |
2、克隆形成实验和细胞增殖实验检测下调TUT4表达对HEEC细胞放射敏感性的影响
克隆形成实验结果显示shTUT4组的细胞的D0、Dq、SF2值分别为0.79、1.61、0.47;阴性对照组细胞的D0、Dq、SF2值分别为1.10、2.42、0.80,两组比较差异均有统计学意义(t=13.2、5.85、7.31,P < 0.05);shTUT4组的SERD0、SERDq值分别为1.41、1.50。CCK8增殖实验的结果显示,6 Gy+ shTUT4组的细胞与6 Gy组比较,48和72 h时增殖明显减少,差异均有统计学意义(t=7.12、13.63,P < 0.05),见图 2。结果表明下调TUT4的表达可增加HEEC细胞的放射敏感性。
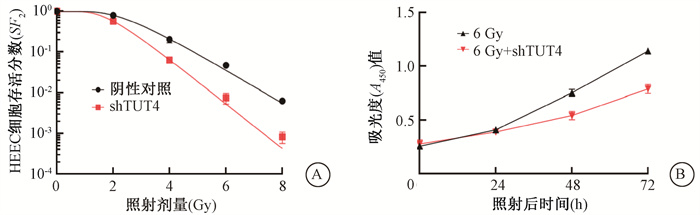
|
图 2 下调TUT4表达对人食管上皮细胞(HEEC)放射敏感性的影响A.存活分数曲线;B.吸光度(A450)值 Figure 2 The effect of down-regulated TUT4 on radiosensitivity of HEEC A. Survival curves of HEEC cells; B. CCK8 assay of cell proliferation after 6 Gy irradiation |
3、细胞周期实验检测下调TUT4表达的HEEC细胞周期的变化
细胞周期实验结果显示6 Gy组和6 Gy+shTUT4组分别较阴性对照组和shTUT4组细胞的G2/M期细胞明显增多,差异均有统计学意义(t=6.67、9.16,P < 0.05);与6 Gy组相比, 6 Gy+shTUT4组S期细胞增多,差异有统计学意义(t=4.79,P < 0.05),见表 1。结果表明X射线照射可增加细胞的G2/M期阻滞,且下调TUT4表达可增加受照射细胞的S期阻滞。
|
|
表 1 Gy照射后各组细胞周期的细胞比例(x±s) Table 1 Cell cycle distribution in different groups after 6 Gy irradiation (x±s) |
4、线粒体膜电位检测实验检测下调TUT4表达的HEEC细胞线粒体损伤情况
线粒体膜电位损伤实验结果显示,阴性对照组、shTUT4组、6 Gy组和6 Gy+shTUT4组的平均荧光强度分别为61.9、56.6、33.8、21.0。其中6 Gy组和6 Gy+shTUT4组分别较阴性对照组和shTUT4组细胞的荧光强度减低,差异均具有统计学意义(t=25.6、55.69,P < 0.05);且与6 Gy组相比, 6 Gy+shTUT4组的荧光强度减低,差异有统计学意义(t=11.98,P < 0.05),见图 3。结果表明,X射线照射可增加细胞的线粒体损伤,且下调TUT4表达可增加受照射细胞的线粒体损伤。
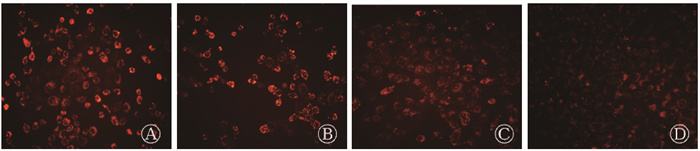
|
图 3 各组线粒体膜电位检测实验荧光图(590 mm)×200 A. NC组;B.shTUT4组;C.6 Gy组;D. 6 Gy+shTUT4组 Figure 3 Fluorescence images of mitochondrial membrane potential in each group (590 nm, ×200) A. NC group; B. shTUT4 group; C. 6 Gy group; D. 6 Gy + shTUT4 group |
5、活性氧自由基(ROS)检测实验检测下调TUT4表达的HEEC细胞的ROS产生情况
ROS检测实验结果显示,阴性对照组、shTUT4组、6 Gy组和6 Gy+shTUT4组的荧光强度分别为44.0、40.3、36.0、25.0。其中6 Gy组和6 Gy+shTUT4组分别较阴性对照组和shTUT4组细胞的绿色荧光强度更高,差异均具有统计学意义(t=17.56、23.73,P < 0.05);且6 Gy+shTUT4组与6 Gy组相比ROS水平更高,两组比较差异有统计学意义(t=15.65,P < 0.05),见图 4。结果表明,X射线照射可增加细胞的ROS产生,且下调TUT4表达可增加受照射细胞的ROS产生。
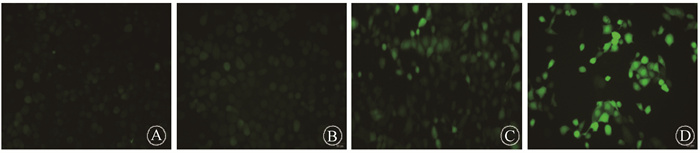
|
图 4 各组活性氧自由基荧光图(540 nm)×200 A. 阴性对照组;B.shTUT4组;C.6 Gy组;D. 6 Gy+shTUT4组 Figure 4 Fluorescence images of ROS in each group (540 nm), ×200 A. NC group; B. shTUT4 group; C. 6 Gy group; D. 6 Gy + shTUT4 group |
6、PCR检测6 Gy+shTUT4组细胞中miR132/212和miR132/212+UUU的表达
PCR实验结果表明6 Gy+TUT4组较6 Gy组的miR132/212的表达增多,miR132/212+UUU的表达减少,差异均有统计学意义(t=27.90、60.99,P < 0.05),见表 2。结果表明,下调TUT4表达的HEEC细胞经照射后miR132/212的尿苷化程度减少。
|
|
表 2 两组细胞中miR132/212和miR132/212+UUU的相对表达量(×10-4,x±s) Table 2 Relative expression levels of miR132/212 and miR132/212+UUU in two groups(10-4, x±s) |
7、克隆形成实验和细胞增殖实验检测过表达miR132/212和miR132/212+UUU对HEEC细胞放射敏感性的影响
克隆形成实验结果显示miR132/212组细胞D0、Dq、SF2值分别为0.87、2.02、0.66,相比于阴性对照组均减少(t=10.56、4.58、5.34,P < 0.05),SERD0、SERDq分别为1.20、1.22;miR132/212+UUU组的细胞的D0、Dq、SF2值分别为1.48、2.95、0.89,比Nc组均增加,差异有统计学意义(t=8.72、7.49、5.11,P < 0.05),SERD0、SERDq分别为0.71, 0.84。增殖实验结果显示6 Gy+miR132/212组细胞在照射后48和72 h时的增殖较6 Gy组减少,差异均有统计学意义(t=11.56、11.72,P < 0.05);6 Gy+miR132/212+UUU组细胞在照射后72 h时的增殖较6 Gy组增加,差异有统计学意义(t=5.21,P < 0.05),见表 5。结果表明,过表达miR132/212可增加HEEC细胞的放射敏感性,过表达miR132/212+UUU可降低HEEC细胞的放射敏感性。
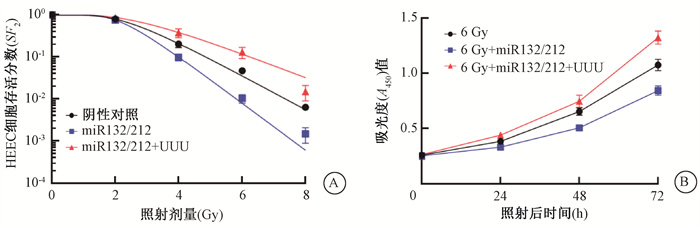
|
图 5 过表达miR132/212+UUU对人食管上皮细胞(HEEC)放射感性的影响A.存活分数曲线;B.吸光度(A450)值 Figure 5 Effect of miR132/212 and miR212+UUU over expression on radio sensitivity of HEEC. A. Survival curves of HEEC; B. CCK8 assay of cell proliferation in three indicated groups |
8、双重转染细胞的增殖结果
6 Gy+TUT4+miR132/212组较6 Gy+TUT4组的增殖受抑制程度在照射后48、72 h时增加,差异有统计学意义(t=4.76,7.65, P < 0.05);6 Gy+TUT4+miR132/212+UUU组较(6 Gy+TUT4)组增殖受抑制程度在照射后72 h时减少, 差异有统计学意义(t=7.22,P < 0.05), 结果表明,TUT4可通过调控miR132/212的尿苷化影响食管上皮细胞的放射敏感性, 见表 3。
|
|
表 3 4组细胞照射后不同时间吸光度(A450)值的变化(x±s) Table 3 CCK8 assay of cell proliferation in four indicated groups(x±s) |
讨论
放射性食管炎是一种无菌性炎症,抗生素治疗疗效甚微,因此应用中医药来缓解患者的症状是目前主要的临床治疗手段[7-8]。目前放射性食管炎的基础研究报道甚少,电离辐射损伤食管上皮细胞的分子机制和相关通路仍有待研究。TUT4是一种末端尿苷基转移酶,被证明可能是多种癌症治疗干预的分子靶点,且与TUT4密切相关的LIN28/let-7通路可能与电离辐射和化疗药物的耐受有关[9-11]。基于TUT4与电离辐射的关联性,本研究验证了TUT4与食管上皮细胞放射损伤密切相关,其可调控miR132/212的尿苷化作用对食管上皮细胞的放射敏感性,为减轻胸部肿瘤的食管放射损伤提供了研究依据。
本研究首先验证了电离辐射可以诱导TUT4的表达,下调TUT4表达可降低食管上皮细胞的放射敏感性,接下来从细胞周期、细胞线粒体膜电位、氧自由基生成角度探究TUT4对食管放射损伤的影响。电离辐射对于细胞损伤的直接分子机制是DNA链的损伤,这会造成真核生物细胞周期中G2/M检验点的阻滞,从而引起细胞周期中各部分细胞比例的变化。本研究细胞周期实验的结果显示下调TUT4表达下调照射后细胞的S期比例。相关研究表明,TUT4相关LIN28/let-7通路中的let7可以直接调节细胞周期中几个关键的原癌基因从而控制细胞增殖阻滞期G1细胞向S期转变[12-14]。因此,TUT4可能通过影响LIN28/let-7通路而影响食管上皮细胞的细胞周期。电离辐射可造成部分细胞不可逆的DNA损伤后启动凋亡,而线粒体跨膜电位的下降被认为是细胞凋亡级联反应中最早发生的事件,其发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前。当细胞受到辐射时,射线直接攻击线粒体,导致线粒体膜结构、通透性发生改变,膜电位下降,一旦线粒体跨膜电位崩溃,细胞凋亡则不可逆转[15-16]。本研究结果表明,下调TUT4表达会通过增加线粒体膜电位下降程度而增加辐射后HEEC细胞的早期凋亡。电离辐射作用于正常组织时会产生大量的活性氧自由基(ROS),过量的氧自由基会攻击脂肪酸、蛋白质和核酸,产生膜流动性降低、渗透率增加,线粒体肿胀、溶酶体释放等一系列氧化性应激反应,导致细胞内DNA、蛋白质和脂质的氧化以及某些特定氧化还原敏感信号通路的激活,进而导致细胞和组织损伤,引起并加重炎症反应,是诱发辐射损伤的主要机制之一[17]。本研究表明下调了TUT4表达的食管上皮细胞在接受照射后的ROS水平增加。以上实验证明了TUT4在食管上皮辐射损伤中的保护作用。
为了进一步探究TUT4的影响机制,本研究从TUT4的生物学功能角度出发探索了可以被TUT4尿苷化的miR132/212基因簇。miR132/212在神经系统中的研究较为成熟,同时在许多癌症中存在失调,被认为可能是一种新的肿瘤抑制miRNA。其被证明在化疗药物敏感性和肺癌细胞的放射敏感性方面发挥作用,并且其在大鼠放射食管损伤的表达谱中存在差异表达[18-20]。本研究验证了miR-212/132可影响食管上皮细胞的放射敏感性,并且miR-212/132是否尿苷化对放射线敏感的影响不同。TUT4作为其尿苷化作用的主要催化酶,可通过影响其尿苷化程度从而影响食管上皮细胞的放射敏感性。
本研究从TUT4调控miRNA尿苷化的角度揭示了影响食管上皮细胞放射敏感性的新机制,为预防和治疗放射性食管损伤提供了新靶点或新思路。然而本研究仍存在一些不足之处有待弥补,比如需完善电离辐射后食管上皮细胞中TUT4蛋白水平的表达结果;完善上调TUT4表达后的食管上皮细胞的细胞周期、损伤、凋亡结果;通过食管组织水平及动物水平的实验进一步验证已有结论等,并且TUT4调控miR132/212影响下游靶基因的具体机制仍待探索。本课题组目前正继续完善以上相关内容,致力于阐明放射性食管上皮细胞的放射敏感性的影响机制,最终为放疗患者的临床治疗做出贡献。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突,排名无争议
作者贡献声明 韩阳负责实验操作、数据分析和论文撰写;罗居东指导实验设计及论文修改;于静萍和孙志强参与统计分析、指导论文撰写
| [1] |
Hirota S, Tsujino K, Endo M, et al. Dosimetric predictors of radiation esophagitis in patients treated for non-small-cell lung cancer with carboplatin/paclitaxel/radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2001, 51(2): 291-295. DOI:10.1016/s0360-3016(1)01648-0 |
| [2] |
Zhang Z, Xu J, Zhou T, et al. Risk factors of radiation-induced acute esophagitis in non-small cell lung cancer patients treated with concomitant chemoradiotherapy[J]. Radiat Oncol, 2014, 9: 54. DOI:10.1186/1748-717X-9-54 |
| [3] |
Lee M, Kim B, Kim VN. Emerging roles of RNA modification: m(6)A and U-tail[J]. Cell, 2014, 158(5): 980-987. DOI:10.1016/j.cell.2014.08.005 |
| [4] |
Lim J, Ha M, Chang H, et al. Uridylation by TUT4 and TUT7 marks mRNA for degradation[J]. Cell, 2014, 159(6): 1365-1376. DOI:10.1016/j.cell.2014.10.055 |
| [5] |
Thornton JE, Du P, Jing L, et al. Selective microRNA uridylation by Zcchc6 (TUT7) and Zcchc11 (TUT4)[J]. Nucleic Acids Res, 2014, 42(18): 11777-11791. DOI:10.1093/nar/gku805 |
| [6] |
Jiang X, Chen X, Chen L, et al. Upregulation of the miR-212/132 cluster suppresses proliferation of human lung cancer cells[J]. Oncol Rep, 2015, 33(2): 705-712. DOI:10.3892/or.2014.3637 |
| [7] |
黄从书, 朱贵花, 谢光辉. 中医药防治放射性皮肤损伤的研究进展[J]. 中华放射医学与防护杂志, 2021, 41(3): 229-233. Huang CS, Zhu GH, Xie GH. Research progress of traditional Chinese medicine in prevention and treatment of radiation-induced skin injury[J]. Chin J Radiol Med Prot, 2021, 41(3): 229-233. DOI:10.3760/cma.j.issn.0254-5098.2021.03.013 |
| [8] |
Li Y, Lin J, Xiao J, et al. Therapeutic effects of Co-Venenum Bufonis Oral Liquid on radiation-induced esophagitis in rats[J]. Exp Anim, 2020, 69(3): 354-362. DOI:10.1538/expanim.19-0142 |
| [9] |
Munoz-Tello P, Rajappa L, Coquille S, et al. Polyuridylation in eukaryotes: a 3'-end modification regulating RNA life[J]. Biomed Res Int, 2015, 2015: 968127. DOI:10.1155/2015/968127 |
| [10] |
Morgan M, Much C, DiGiacomo M, et al. mRNA 3' uridylation and poly(A) tail length sculpt the mammalian maternal transcriptome[J]. Nature, 2017, 548(7667): 347-351. DOI:10.1038/nature23318 |
| [11] |
Lee H, Han S, Kwon CS, et al. Biogenesis and regulation of the let-7 miRNAs and their functional implications[J]. Protein Cell, 2016, 7(2): 100-113. DOI:10.1007/s13238-015-0212-y |
| [12] |
刘春旭, 刘建香. microRNAs和电离辐射诱导的细胞周期阻滞[J]. 中华放射医学与防护杂志, 2014, 34(10): 793-796. Liu CX, Liu JX. MicroRNAs and ionizing radiation induced cell cycle arrest[J]. Chin J Radiol Med Prot, 2014, 34(10): 793-796. DOI:10.3760/cma.j.issn.0254-5098.2014.10.019 |
| [13] |
Taylor WR, Stark GR. Regulation of the G2/M transition by p53[J]. Oncogene, 2001, 20(15): 1803-1815. DOI:10.1038/sj.onc.1204252 |
| [14] |
Balzeau J, Menezes MR, Cao S, et al. The LIN28/let-7 pathway in cancer[J]. Front Genet, 2017, 8: 31. DOI:10.3389/fgene.2017.00031 |
| [15] |
Kuwahara Y, Roudkenar MH, Suzuki M, et al. The involvement of mitochondrial membrane potential in cross-resistance between radiation and docetaxel[J]. Int J Radiat Oncol Biol Phys, 2016, 96(3): 556-565. DOI:10.1016/j.ijrobp.2016.07.002 |
| [16] |
Bertero E, Maack C. Calcium signaling and reactive oxygen species in mitochondria[J]. Circ Res, 2018, 122(10): 1460-1478. DOI:10.1161/CIRCRESAHA.118.310082 |
| [17] |
Farhood B, Ashrafizadeh M, Khodamoradi E, et al. Targeting of cellular redox metabolism for mitigation of radiation injury[J]. Life Sci, 2020, 250: 117570. DOI:10.1016/j.lfs.2020.117570 |
| [18] |
Kim HR, Hwang SJ, Shin CH, et al. SRSF3-regulated miR-132/212 controls cell migration and invasion by targeting YAP1[J]. Exp Cell Res, 2017, 358(2): 161-170. DOI:10.1016/j.yexcr.2017.06.009 |
| [19] |
Luo J, Meng C, Tang Y, et al. miR-132/212 cluster inhibits the growth of lung cancer xenografts in nude mice[J]. Int J Clin Exp Med, 2014, 7(11): 4115-4122. |
| [20] |
Luo J, Zhang C, Zhan Q, et al. Profiling circRNA and miRNA of radiation-induced esophageal injury in a rat model[J]. Sci Rep, 2018, 8(1): 14605. DOI:10.1038/s41598-018-33038-1 |
 2021, Vol. 41
2021, Vol. 41


