随着放射诊断技术在临床实践中的广泛应用[1],全球范围内,孕妇接受放射学诊断成像的人次也在迅速增长[2]。一般来说,孕妇在产前不同阶段接触电离辐射对胎儿造成的风险随着孕期的不同而变化:妊娠8~15周(妊娠早期)是导致胚胎死亡、生长/智力迟缓和小头畸形等确定性效应的最敏感时期,其辐射剂量阈值为0.35~0.50 Gy;对于16~40周的胎儿,更高剂量的辐射暴露会导致生长迟缓、脑容量降低和智力迟缓[3]。因此,对胎儿器官剂量进行准确估计,是实现妊娠期放射诊断成像方案优化,减少胎儿和患者关键组织器官的辐射照射剂量的基础,有助于向孕产妇提供更优质的医疗保健服务。目前在辐射剂量学和辐射防护学领域,可计算体模结合蒙特卡罗计算已成为剂量评估最常用的手段[2],且越来越向个性化方向发展[4]。近几十年来,由于成本低、资源共享方便等优点,可计算人体模型的数量呈现指数型增长[5]。为估计胎儿体内沉积的剂量,已有许多国内外研究者对孕妇可计算体模的构建和应用进行了研究[4-12]。然而,上述研究构建的孕妇体模相关参数以及胎儿在孕妇体内的大小和位置等参数与临床实际均不相同,可能会导致辐射剂量计算结果被严重低估或高估[13]。已有很多研究表明,孕妇腹围大小对胎儿剂量的估计有着显著影响[14-15]。自1970年以来,辅助生殖技术(ART)等生育治疗手段的发展和医学水平的提高,双胞胎出生率和存活率逐年提高[16],且极有可能会继续增加[17]。另一方面,怀有双胞胎的孕妇与单胞胎孕妇相比,往往会有更大的体围和体重[18],胎儿体积等各项解剖学参数较单胎胎儿也更小,这些辐射剂量学特征与正常孕妇存在差异。然而,目前国内外均未有研究报道双胞胎个性化体模构建及辐射剂量学研究的相关工作,双胞胎的剂量学数据存在亟需填补的空白。本研究基于孕妇低剂量CT扫描成像数据构建了一套双胞胎个性化可计算体模,可用于针对双胞胎的辐射剂量学研究和辐射防护实践。同时,该模型基于临床影像学图像构建,最大程度上保留了真实患者的解剖特征,从而保证了后续模拟计算结果的准确性,为放射科医师评估放射诊断成像中双胞胎受到的辐射剂量提供帮助。
材料与方法 1、构建流程本研究构建双胞胎孕妇模型的具体流程如图 1所示。
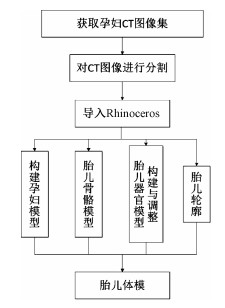
|
图 1 双胞胎孕妇模型构建流程图 Figure 1 Flow chart of construction process for the pregnant model of twins |
2、孕妇患者的低剂量CT图像
孕妇患者的CT图像集来自于瑞士日内瓦大学附属医院的非公开数据,患者在急诊科进行腹部和骨盆的CT检查。本研究中孕妇孕周为30周,CT图像集共包括393幅CT扫描图像,扫描范围从患者解剖学结构的下胸腔到趾骨联合。获得的CT图像是在GE LightSpeed VCT扫描仪获得(120 kVp,层厚为2.5 mm,螺距为1.375,床旋进比为55 mm/s,管电流为45 mA,为固定管电流调制,平均有效mAs为22.88)。
3、图像分割在专业分割软件采用阈值自动分割和手动分割结合的形式进行。对孕妇的身体轮廓、骨骼和肺进行阈值自动分割,而孕妇的子宫、肝脏、肾脏以及胎儿的轮廓、骨骼和脑由专业人员进行手动识别勾画。图 2展示了对该双胞胎孕妇患者的CT图像的分割结果,其中腹中两个胎儿的外轮廓分别采取了不同的颜色(紫色和黄色)进行示意,以方便读者辨别。右图中标识出了A、B两张CT图像在孕妇患者身体的位置,分别用红色和蓝色的虚线表示。分割后的结果导出为STL文件格式,方便导入3D建模软件进行后续处理。
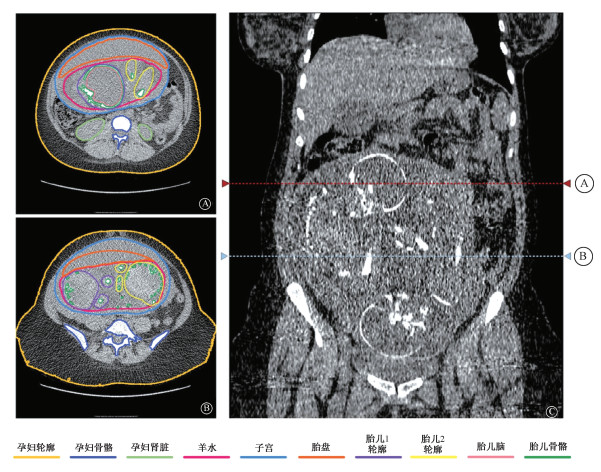
|
A、B图在母体中的位置如C图中对应颜色的虚线所示 图 2 8个月双胞胎孕妇患者的CT图像分割示意图 A. 胎儿头部; B. 胎儿腹部; C.矢状面 Figure 2 Schematic diagram of CT images segmentation of the pregnant patient A. Fetal brain; B. Fetal abdomen; C. Sagittal plane |
4、双胞胎NURBS曲面模型的构建
分割完成后,STL文件被导入Rhinoceros软件中,通过该软件将其重构为双胞胎非均匀有理B样条(non-uniform rational B-splines,NURBS)曲面模型。具体流程如图 3所示。首先辨别被分割在一起的双胞胎。骨骼决定了胎儿总体的框架、大小、姿态及位置等信息,因此,重构骨骼模型为构建胎儿模型的首要任务。然后,对其骨骼结构进行分辨,包括颅骨、肩胛骨、肋骨、脊椎、左/右上肢骨、髋骨和左/右腿骨,并将其放入不同的图层。由于CT图像不足够清晰,对于四肢骨、锁骨的分割不够准确,存在未识别到或由于噪声而过度识别的分割误差,在构建过程中分辨并删除多余组织,补全缺损的手骨和足骨;锁骨被分割成断裂的几小块骨骼,如图 4 (A)所示,在使用曲面放样(Loft)命令重建时构建为一根完整的锁骨,如图 4 (B)所示。
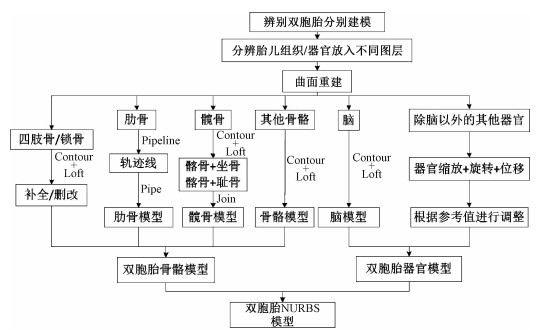
|
图 3 胎儿骨骼/器官模型构建流程图 Figure 3 Flow chart of fetal bone or organ model construction |

|
图 4 锁骨、胸骨构建示意图 A.Mesh模型; B.重构的NURBS曲面 Figure 4 Construction diagram of clavicle and sternum A. Mesh model; B. Reconstructed NURBS surface |
使用多重直线(polyline)命令在肋骨的多边形网格模型(polygonal meshes)绘制轨迹线,Rebuild命令对轨迹线重建,手动调整控制点位置,圆管(pipe)命令沿轨迹线构建双圆头盖管道代表肋骨。由于髋骨解剖结构特殊,坐骨与耻骨中间存在闭孔,将髂骨和坐骨、髂骨和耻骨分别构建曲面,并使用Join命令将其组合形成髋骨。
除上述特殊的骨骼结构外,其余骨骼模型(颅骨、肩胛骨、脊椎、左/右上肢骨和左/右腿骨)的构建过程如下:通过轮廓提取(contour)命令绘制Mesh模型的外轮廓,得到轮廓线;使用Rebuild命令对阶梯形的轮廓线重建,在保证形状、大小与真实结构一致的前提下,实现重建曲面的平滑与美观;放样(loft)命令重构得到其余骨骼的NURBS模型。
两个胎儿的骨骼模型的构建均按照上述步骤进行。
骨骼模型构建完成后,进行胎儿器官模型的构建。本研究对胎儿的脑进行了CT图像的器官分割,如图 2淡粉色线条所示,脑的构建过程与上述骨骼模型一致。
其余器官来自于本课题组前期已构建的胎儿参考模型[19],该参考模型为20周胎儿,将其器官进行三维缩放,保证器官大小与胎龄相符。由于胎儿颅骨为人工分割,与实际体积一致,因此本研究采用以下公式计算器官缩放系数:
| $ k = \frac{{{V_{a器官}}}}{{{V_{0器官}}}} = \sqrt[3]{{\frac{{{V_{as}}}}{{{V_{0s}}}}}} $ | (1) |
式中, k为器官缩放系数,即所构建胎儿体模器官体积Va器官与胎儿参考模型器官体积V0器官之比;Vas和V0s分别为待构建胎儿体模与胎儿参考模型的颅骨体积。颅骨的体积可直接由软件Rhinoceros的Volume命令获得。本研究采用胎儿参考模型胎龄为20周,其颅骨体积V0s=123.74 cm3。
根据测量,双胞胎模型的颅骨体积Vas分别为307.33和356.84 cm3。根据公式(1),得到其器官缩放比例k分别为1.35和1.42。
两个胎儿的胎龄为30周,因此颅骨体积更大,器官缩放系数也>1,即应放大参考模型的器官。缩放中心点为器官体积重心,可通过volume centroid命令获得,按照上述比例围绕缩放中心点使用缩放(scale)命令将除脑以外的器官进行三轴缩放后,进行位移处理。需要注意不可重叠、不可与骨骼相交导致骨骼穿过器官以及不可超出胸腹腔空间等。此外,在放置眼睛时,可以借助胎儿颅骨的Mesh模型,观察其眼眶位置,以保证眼睛的置入更符合临床实际。在经历一系列缩放和位移操作后,将器官嵌入胎儿的骨骼模型。
为了更加接近胎儿的真实器官质量,本研究未选择直接采用参考值,而是将世界卫生组织(WHO)报告[20]所给的股骨长参考值与胎儿预测体重的参考值之间的关系进行公式拟合,根据测得的双胞胎股骨长分别计算双胞胎的预估体重。将国际放射防护委员会(ICRP)第89号报告[21]所给出的胎儿器官质量参考值与胎儿预测体重之间进行公式拟合,得到胎儿各个器官与胎儿预测体重的关系,求出该对双胞胎的器官质量的目标值。由于该目标值的传递关系是股骨长-预估胎儿体重-器官质量,因此可能比ICRP和WHO报告中的参考值更符合真实的情况。根据该目标值结合ICRP第89号报告给出的器官/组织密度参考值,对各个器官的体积与位置进行最后调整。
本研究前期对胎儿轮廓进行了图像分割,依据分割结果,提取轮廓线作为调整基础,对轮廓线的控制点进行删改和位移处理,在保证真实结构形状和包围全部胎儿内部器官/组织的同时重建身体轮廓。
5、孕妇模型对于孕妇的腹部相关器官/组织的重建,与上述胎儿骨骼模型的过程一致,得到孕妇的相关器官/组织的NURBS模型。
将双胞胎模型嵌入孕妇腹部,双胞胎孕妇体模构建完成。
结果 1、双胞胎孕妇模型按照上述步骤和操作,构建了基于某一孕妇CT图像的一对30周双胞胎可计算模型,其器官/组织和骨骼3D可视化结果如图 5所示。双胞胎孕妇模型的左视图和正视图展示如图 6,且展示了同样位置的孕妇患者的冠状面(B)和矢状面(D)的CT图像(由Amide软件生成)。由图 6的对比可以看出,本研究构建的双胞胎模型在母体中的形状、位置、大小与姿势均与孕妇患者的临床实际完全一致。
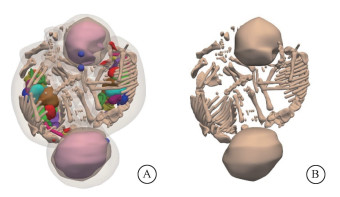
|
图 5 双胞胎模型展示图 A.包含皮肤的骨骼和器官模型; B.骨骼模型(为方便读者看清内部器官结构,已将皮肤作半透明化处理) Figure 5 Twin model A. Bone and organ model containing skin; B. Bone model (the skin be made translucent) |
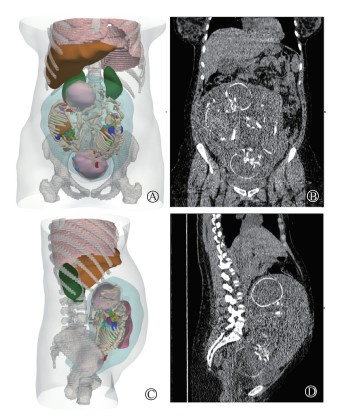
|
注:棕黄色为孕妇模型的肝脏,绿色为肾脏,粉色为肺,玫粉色为胎盘,水蓝色为子宫;已将子宫半 透明化处理。A图为展示胎儿模型,胎盘被隐藏) 图 6 双胞胎孕妇模型的3D可视化与CT图形对比展示图 A.正视图; B.冠状面; C.左视图; D. 矢状面 Figure 6 Comparative display of 3D visualization and CT graphics of pregnant twins A. Upright view; B. Coronal plane; C. Left view,; D Sagittal plane |
2、胎儿器官质量
本文建立的双胞胎体模器官质量及其与目标值的对比结果如表 2所示。从表中可看出,绝大多数器官的相对误差在10%以内。而需要说明的是,表 2列出的胃、小肠和大肠等腹部器官的器官质量仅为器官壁的质量,不包含内容物,但ICRP参考值包含内容物,为器官总体质量,因此差异较大;另一方面,骨骼差异较大的原因是本研究是基于CT图像分割的真实结果建模,且实际测量密度,保证了体积与密度与真实人体一致,未作向参考值靠近的调整。
|
|
表 2 双胞胎模型的器官质量值及其相对误差(与ICRP参考值相比) Table 2 Organ mass value and the relative error of twin model (compared with ICRP reference value) |
讨论
蒙特卡罗计算结合可计算体模的方法在辐射剂量学领域的应用越来越广泛,目前已有许多胎儿辐射剂量学相关研究。胎儿具有很高的辐射敏感性,超过5 mGy的辐射会对胎儿神经系统产生影响,与其他组织相比,神经系统对电离辐射的敏感期更长[22]。ICRP第90号出版物[23]证实,儿童白血病与胎儿时期辐射暴露有关。
在自然条件下,同卵双胞胎和异卵双胞胎出生率分别为0.4%和1.2%[24],但随着辅助生殖技术和现代医学的不断成熟,双胞胎出生率不断提高。据牛津大学一项研究指出,全球双胞胎绝对数和相对数已达到前所未有的高峰,每年出生的双胞胎数高达160万对,即每42名出生儿童中就有1例是双胞胎[25]。且由于孕妇体重、体围等普遍大于普通孕妇,双胞胎大概率体积低于单胞胎:有一项研究表明,59%的双胞胎在37周前出生,64%的双胞胎出生时体重较低甚至非常低[26]。因此双胞胎的辐射剂量学特征与普通胎儿不同。然而目前未有相关研究报道双胞胎体模构建相关工作,且现存胎儿可计算体模的胎儿大小、位置和孕妇体围等相关参数与临床实际不同。已有很多研究表明孕妇腹围对胎儿剂量的估算有着重大影响。本研究对一位双胞胎孕妇患者的CT图像集进行分割处理(分割的器官/组织有孕妇的轮廓、骨骼、子宫、胎盘、肝脏和肾脏,胎儿的轮廓、脑和骨骼),通过Rhinoceros软件进行曲面重构,对胎儿参考模型的器官进行变形和位移,构建了一套全新的个性化30周双胞胎可计算模型。该双胞胎模型拥有25种器官/组织,器官质量/体积按照ICRP第89号报告和WHO报告所给参考值进行仔细调整,孕妇和胎儿的解剖参数与临床实际完全一致。
但本研究构建的双胞胎孕妇模型仍存在一些不足:为保护胎儿,孕妇患者采用了低剂量CT成像方案,其噪声较大、分辨率低[27],因此,未能对胎儿器官进行分割和建模,且部分骨骼存在分割误差。但为尽可能接近临床实际,本研究所采用的器官质量是通过股骨长-预估胎儿体重-器官质量的一系列推导得到;且由于分割产生的断裂小块骨骼的大小及位置等信息为真实骨骼提供了重要参考,本研究在重构时对小块骨骼的轮廓线进行了统一放样,所构建的骨骼模型最大化地接近真实胎儿。为实现对胎儿器官的准确识别,后续还将继续开展相关工作。可通过借助孕妇的核磁共振图像和超声图像进行分割并建模,以提高胎儿器官模型构建的准确性。另一个限制在于,本研究仅构建1例30周孕妇双胞胎模型,不能代表所有孕妇患者。为提高模型的应用性和代表性,将采用本文介绍的构建方法,拓展孕妇模型规模,建立包含一系列孕龄的孕妇体模库。
本研究构建的双胞胎个性化体模填补了目前研究中对于双胞胎模型相关研究的空白,适应了双胞胎出生率逐年增加及孕妇对于放射学检查使用率增加的趋势,有助于帮助医学物理学家对双胞胎孕妇患者在接受放射诊断的过程中,双胞胎接受的电离辐射剂量进行准确合理的估计,并为临床上孕妇患者进行辐射防护相关工作提供基础数据。另一方面,由于NURBS曲面模型易变形和位移,可以通过对双胞胎模型变形,对不同姿势、位置的双胞胎进行相关剂量学计算。该体模后续将用于计算孕妇患者进行X射线-CT检查过程中胎儿受到的辐射剂量。
利益冲突 无
作者贡献声明 曲水音负责体模构建、调整和论文起草;卓维海指导论文修改;谢添武指导建模
| [1] |
United Nations Scientific Committee on the Effects of Atomic Radiation. UNSCEAR 2008 report. Sources and effects of ionizing radiation[R]. Vienna: United Nations, 2010.
|
| [2] |
Lazarus E, Debenedectis C, North D, et al. Utilization of imaging in pregnant patients: 10-year review of 5270 examinations in 3285 patients-1997-2006[J]. Radiology, 2009, 251(2): 517-524. DOI:10.1148/radiol.2512080736 |
| [3] |
Stabin MG. Radiation dose concerns for the pregnant or lactating patient[J]. Semin Nucl Med, 2014, 44(6): 479-488. DOI:10.1053/j.semnuclmed.2014.06.003 |
| [4] |
Hoseinian E, Motavalli LR, Hakimabad HM. Hybrid pregnant reference phantom series based on adult female ICRP reference phantom[J]. Radiat Phys Chem, 2018, 144(6): 479-488. DOI:10.1016/j.radphyschem.2017.10.001 |
| [5] |
Xu XG. An exponential growth of computational phantom research in radiation protection, imaging, and radiotherapy: a review of the fifty-year history[J]. Phys Med Biol, 2014, 59(18): R233-302. DOI:10.1088/0031-9155/59/18/r233 |
| [6] |
Stabin MG, Watson EE, Cristy M, et al. Mathematical models and specific absorbed fractions of photon energy in the nonpregnant adult female and at the end of each trimester of pregnancy[R]. Oak Ridge: Office of Scientific & Technical Information Technical Reports, 1995.
|
| [7] |
Russell JR, Stabin MG, Sparks RB, et al. Radiation absorbed dose to the embryo/fetus from radiopharmaceuticals[J]. Health Phys, 1997, 73(5): 756-769. DOI:10.1097/00004032-199711000-00003 |
| [8] |
石成玉, 徐榭, 白净. 一个数字化的孕妇物理人模型的开发及其在核医药学上的应用[J]. 中国医学影像技术, 2004, 20(8): 1267-1272. Shi CY, Xu X, Bai J. Development of a tomographic model for a pregnant woman and its application in nuclear medicine[J]. Chin J Med Imaging Technol, 2004, 20(8): 1267-1272. DOI:10.3321/j.issn.1003-3289.2004.08.037 |
| [9] |
Xu XG, Taranenko V, Zhang J, et al. A boundary-representation method for designing whole-body radiation dosimetry models: pregnant females at the ends of three gestational periods-RPI-P3, -P6 and -P9[J]. Phys Med Biol, 2007, 52(23): 7023-7044. DOI:10.1088/0031-9155/52/23/017 |
| [10] |
汤晓斌, 耿长冉, 谢芹, 等. 中国参考人孕妇模型的建立及其内照射剂量学研究[J]. 中国医学物理学杂志, 2012, 29(1): 3088-3092, 3095. Tang XB, Geng CR, Xie Q, et al. The establishment of Chinese pregnant woman model and application on internal dosimetry research[J]. Chin J Med Phys, 2012, 29(1): 3088-3092, 3095. |
| [11] |
Maynard MR, Long NS, Moawad NS, et al. The UF family of hybrid phantoms of the pregnant female for computational radiation dosimetry[J]. Phys Med Biol, 2014, 59(15): 4325-4343. DOI:10.1088/0031-9155/59/15/4325 |
| [12] |
Paulbeck C, Griffin K, Lee C, et al. Dosimetric impact of a new computational voxel phantom series for the Japanese atomic bomb survivors: pregnant females[J]. Radiat Res, 2019, 192(5): 538-561. DOI:10.1667/rr15394.1 |
| [13] |
Osei EK, Faulkner K. Fetal position and size data for dose estimation[J]. Brit J Radiol, 1999, 72(856): 363-370. DOI:10.1074/jbc.M311735200 |
| [14] |
Xie T, Poletti PA, Platon A, et al. Assessment of CT dose to the fetus and pregnant female patient using patient-specific computational models[J]. Eur Radiol, 2018, 28(3): 1054-1065. DOI:10.1007/s00330-017-5000-z |
| [15] |
Angel E, Wellnitz CV, Goodsitt MM, et al. Radiation dose to the fetus for pregnant patients undergoing multidetector CT imaging: Monte Carlo simulations estimating fetal dose for a range of gestational age and patient size[J]. Radiology, 2008, 249(1): 220-227. DOI:10.1148/radiol.2491071665 |
| [16] |
Kulkarni AD, Jamieson DJ, Jones HW Jr, et al. Fertility treatments and multiple births in the United States[J]. N Engl J Med, 2013, 369(23): 2218-2225. DOI:10.1056/NEJMoa1301467 |
| [17] |
Johnson JA, Tough S, Sogc Genetics Committee. Delayed child-bearing[J]. J Obstet Gynaecol Can, 2012, 34(1): 80-93. DOI:10.1016/S1701-2163(16)35138-6 |
| [18] |
Lutsiv O, Hulman A, Woolcott C, et al. Examining the provisional guidelines for weight gain in twin pregnancies: a retrospective cohort study[J]. BMC Pregnancy Childbirth, 2017, 17(1): 330. DOI:10.1186/s12884-017-1530-2 |
| [19] |
Xie T, Zaidi H. Development of computational pregnant female and fetus models and assessment of radiation dose from positron-emitting tracers[J]. Eur J Nucl Med Mol Imaging, 2016, 43(13): 2290-2300. DOI:10.1007/s00259-016-3448-8 |
| [20] |
Kiserud T, Piaggio G, Carroli G, et al. The World Health Organization fetal growth charts: a multinational longitudinal study of ultrasound biometric measurements and estimated fetal weight[J]. PLoS Med, 2017, 14(1): e1002220. DOI:10.1371/journal.pmed.1002284 |
| [21] |
International Commission on Radiological Protection. ICRP publication 89. Basic anatomical and physiological data for use in radiological protection: Reference values[R]. Oxford: Pergamon Press, 2002.
|
| [22] |
Altman KI, Lett JT. Relative radiation sensitivities of human organ systems[M]. Salt Lake City: Academic Press, 1994.
|
| [23] |
International Commission on Radiological Protection. ICRP publication 90. Biological effects after prenatal irradiation (embryo and fetus)[R]. Oxford: Pergamon Press, 2003.
|
| [24] |
Group TECW. Multiple gestation pregnancy[J]. Hum Reprod, 2000, 15(8): 1856-1864. DOI:10.1093/humrep/15.8.1856 |
| [25] |
Monden C, Pison G, Smits J. Twin peaks: more twinning in humans than ever before[J]. Hum Reprod, 2021, 36(6): 1666-1673. DOI:10.1093/humrep/deab029 |
| [26] |
Beiguelman B, Colletto G, Franchipinto C, et al. Birth weight of twins: 1. The fetal growth patterns of twins and singletons[J]. Genet Mol Biol, 1998, 21(1): 151-154. DOI:10.1590/S1415-47571998000100025 |
| [27] |
Diwakar M, Kumar M. A review on CT image noise and its denoising[J]. Biomed Signal Process Control, 2018, 42: 73-88. DOI:10.1016/j.bspc.2018.01.010 |
 2021, Vol. 41
2021, Vol. 41


