与广泛转移不同,寡转移是肿瘤侵袭的温和阶段,主要体现为具有较少的转移灶和局限的转移器官[1]。基于寡转移的理论基础,在介于局限性原发灶与广泛性转移之间的过渡阶段给予积极的局部治疗,可抑制具有潜在转移能力的肿瘤细胞生长。2019年,国际肺癌研究协会(International Association for the Study of Lung Cancer, IASLC)发表了寡转移非小细胞肺癌(non-small cell lung cancer,NSCLC)共识,对寡转移进行了定义,即≤5个转移灶、≤3个转移器官,除外弥漫性浆膜转移及骨髓转移[2]。有研究表明,26%~50%的晚期NSCLC患者存在寡转移[3-4],即便是接受手术完全切除的NSCLC患者,也有60%出现远隔部位转移,其中55%的转移灶≤3个[5]。初始接受局部治疗NSCLC寡转移患者,约1/4的患者在清除所有转移灶后能长期生存[7]。积极的局部治疗手段包括手术切除[8]、放疗[9]和射频消融治疗[10]等,但由于缺乏大规模随机对照的前瞻性临床试验,患者施行何种局部治疗手段、施行局部治疗的合适时机仍不清晰[11]。本研究探讨了寡转移NSCLC患者的预后影响因素,尤其是放疗干预的效果,现将结果报告如下。
资料与方法 1、入组标准收集2015年1月至2018年12月在苏州大学附属第一医院放疗科接受局部放疗的191例寡转移NSCLC患者资料,除外32例临床资料不全者,共纳入159例患者进入分析。159例患者均满足以下入组标准:①原发灶经病理学确诊为NSCLC。②年龄18~85岁。③体力活动状态(performance status, PS)评分0~2。④转移器官≤3个,包括肺内转移、脑转移、骨转移。⑤转移灶≤5个,不存在弥漫性或不可测量病灶。⑥所有患者的转移灶均经多次增强CT或增强MRI检查,由放疗科主管医师与影像科医师共同确诊。⑦转移灶既往未接受过放射治疗。⑧接受放射治疗前可接受联合或维持化疗,联合或不联合表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)或间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂、抗血管治疗。
2、临床资料159例寡转移NSCLC患者中,男107例,女52例;年龄27~84岁,中位年龄63岁;腺癌106例,鳞癌26例,腺鳞癌5例,大细胞癌及其他22例;曾经接受肺叶手术43例,化疗126例,胸部放疗19例,抗血管靶向治疗18例,应用EGFR-TKI治疗42例,应用ALK抑制剂治疗8例;T1期50例,T2~4期109例,N0~1期69例,N2~3期90例,Ⅰ~Ⅲ期48例,Ⅳ期111例;单器官转移151例,2~3个器官转移8例,单病灶转移97例,2~5个病灶转移62例;脑转移71例,骨转移80例,肺内转移8例。
3、放疗方法包含所有寡转移灶的定位CT图像传至Eclipse或Monaco计划系统进行靶区勾画,行4DCT者在10个时相内勾画肿瘤靶体积(gross traget volume,GTV)生成内靶区(internal target volume,ITV),颅内转移灶各方向均匀外放3 mm生成计划靶体积(planning target volume,PTV),肺内转移灶各方向均匀外放5 mm生成PTV;未行4DCT者,勾画颅内转移灶时GTV各方向均匀外放3 mm生成PTV,勾画肺内或骨转移时GTV各方向均匀外放5~6 mm生成PTV,处方剂量覆盖95%PTV。放疗技术包括调强放射治疗(intensity modulated radiotherapy,IMRT)或IMRT-立体定向放射治疗(stereotactic body radiotherapy,SBRT)。正常组织的剂量限值以肿瘤放射治疗协作组(Radiation Therapy Oncology Group, RTOG)0618为标准,剂量分割模式为常规分割剂量为1.8~2.0 Gy/次,分次立体定向放射治疗(fractionated stereotactic radiotherapy,FSRT)即单次剂量2.0~3.0 Gy,低分割立体定向放射治疗(hypo-fractional stereotactic radiotherapy,HSRT)即单次剂量 > 3.0 Gy。IMRT患者在放疗首次行图像引导放射治疗(image guided radiotherapy,IGRT),SBRT患者每次均行IGRT。159例患者中,采用IMRT 148例,采用SBRT 11例;GTV < 10 cm3者24例,GTV 10~100 cm3者80例,GTV 101~1 000 cm3者54例,GTV > 1 000 cm3者1例,中位GTV为55 cm3,中位靶区吸收剂量40.0 Gy,中位生物等效剂量(biological equralent dose,BED)为48.0 Gy。
4、肿瘤负荷评分(tumor burden scoring system,TBSS)TBSS=转移器官数量+转移灶数量+GTV评分,其中转移器官数量为1~3分,转移灶数量为1~5分,GTV≤45.5 cm3为0分,GTV > 45.5 cm3为1分。根据3项得分之和,TBSS=2分为低肿瘤负荷,TBSS > 2分为高肿瘤负荷。159例患者中,低肿瘤负荷48例,高肿瘤负荷111例。
5、放疗干预模式将确诊寡转移NSCLC至放疗间隔时间≤4周定义为放疗早期干预,> 4周为放疗中晚期干预。159例患者中,放疗早期干预137例,放疗中晚期干预22例。
6、疗效评价采用实体瘤的疗效评价标准1.1版评价疗效,分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease, PD),客观缓解率(objective response rate,ORR)为CR+PR占所有患者的百分比,疾病控制率(disease control rate,DCR)为CR+PR+SD患者占所有患者的百分比。急性放疗不良反应及晚期损伤的评价采用美国国立癌症研究所(National Cancer Institute, NCI)常见不良反应事件评价标准4.0版,分为0~4级。
7、随访采用门诊复查和电话的方式进行随访。所有患者在局部放疗结束后1个月内行肿瘤所在部位增强CT或增强MRI检查,之后2年内每季度复查1次,2年后每半年复查1次。总生存时间(overall survival,OS)的定义为初诊NSCLC至肿瘤相关死亡或随访结束的时间,无进展生存时间(progression free survival,PFS)的定义为寡转移灶放疗结束后至第1次出现PD或任何原因死亡的时间,局部控制(local control,LC)的定义为寡转移灶放疗结束后PTV覆盖放射野内及边缘未见肿瘤复发或未控或出现新的病灶。随访截至2020年12月,159例患者均获得随访,随访率100%。
8、统计学处理采用SPSS 20.0统计软件进行分析,以受试者工作特征曲线(receiver operating characteristic curve,ROC)确定PFS/OS判断局部控制和预后的最佳截断值。生存分析采用Kaplan-Meier法,并行Log-rank检验,多因素生存分析采用Cox风险比例模型。P < 0.05为差异有统计学意义。
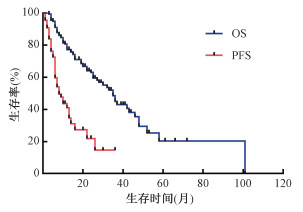
结果 1、疗效和生存情况全组患者的中位随访时间为28.2个月(95%CI为10.3~39.6个月)。随访期内,CR 16例(10.1%),PR 53例(33.3%),SD 27例(17.0%),PD 63例(39.6%);中位PFS为8.0个月(95%CI为5.4~10.6个月,图 1),3、6、12个月局部控制率分别为83.9%、59.7%和41.0%。全组有73例(45.9%)患者死亡,其中脑转移19例,骨转移24例,因新发远处转移致死27例,非肿瘤PD事件致死3例;中位OS为35.0个月(95%CI为29.1~40.9个月),1、2、3年生存率分别为77.3%、63.0%和45.1%(图 1)。
|
图 1 159例非小细胞肺癌寡转移患者的无进展生存(PFS)曲线和总生存(OS)曲线 Figure 1 Survival curves of OS and PFS in oligometastatic NSCLC patients (n=159) |
2、ROC曲线分析结果
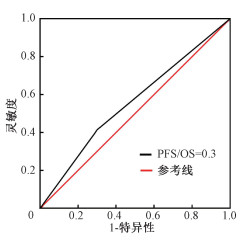
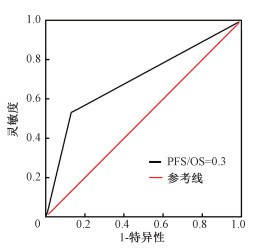
由图 2,3可见,PFS/OS=0.3是判断患者局部控制和预后的最佳截断值,曲线下面积分别为0.553和0.715。肿瘤靶体积吸收剂量(DT-GTVnx)和肿瘤靶体积(V-GTVnx)的最佳截断值分别为50 Gy和45.5 cm3。
|
图 2 PFS/OS=0.3判断159例非小细胞肺癌寡转移患者局部控制的受试者工作特征曲线 Figure 2 Receiver operating characteristic curve of PFS/OS=0.3 which determined the local control in oligometastatic NSCLC patients (n=159) |
|
图 3 PFS/OS=0.3判断159例非小细胞肺癌寡转移患者预后的受试者工作特征曲线 Figure 3 Receiver operating characteristic curve of PFS/OS=0.3 which determined the prognosis in oligometastatic NSCLC patients (n=159) |
3、影响患者PFS和OS的单因素分析
单因素分析结果显示,患者性别(χ2=4.175,P=0.041)、寡转移器官数(χ2=16.508,P < 0.001)、T分期(χ2=4.408,P=0.036)、放疗干预模式(χ2=10.300,P=0.001)、DT-GTVnx(χ2=6.842,P=0.009)以及PFS/OS(χ2=38.175,P < 0.001)与患者的中位PFS有关;患者性别(χ2=6.672,P=0.010)、病理类型(χ2=8.330,P=0.040)、寡转移器官数(χ2=21.299,P < 0.001)、初诊分期(χ2=5.398,P=0.020)、T分期(χ2=6.874,P=0.009)、N分期(χ2=6.893,P=0.009)、肺叶手术情况(χ2=5.611,P=0.018)、放疗干预模式(χ2=115.206,P < 0.001)、V-GTVnx(χ2=4.017,P=0.045)、肿瘤负荷(χ2=5.110,P=0.024)以及肿瘤局部控制情况(χ2=21.299,P < 0.001)与患者的中位OS有关(表 1)。
|
|
表 1 影响159例NSCLC寡转移患者PFS和OS的单因素分析 Table 1 Survival analyses for PFS and OS in oligometastatic NSCLC patients (n=159) |
4、影响患者PFS和OS的多因素分析
多因素分析结果显示,放疗中晚期干预(HR=3.728,95%CI为2.099~6.622,P < 0.001)是影响NSCLC寡转移患者PFS的独立危险因素,PFS/OS > 0.3(HR=0.123,95%CI为0.062~0.246,P < 0.001)是影响NSCLC寡转移患者PFS的独立保护因素;男性(HR=1.665,95%CI为1.024~3.043,P=0.033)、高肿瘤负荷(HR=2.113,95%CI为1.088~4.107,P=0.027)、放疗中晚期干预(HR= 15.076,95%CI为7.925~28.680,P < 0.001)是影响NSCLC寡转移患者OS的独立危险因素(表 2)。
|
|
表 2 影响159例NSCLC寡转移患者PFS和OS的多因素分析 Table 2 Multivariate analyses for PFS and OS in oligometastatic NSCLC patients (n=159) |
5、放疗相关不良反应
全组患者不良反应较轻,多为1~2级。71例脑寡转移NSCLC患者中,主要不良反应包括恶心、呕吐、眩晕、头痛、全身乏力、白细胞数降低,其中出现3级不良反应14例(19.7%)。80例骨寡转移NSCLC患者中,主要不良反应包括骨痛、肌痛、全身乏力、白细胞数降低,其中出现3级不良反应共7例(8.8%)。8例肺内寡转移NSCLC患者中,主要不良反应包括皮肤干燥、白细胞数降低,其中出现3级不良反应1例。
讨论美国监测、流行病学和结果数据库(SEER)进行的分析显示,NSCLC脑转移、骨转移、肝脏转移、多器官转移患者的中位OS分别为6、5、4和3个月[12]。有研究显示,单个脑转移患者加用立体定向放射治疗(stereotatic radiotherapy,SRT)后,中位OS从4.9个月延长至6.5个月。近年来,由于肿瘤寡转移惰性状态在Ⅳ期NSCLC的特殊性,局部治疗尤其是放疗挑战维持治疗的阳性结果陆续披露。一项晚期NSCLC寡转移放疗的Ⅱ期、多中心、随机对照临床研究结果显示,一线化疗后,寡转移灶巩固性放疗组患者的中位PFS为11.9个月,明显长于维持化疗组的3.9个月[14]。一项针对NSCLC寡转移的Ⅱ期临床研究表明,在一线化疗后、5个以下寡转移灶患者接受针对所有转移病灶的局部放疗,而非维持化疗,中位PFS为11.2个月,中位OS达28.4个月[15]。上述研究结果提示,原发病灶和转移灶接受局部放疗,可明显推迟复发时间,延长OS,使得NSCLC寡转移患者最终获益。但本研究中患者的中位PFS均逊于上述临床研究结果,表明真实世界中NSCLC寡转移患者采用局灶放疗干预的积极性有待提高。此外,Divisi等[16]认为,NSCLC寡转移器官为肺、脑的患者,比骨转移患者预后更好,与本研究结果一致。
目前,有越来越多针对高剂量放射治疗在NSCLC寡转移治疗地位的小型回顾性研究和前瞻性研究[17-19]。有研究表明,转移灶可达到局部控制的放疗剂量需要生物有效剂量(BED) > 100 Gy[20]。基于上述BED的研究结果,尽管缺乏随机对照证据支持,但临床医生会倾向于优选适合的NSCLC寡转移患者接受更为积极的局部治疗,如SBRT或SRS。Iyengar等[21]研究发现,SBRT治疗部位的增加与较高的死亡率显著相关,表明SBRT在肿瘤负荷较高的NSCLC寡转移患者治疗中并未获得OS获益。此外,Milano等[22]开展的前瞻性研究发现,寡病灶转移NSCLC患者对比非寡病灶转移NSCLC患者而言,可降低3倍的死亡风险,入组患者接受的放疗分割模式包括了常规分割放疗、SRS和SBRT,而3种分割模式下OS、PFS及不良反应发生率差异并无统计学意义,表明针对肿瘤控制和正常组织耐受的最佳分割模式尚不明确。
NSCLC寡转移治疗选择的关键之一是明确患者可能获益的治疗方法,然而仅有15%~25%的患者能在局部治疗后延长无病间隔时间(disease-free interval,DFI)[23]。目前,针对NSCLC寡转移患者预后、疗效及不良反应相关生物学靶点的研究仍处于初步探索阶段,掌握上述影响因素对NSCLC寡转移患者的治疗变得尤为重要。相关研究结果显示,与NSCLC寡转移相关的因素包括纵隔淋巴结状态[24]、病理类型、年龄、PS评分、DFI[23]、脑转移患者的诊断特异性等级预后评估系统分级[25]、T分期、转移器官、是否为同时寡转移[26]、原发肿瘤治疗手段[27]、分子结构等。本研究中的单因素分析结果显示,患者性别、寡转移器官数、T分期、放疗干预模式、DT-GTVnx、PFS/OS与中位PFS有关(P < 0.05);患者性别、病理类型、寡转移器官数、初诊分期、T分期、N分期、肺叶手术情况、放疗干预模式、V-GTVnx、肿瘤负荷、肿瘤局部控制情况与中位OS有关(P < 0.05)。
Parikh等[3]的研究表明,无论转移灶是否接受局部治疗,寡转移中较少转移灶患者的预后优于多发转移的患者。Albain等[7]评估了2 531例Ⅳ期NSCLC患者,发现单个转移灶患者的中位OS(8.7个月)明显优于单器官多发转移患者(6.2个月)及多器官多发转移患者(5.1个月)。本研究中,寡转移器官数对局部控制和预后的影响明显强于寡转移病灶数,似乎与前者结论不一致,因此认为,单纯分析转移病灶和器官数量而忽略转移灶生物学特性和物理体积可能存在一定缺陷。NSCLC寡转移中存在预后相关的分层因素,因此创新性地提出了TBSS概念,旨在对NSCLC寡转移患者进行分层,进一步明确放疗获益人群。本研究中,低肿瘤负荷人群为单器官、小体积(≤45.5 cm3)、单转移灶的NSCLC患者,其较高肿瘤负荷的NSCLC寡转移患者有着更优的中位OS(分别为43.0和32.0个月;χ2=5.110,P=0.024)。
Asworth等[23]的荟萃分析结果显示,寡转移出现的时间是NSCLC患者重要的预后因素,75.5%的患者为同时性寡转移,24.5%为异时性寡转移,在该项研究中,患者被分为3个预后组:低风险即异时性转移患者(5年生存率为47.8%),中风险即同时性转移和N0期患者(5年生存率为36.2%),高风险即同时性转移和N1~2期患者(5年生存率为13.8%)。本研究结果也证实,同时性寡转移的NSLCL患者(初诊Ⅳ期)较异时性寡转移患者(初诊Ⅰ~Ⅲ期)有着更差的中位OS(分别为30.0和43.0个月;χ2=5.398,P=0.020)。
此外,更多有关寡转移分子机制的研究正在开展。Liu等[28]对66例接受SBRT的NSCLC肺转移患者进行研究,发现SBRT后1个月肺转移瘤的肿瘤反应与周围CD4+T细胞、记忆CD8+T细胞、幼稚CD4+T细胞、幼稚CD4+/记忆CD4+独立相关,体现了宿主的免疫状态与SBRT疗效相关。而在另一项研究中,CD8+T细胞和CD28+T细胞的计数被认为是NSCLC肺转移患者接受SBRT早期肿瘤反应的预测因子[29]。Lussier等[30]鉴定了在小鼠模型中,microRNA-200c参与了肿瘤从寡转移进展为多转移状态的进程。因此,对于分子生物标志物在NSCLC寡转移中的研究,需要积极推动和展开。
Li等[26]分析了24项研究以确定NSCLC寡转移的预后因素,共纳入1 935例患者,发现原发灶(HR=0.56,95% CI为0.37~0.83,P=0.001)和转移灶(HR=0.54, 95%CI为0.36~0.82, P < 0.001)接受积极或根治性局部治疗的患者具有更好的OS。本研究中,针对转移灶采取放疗早期干预的治疗模式可带来PFS与OS的双重获益,也印证了局部治疗在寡转移NSCLC全程管理中的治疗地位。本研究中,并没有发现全身治疗包括化疗、小分子靶向治疗及抗血管治疗带来PFS与OS上的获益,鉴于回顾性研究证据的局限性,期待后续开展的多中心、随机对照临床试验ChiCTR1800017496研究,以提供不同治疗模式影响PFS和OS的高级别证据。
总之,女性、低肿瘤负荷和放疗早期干预的NSCLC寡转移患者的OS明显延长,放疗早期干预可明显改善患者的预后,且放疗相关不良反应均可耐受,提示局部放疗是治疗NSCLC寡转移患者安全且有效的手段。放疗中晚期干预是影响NSCLC寡转移患者PFS的独立危险因素,PFS/OS > 0.3是影响NSCLC寡转移患者PFS的独立保护因素,说明早期放疗干预能给患者带来PFS的获益,而PFS占OS比重逾三成则表明了放疗干预的局部控制成功。男性、高肿瘤负荷、放疗中晚期干预是影响NSCLC寡转移患者OS的独立危险因素,因此,男性、高肿瘤负荷NSCLC寡转移患者更需要放疗早期干预,以期优化OS。对于NSCLC寡转移的患者在有效的全身治疗情况下,采取积极的局部治疗获得生存获益已成为临床共识,但目前对于寡转移的生物学特点和发生机制的了解并不充分,基于分子研究和动物模型的基础研究不可缺位。此外,不同器官转移也具有不同的特点,临床实践过程中应当从分子生物学的角度,依据不同器官转移的特点选择治疗方式。另一方面,驱动基因和特异性分子标志物表达情况将NSCLC寡转移的综合治疗方案变得更为复杂多变,更应结合多中心、大样本的前瞻性临床研究结果,开展获益人群筛选,选择合适的放疗技术,调整局部放疗参与治疗的时间窗,制定个体化治疗方案,最终将局部控制获益转化为生存获益。
利益冲突 所有作者均声明不存在利益冲突
志谢 本研究受到苏州市科技发展计划项目(SS201628, KJXW2020008)资助
作者贡献声明 马辰莺负责资料收集、数据的整理和分析、论文的撰写和修改;徐晓婷、秦颂兵协助整理数据、修改论文;柳燕冬、薛姣负责资料收集;周菊英提出研究设计思路,指导论文修改
| [1] |
Niibe Y, Hayakawa K. Oligometastases and oligo-recurrence: the new era of cancer therapy[J]. Jpn J Clin Oncol, 2010, 40(2): 107-111. DOI:10.1093/jjco/hyp167 |
| [2] |
Dingemans AC, Hendriks L, Berghmans T, et al. Definition of synchronous oligometastatic non-small cell lung cancer-a consensus report[J]. J Thorac Oncol, 2019, 14(12): 2109-2119. DOI:10.1016/j.jtho.2019.07.025 |
| [3] |
Parikh RB, Cronin AM, Kozono DE, et al. Definitive primary therapy in patients presenting with oligometastatic non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2014, 89(4): 880-887. DOI:10.1016/j.ijrobp.2014.04.007 |
| [4] |
Mehta N, Mauer AM, Hellman S, et al. Analysis of further disease progression in metastatic non-small cell lung cancer: implications for locoregional treatment[J]. Int J Oncol, 2004, 25(6): 1677-1683. |
| [5] |
Yano T, Okamoto T, Haro A, et al. Local treatment of oligometastatic recurrence in patients with resected non-small cell lung cancer[J]. Lung Cancer, 2013, 82(3): 431-435. DOI:10.1016/j.lungcan.2013.08.006 |
| [6] |
Hishida T, Yoshida J, Aokage K, et al. Postoperative oligo-recurrence of non-small-cell lung cancer: clinical features and survival†[J]. Eur J Cardiothorac Surg, 2016, 49(3): 847-853. DOI:10.1093/ejcts/ezv249 |
| [7] |
Albain KS, Crowley JJ, LeBlanc M, et al. Survival determinants in extensive-stage non-small-cell lung cancer: the Southwest Oncology Group experience[J]. J Clin Oncol, 1991, 9(9): 1618-1626. DOI:10.1200/JCO.1991.9.9.1618 |
| [8] |
Congedo MT, Cesario A, Lococo F, et al. Surgery for oligometastatic non-small cell lung cancer: long-term results from a single center experience[J]. J Thorac Cardiovasc Surg, 2012, 144(2): 444-452. DOI:10.1016/j.jtcvs.2012.05.051 |
| [9] |
Jabbour SK. Are we expanding oligometastatic non-small-cell lung cancer using advanced radiotherapeutic modalities?[J]. J Clin Oncol, 2014, 32(34): 3794-3796. DOI:10.1200/JCO.2014.58.5539 |
| [10] |
Di Lascio S, Pagani O. Oligometastatic breast cancer: a shift from palliative to potentially curative treatment?[J]. Breast Care (Basel), 2014, 9(1): 7-14. DOI:10.1159/000358750 |
| [11] |
Bergsma DP, Salama JK, Singh DP, et al. The evolving role of radiotherapy in treatment of oligometastatic NSCLC[J]. Expert Rev Anticancer Ther, 2015, 15(12): 1459-1471. DOI:10.1586/14737140.2015.1105745 |
| [12] |
吴炳群, 魏慎海, 田进涛, 等. 不同转移部位的非小细胞肺癌患者的生存时间比较[J]. 中国肺癌杂志, 2019, 22(2): 105-110. Wu BQ, Wei SH, Tian JT, et al. Comparison of the survival time in the non-small cell lung cancer patients with different organ metastasis[J]. Chin J Lung Cancer, 2019, 22(2): 105-110. DOI:10.3779/j.issn.1009-3419.2019.02.05 |
| [13] |
Andrews DW, Scott CB, Sperduto PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase Ⅲ results of the RTOG 9508 randomised trial[J]. Lancet, 2004, 363(9422): 1665-1672. DOI:10.1016/S0140-6736(04)16250-8 |
| [14] |
Gomez DR, Blumenschein GR Jr, Lee JJ, et al. Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after first-line systemic therapy: a multicentre, randomised, controlled, phase 2 study[J]. Lancet Oncol, 2016, 17(12): 1672-1682. DOI:10.1016/S1470-2045(16)30532-0 |
| [15] |
Petty WJ, Urbanic JJ, Ahmed T, et al. Long-term outcomes of a phase 2 trial of chemotherapy with consolidative radiation therapy for oligometastatic non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2018, 102(3): 527-535. DOI:10.1016/j.ijrobp.2018.06.400 |
| [16] |
Divisi D, Barone M, Zaccagna G, et al. Surgical approach in the oligometastatic patient[J]. Ann Transl Med, 2018, 6(5): 94. DOI:10.21037/atm.2018.01.19 |
| [17] |
Collen C, Christian N, Schallier D, et al. Phase Ⅱ study of stereotactic body radiotherapy to primary tumor and metastatic locations in oligometastatic nonsmall-cell lung cancer patients[J]. Ann Oncol, 2014, 25(10): 1954-1959. DOI:10.1093/annonc/mdu370 |
| [18] |
De Ruysscher D, Wanders R, van Baardwijk A, et al. Radical treatment of non-small-cell lung cancer patients with synchronous oligometastases: long-term results of a prospective phase Ⅱ trial (Nct01282450)[J]. J Thorac Oncol, 2012, 7(10): 1547-1555. DOI:10.1097/JTO.0b013e318262caf6 |
| [19] |
Griffioen GH, Toguri D, Dahele M, et al. Radical treatment of synchronous oligometastatic non-small cell lung carcinoma (NSCLC): patient outcomes and prognostic factors[J]. Lung Cancer, 2013, 82(1): 95-102. DOI:10.1016/j.lungcan.2013.07.023 |
| [20] |
McCammon R, Schefter TE, Gaspar LE, et al. Observation of a dose-control relationship for lung and liver tumors after stereotactic body radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2009, 73(1): 112-118. DOI:10.1016/j.ijrobp.2008.03.062 |
| [21] |
Iyengar P, Kavanagh BD, Wardak Z, et al. Phase Ⅱ trial of stereotactic body radiation therapy combined with erlotinib for patients with limited but progressive metastatic non-small-cell lung cancer[J]. J Clin Oncol, 2014, 32(34): 3824-3830. DOI:10.1200/JCO.2014.56.7412 |
| [22] |
Milano MT, Katz AW, Zhang H, et al. Oligometastases treated with stereotactic body radiotherapy: longterm follow-up of prospective study[J]. Int J Radiat Oncol Biol Phys, 2012, 83(3): 878-886. DOI:10.1016/j.ijrobp.2011.08.036 |
| [23] |
Ashworth AB, Senan S, Palma DA, et al. An individual patient data metaanalysis of outcomes and prognostic factors after treatment of oligometastatic non-small-cell lung cancer[J]. Clin Lung Cancer, 2014, 15(5): 346-355. DOI:10.1016/j.cllc.2014.04.003 |
| [24] |
Dai C, Ren Y, Xie D, et al. Does lymph node metastasis have a negative prognostic impact in patients with NSCLC and M1a disease?[J]. J Thorac Oncol, 2016, 11(10): 1745-1754. DOI:10.1016/j.jtho.2016.06.030 |
| [25] |
Bergsma DP, Salama JK, Singh DP, et al. Radiotherapy for oligometastatic lung cancer[J]. Front Oncol, 2017, 7: 210. DOI:10.3389/fonc.2017.00210 |
| [26] |
Li S, Zhu R, Li D, et al. Prognostic factors of oligometastatic non-small cell lung cancer: a meta-analysis[J]. J Thorac Dis, 2018, 10(6): 3701-3713. DOI:10.21037/jtd.2018.05.105 |
| [27] |
Frost N, Tessmer A, Schmittel A, et al. Local ablative treatment for synchronous single organ oligometastatic lung cancer-A propensity score analysis of 180 patients[J]. Lung Cancer, 2018, 125: 164-173. DOI:10.1016/j.lungcan.2018.09.021 |
| [28] |
Liu C, Hu Q, Xu B, et al. Peripheral memory and naïve T cells in non-small cell lung cancer patients with lung metastases undergoing stereotactic body radiotherapy: predictors of early tumor response[J]. Cancer Cell Int, 2019, 19: 121. DOI:10.1186/s12935-019-0839-5 |
| [29] |
Liu C, Hu Q, Hu K, et al. Increased CD8+CD28+ T cells independently predict better early response to stereotactic ablative radiotherapy in patients with lung metastases from non-small cell lung cancer[J]. J Transl Med, 2019, 17(1): 120. DOI:10.1186/s12967-019-1872-9 |
| [30] |
Lussier YA, Xing HR, Salama JK, et al. MicroRNA expression characterizes oligometastasis(es)[J]. PLoS One, 2011, 6(12): e28650. DOI:10.1371/journal.pone.0028650 |
 2021, Vol. 41
2021, Vol. 41


