2. 天津医科大学第二医院 300211;
3. 山东省滕州市中心人民医院 277500;
4. 河北省承德钢铁集团有限公司职工医院 067002;
5. 辽宁省大连大学附属中山医院 116001
2. The Second Hospital of Tianjin Medical University, Tianjin 300211, China;
3. Tengzhou Central People's Hospital of Shandong Province, Tengzhou 277500, China;
4. Staff Hospital of Chengde Iron and Steel Group Co. Ltd. of Hebei Province, Chengde 067002, China;
5. Affiliated Zhongshan Hospital of Dalian University of Liaoning Province, Dalian 116001, China
早期非小细胞肺癌(non-small cell lung cancer, NSCLC)的主流治疗手段为手术切除,倘若无法手术,行立体定向消融放疗(stereotactic ablative radiotherapy, SABR)亦可达到接近手术的效果[1]。但对于未手术又不能或不愿接受放疗的患者来说,预后则较差,5年生存率不到10%[2]。随着临床实践的不断发展,放射性125I粒子植入(radioactive 125I seed implantation, RISI)在肿瘤局部治疗中的应用越来越广泛[3],且显示出了良好的局部效果与安全性,为临床提供了另外一种治疗选择[4-7]。而对于前列腺癌以外的早期肿瘤,由于很少初诊时即采用RISI治疗,故RISI在早期肿瘤治疗中的效果如何,目前数据很少。本研究回顾性分析了接受RISI治疗的早期NSCLC患者的数据,拟进一步明确该治疗方式的临床效果及安全性,为实际临床工作及后续相关研究的开展提供数据参考。
资料与方法1.临床资料:由于早期肿瘤接受RISI治疗的病例相对较少,故本研究共联合北京大学第三医院、天津医科大学第二医院、滕州市中心人民医院、承德钢铁集团有限公司职工医院、大连大学附属中山医院共5个治疗中心,回顾性筛选了2010年12月至2018年12月接受RISI治疗的NSCLC患者的病例资料。病例纳入标准:初诊时病理诊断明确为NSCLC;经全身评价后,国际抗癌联盟(Union for International Cancer Control,UICC)第8版分期为T1~3N0M0(IA~IIB期);未行手术及放疗,采用RISI做为初始治疗;术后验证D90达到100 Gy以上。经汇总,共有39例患者纳入分析,平均年龄70岁(51~85岁),KPS评分80(60~90),患者一般资料见表 1。RISI治疗均在患者及家属知情同意下进行。
|
|
表 1 39例早期非小细胞肺癌患者一般临床资料 Table 1 General clinical data of 39 patients with early NSCLC |
2.主要器械与设备:大孔径CT模拟定位机(Brilliance Bigbore CT,荷兰Philips公司)。近距离治疗计划系统(KLSIRPS-3D,北京航空航天大学天航科霖科技发展有限公司)。计划系统源数据参考美国医学物理师学会(American Association of Physicistsin Medicine,AAPM)TG 43及其更新文件[8-9]。放射性125I粒子(BT-125-I,原子高科公司和天津赛德公司),半衰期59.4 d,剂量率常数0.965 cGy/(h·U)。
3.治疗方法
(1) 术前计划:术前1周内行肿瘤部位增强CT扫描,层厚5 mm,将图像传送到计算机治疗计划系统,评价手术可行性并行术前计划设计,包括勾画肿瘤靶区体积(gross tumor volume,GTV)和临近危及器官,设定处方剂量和粒子活度,确定穿刺针道(方向、分布、深度),计算粒子数目,模拟粒子空间位置分布。处方剂量按经验性给予不低于100 Gy。
(2) 术中操作:采用1%利多卡因局部浸润麻醉,按术前预计划设计在CT监视下于目标病灶内插入一次性粒子植入针。粒子针插植边缘达到距肿瘤影像学边缘0.5 cm,每排针间距0.5~1.0 cm。按术前预计划设计,利用Mick粒子植入枪后退式植入粒子,粒子间距0.5~1.0 cm。粒子植入后CT检查,了解粒子分布是否准确,如果粒子空间分布欠均匀,可以补充粒子,避免剂量学冷点。
(3) 术后处理及剂量验证:术后常规给予抗感染及止血治疗。术后即刻至24 h内行胸部CT了解是否存在气胸、出血等并发症,必要时给予相应处理,同时行术后剂量验证。
4.观察指标:主要评价指标为局部控制率,次要评价指标为总生存率、不良反应与失败原因。随访期间以CT检测肿瘤大小变化。采用国际实体肿瘤疗效评估标准v1.1(RECIST)[10],完全缓解(CR)为靶病灶消失。部分缓解(PR)为靶病灶直径比基线水平减少>30%。疾病进展(PD)为靶病灶直径增加>20%,或出现新病灶。疾病稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间。参考不良事件常用术语评定标准v5.0(Common Terminology Criteriafor Adverse Events,CTCAE)[11]对穿刺并发症及放射性不良反应,进行分级:1级为无症状,无需治疗;2级为有症状,需要治疗;3级为有症状,药物不能完全控制,需要借助物理、仪器或有创操作进行治疗;4级为危及生命,需要抢救;5级为死亡。纳入预后分析的影响因素包括:性别、年龄、KPS、病理类型、分期、病灶位置、D90(90%靶区体积接受的剂量)、是否气胸。
5.统计学处理:采用SPSS 20.0软件行统计学分析。组间率的比较采用卡方检验,采用Kaplan-Meier法计算局部控制率和生存率,采用Log-rank检验比组织间差异并进行单因素分析。P < 0.05为差异有统计学意义。
结果1.粒子植入情况:植入病灶直径1.1~6.0 cm,中位直径2.7 cm;病灶体积2.0~60.1 cm3中位体积13.8 cm3;应用粒子数12~100颗,中位30颗;粒子活度0.6~0.8 mCi(1 Ci=3.7×1010 Bq);针数5~25根,中位10根;术后D90110.4~278.8 Gy,中位159.9 Gy。
2.治疗结果:截至2019年12月,中位随访29个月,全组患者死亡10例(25.6%),存活29例(74.4%),总体的1、3、5年局部控制率分别为89.5%、79%、79%。中位生存时间30.2个月(95%CI 27.4~32.9),1、3、5年生存率分别为100%、74.8%、49.9%。共有13例患者发生治疗失败,其中局部复发5例(12.8%),区域复发1例(2.6%),远处转移4例(10.3%),局部复发合并远处转移2例(5.1%),区域复发合并远处转移1例(2.6%)。操作相关并发症包括,1~2级气胸13例(33.3%),3级气胸9例(23.1%),1级皮下气肿1例(2.6%),1级血胸5例(12.8%),1级针道出血12例(30.8%),2级针道出血1例(2.6%),1级咯血3例(7.7%)。发生3级气胸的患者为肺压缩体积>30%,需要创闭式引流。无危及生命的并发症出现。放射性不良反应方面,有1例2级放射性肺炎(2.6%),未观察到皮肤反应、食管炎、脊髓炎等不良反应。
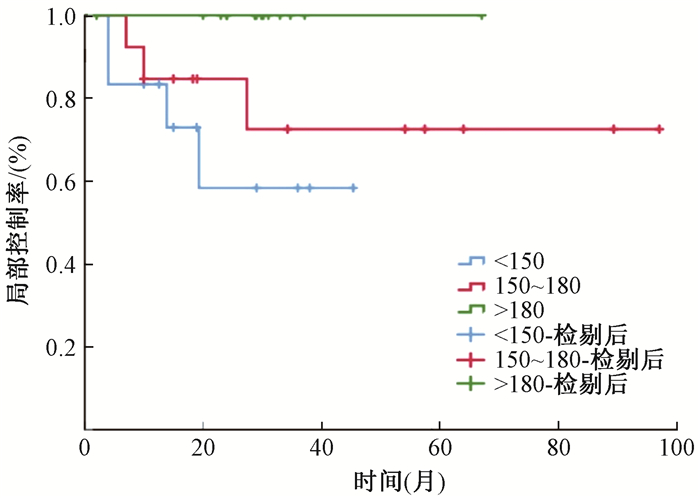
3.影响因素分析:由表 2可知,KPS 80~90、病理类型腺癌、T分期T1~2、术后D90高的患者,有更好的局部控制率(χ2=12.706,3.995、6.077、6.202,P<0.05),其中,D90为<150 Gy、150~180 Gy、>180 Gy患者的3年局部控制率分别为58.3%、72.5%、100%(χ2=6.202,P=0.045),见表 2。而术后剂量高者,同样有更好的生存,术后D90为<150 Gy、150~180 Gy、>180 Gy患者的3年生存率分别为70%、90%、92.3%(χ2=6.907, P=0.032)。并发症方面,病灶体积≤13 cm3(20例)与>13 cm3(19例)的患者,其气胸发生率分别为35%和78.9%,差异有统计学意义(χ2=7.653,P<0.05),其他未发现与气胸相关的影响因素。针数 < 10针(17例)与≥10针(22例)的患者,其气胸发生率分别为41.2%和68.2%。未出现气胸的患者局部控制率与生存情况略优于出现气胸的患者,但差异无统计学意义(P>0.05),其5年局部控制率分别为87.4%与57.6%,5年生存率分别为59.4%与49.3%差异无统计学意义(P>0.05)。
|
|
表 2 39例早期NSCLC患者125I粒子植入治疗后局部控制率单因素分析(%) Table 2 Univariate analysis of local control rate after 125I seeds implantation in 39 patients with early NSCLC(%) |
|
注: χ2=6.202, P<0.05;RISI.放射性125I粒子植入;NSCLC.非小细胞肺癌患者 图 1 接受RISI治疗不同D90NSCLC患者的3年局部控制率 Figure 1 The 3-year local control rate of NSCLC patients receiving RISI with different D90 |
讨论
T1~3N0M0(IA~IIB期)NSCLC的标准治疗为手术和根治性外放疗(包括SABR)[11]。故临床上很少有早期NSCLC病例行RISI治疗。但与外放疗相比,RISI治疗的存在又有其独特的合理性:①125I粒子在组织内的半价层为2.6 cm,其植入肿瘤后,肿瘤靶区内部剂量高,周围正常组织剂量低,理论上更有利于正常组织的保护[12]。②粒子在肿瘤内的分布经过术前设计并可以术中适时调整,肿瘤靶区可以实现真正的适形、调强照射。③粒子一次性植入肿瘤靶区对肿瘤细胞进行持续杀伤,很好地克服了器官运动和治疗中/分次治疗间带来的误差,剂量实施更确切。④无需加速器,需要的软硬件成本相对较低,基层医院即可开展,可服务于更多的基层患者。故在临床实践中,尚有少数早期未能手术的NSCLC患者,接受了RISI治疗。本研究回顾性收集了8年时间(2010—2018年)、5个治疗中心的病例,汇集较大的样本量数据。
本研究中的3、5年局部控制率皆为79%(Ⅰ期患者为84.9%)。在Martínez-Monge等[13]的研究中,对7例分期为T1N0M0的NSCLC患者行RISI治疗,中位随访13个月(4.6~41.0个月),无患者出现局部或区域复发,显示了RISI局部治疗的良好效果。回顾SABR的研究,其3年局部控制率虽多为90%或以上[14-16],但一些长期结果显示,其5年局部控制率则为80%左右[17-19],可见RISI对于局部的控制已达到接近SABR水平。而且本研究显示,剂量(D90)是局部控制的独立影响因素,D90高者局部控制率好,尤其对于D90>180 Gy者,3年局部控制可达100%,而未出现2级或以上不良反应,此提示若将剂量进一步提高,有达到或超过SABR效果的可能性。而本研究中的生存率与主要死亡原因(远处远移),与SABR的结果类似。
影响外照射剂量提升的一个重要的限制就是放射性不良反应,虽然目前SABR的不良反应已经较低,但仍有5%~10%的患者会发生3级及以上不良反应(肺炎、胸痛、咯血等)[16, 19-20],在部分研究中,这个比例甚至达到15%~30%[17-18, 21]。而纵观RISI相关研究,放射性不良反应的发生率很低,一些头颈部、胸壁肿瘤的研究中,皮肤/黏膜1、2级不良反应发生率为7%~30%,皆未观察到3~4级不良反应,且其中大部分患者既往接受过放疗[5, 22]。若患者病灶位于纵隔,行RISI则有食管瘘、气管瘘的风险[23],而早期肺癌并不会出现病灶侵犯纵隔的情况。本研究同样显示了RISI不良反应低的特点,放射性不良反应中,仅有1例患者出现2级放射性肺癌炎,该患者D90为144 Gy,经药物治疗后好转。由于相关数据较少,RISI的剂量/不良反应关系尚需进一步研究加以明确。
与外照射不同,由于是有创操作,RISI治疗还存在操作并发症,本研究中最主要的操作并发症为气胸,发生率达56.4%。在肺穿刺活检的研究中,报道的气胸发生率多为30%以下,需要引流者不足10%[24-26]。而本研究与之相比,气胸发生率处于较高水平,考虑与RISI操作时间较长、穿刺针数较多有关。在针对气胸的影响因素分析中,病灶大与针数多者气胸发生率也的确更高,但经过治疗后基本可恢复。未出现气胸的患者局部控制率与生存率皆略优于出现气胸的患者,考虑可能与气胸会影响操作质量有关,但差异并未达统计学意义,后续需要扩大样本量进一步明确。其他并发症多数轻微且发生率低。就本研究的数据来看,RISI治疗的安全性良好。
在预后因素分析方面,相关的数据较少,本研究显示腺癌的局部控制情况优于鳞癌,在头颈肿瘤部RISI的研究[4]和早期NSCLC行SABR的研究[27]中同样观察到了此种情况,而具体机制可能需要与放射生物学相关的进一步研究。同样,在非前列腺癌的肿瘤中,有关放射性粒子的剂量与局部控制的关系,研究报道很少,但本研究所显示的剂量更高者局部控制更好(如前所述),符合临床预期。
综上所述,RISI治疗无法手术的早期NSCLC有接近SABR的效果且不良反应发生率低,若患者不能或拒绝行根治性外放疗,在充分对患者进行知情同意的情况下,可酌情选择是否进行该治疗。气胸是最主要的操作并发症。腺癌、剂量高预示着较好的局部控制,随着植入设备的完善和植入技术的改进,提高剂量有进一步提高疗效的可能性。后续研究可继续积累样本量,进一步探索剂量与疗效、不良反应的关系,以对临床处方剂量给予指导。
利益冲突 无
作者贡献声明 吉喆负责撰写论文、文献检索及数据分析;霍彬负责临床资料与数据收集、文献检索与数据分析;邢超、马艳丽、王喆负责临床资料与数据收集;宋玉卿、张开贤负责论文修改;王若雨、柴树德负责论文审核与校对;王俊杰负责研究设计及论文审核
| [1] |
National Comprehensive Cancer Network (NCCN).Clinical practice guidelines in oncology: non-small cell lung cancer. Version 2.2020.David S.Ettinger: NCCN, 2020[2020-04-15].https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
|
| [2] |
Raz DJ, Zell JA, Ou SH, et al. Natural history of stage I non-small cell lung cancer:implications for early detection[J]. Chest, 2007, 132(1): 193-199. DOI:10.1378/chest.06-3096 |
| [3] |
Zhang F, Wang J, Guo J, et al. Chinese expert consensus workshop report:guideline for permanent 125I seed implantation of primary and metastatic lung tumors[J]. Thoracic Cancer, 2019, 10(2): 388-394. DOI:10.1111/1759-7714.12912 |
| [4] |
Ji Z, Jiang Y, Tian S, et al. The effectiveness and prognostic factors of CT-guided radioactive 125I seed implantation for the treatment of recurrent head and neck cancer after external beam radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2019, 103(3): 638-645. DOI:10.1016/j.ijrobp.2018.10.034 |
| [5] |
Jiang P, Liu C, Wang J, et al. Computed tomography (CT)-guided interstitial permanent implantation of 125I seeds for refractory chest wall metastasis or recurrence[J]. Technol Cancer Res Treat, 2015, 14(1): 11-18. DOI:10.7785/tcrt.2012.500402 |
| [6] |
Wang H, Wang J, Jiang Y, et al. The investigation of 125I seed implantation as a salvage modality for unresectable pancreatic carcinoma[J]. J Exp Clin Cancer Res, 2013, 32(1): 106-113. DOI:10.1186/1756-9966-32-106 |
| [7] |
Wang JJ, Yuan HS, Li JN, et al. Interstitial permanent implantation of 125I seeds as salvage therapy for re-recurrent rectal carcinoma[J]. Int J Colorectal Dis, 2009, 24(4): 391-399. DOI:10.1007/s00384-008-0628-4 |
| [8] |
Nath R, Anderson LL, Luxton G, et al. Dosimetry of interstitial brachytherapy sources:recommendations of the AAPM Radiation Therapy Committee Task Group No.43.American Association of Physicists in Medicine[J]. Med Phys, 1995, 22(2): 209-234. DOI:10.1118/1.597458 |
| [9] |
Rivard MJ, Coursey BM, De Werd LA, et al. Update of AAPM Task Group No.43 Report:a revised AAPM protocol for brachytherapy dose calculations[J]. Med Phys, 2004, 31(3): 633-674. DOI:10.1118/1.1646040 |
| [10] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [11] |
National Cancer Institute (NCI).Common Terminology Criteria for Adverse Events (CTCAE), Version 5.2017.Lyubov Remennik: NCI, 2020[2020-4-15]. https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_5.0.
|
| [12] |
Sastry KS. Biological effects of the auger emitter 125I:a review.Report No.1 of AAPM Nuclear Medicine Task Group No.6[J]. Med Phys, 1992, 19(6): 1361-1370. DOI:10.1118/1.596926 |
| [13] |
Martínez-Monge R, Pagola M, Vivas I, et al. CT-guided permanent brachytherapy for patients with medically inoperable early-stage non-small cell lung cancer (NSCLC)[J]. Lung Cancer, 2008, 61(2): 209-213. DOI:10.1016/j.lungcan.2007.12.016 |
| [14] |
Videtic GM, Hu C, Singh AK, et al. A randomized phase 2 study comparing 2 stereotactic body radiation therapy schedules for medically inoperable patients with stage I peripheral non-small cell lung cancer:NRG Oncology RTOG 0915(NCCTG N0927)[J]. Int J Radiat Oncol Biol Phys, 2015, 93(4): 757-764. DOI:10.1016/j.ijrobp.2015.07.2260 |
| [15] |
Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076. DOI:10.1001/jama.2010.261 |
| [16] |
Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer:a pooled analysis of two randomised trials[J]. Lancet Oncol, 2015, 16(6): 630-637. DOI:10.1016/S1470-2045(15)70168-3 |
| [17] |
Timmerman RD, Hu C, Michalski J, et al. Long-term results of RTOG 0236:a phase Ⅱ trial of stereotactic body radiation therapy (sbrt) in the treatment of patients with medically inoperable stage I non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2014, 90(1): S30. DOI:10.1016/j.ijrobp.2014.05.135 |
| [18] |
Lindberg K, Nyman J, Riesenfeld Källskog V, et al. Long-term results of a prospective phase Ⅱ trial of medically inoperable stage I NSCLC treated with SBRT-the Nordic experience[J]. Acta Oncol, 2015, 54(8): 1096-1104. DOI:10.3109/0284186X.2015.1020966 |
| [19] |
Shibamoto Y, Hashizume C, Baba F, et al. Stereotactic body radiotherapy using a radiobiology-based regimen for stage I non-small-cell lung cancer:five-year mature results[J]. J Thorac Oncol, 2015, 10(6): 960-964. DOI:10.1097/JTO.0000000000000525 |
| [20] |
Sun B, Brooks ED, Komaki RU, et al. 7-year follow-up after stereotactic ablative radiotherapy for patients with stage I non-small cell lung cancer:results of a phase 2 clinical trial[J]. Cancer, 2017, 123(16): 3031-3039. DOI:10.1002/cncr.30693 |
| [21] |
Bezjak A, Paulus R, Gaspar LE, et al. Efficacy and toxicity analysis of NRG oncology/RTOG 0813 trial of stereotactic body radiation therapy (SBRT) for centrally located non-small cell lung cancer (NSCLC)[J]. Int J Radiat Oncol Biol Phys, 2016, 96(2 Suppl): S8. DOI:10.1016/j.ijrobp.2016.06.035 |
| [22] |
Jiang Y, Ji Z, Guo F, et al. Side effects of CT-guided implantation of 125I seeds for recurrent malignant tumors of the head and neck assisted by 3D printing non co-planar template[J]. Radiat Oncol, 2018, 13(1): 18-24. DOI:10.1186/s13014-018-0959-4 |
| [23] |
Stewart AJ, O'Farrell DA, Mutyala S, et al. Severe toxicity after permanent radioactive seed implantation for mediastinal carcinoid tumors[J]. Brachytherapy, 2007, 6(1): 58-61. DOI:10.1016/j.brachy.2006.08.009 |
| [24] |
Yeow KM, See LC, Lui KW, et al. Risk factors for pneumothorax and bleeding after CT-guided percutaneous coaxial cutting needle biopsy of lung lesions[J]. J Vasc Interv Radiol, 2001, 12(11): 1305-1312. DOI:10.1016/S1051-0443(07)61556-5 |
| [25] |
Yildirim E, Kirbas I, Harman A, et al. CT-guided cutting needle lung biopsy using modified coaxial technique:factors effecting risk of complications[J]. Eur J Radiol, 2009, 70(1): 57-60. DOI:10.1016/j.ejrad.2008.01.006 |
| [26] |
Zheng YF, Jiang LM, Mao WM, et al. Percutaneous computed tomography-guided lung biopsy of solitary nodular ground-glass opacity[J]. J Cancer Res Ther, 2015, 11(Suppl): C231-C233. DOI:10.4103/0973-1482.162117 |
| [27] |
Baine MJ, Verma V, Schonewolf CA, et al. Histology significantly affects recurrence and survival following SBRT for early stage non-small cell lung cancer[J]. Lung Cancer, 2018, 118: 20-26. DOI:10.1016/j.lungcan.2018.01.021 |
 2021, Vol. 41
2021, Vol. 41
