局部晚期腮腺腺样囊性癌(ACC)常因广泛浸润邻近肌肉、神经、颅底骨质、颈动脉,难以实施根治性手术切除。放射治疗是控制腺样囊性癌局部进展的一种重要治疗手段[1]。因头颈部解剖结构复杂的特殊性,尤其对于发生在近颅底、重要血管受侵的恶性肿瘤,放射治疗可以达到较高的局部控制率,但经常导致非常严重的近远期放射性不良反应。
125I放射性粒子组织间植入治疗具有高度适形的特点,在治疗肿瘤的同时可降低正常组织的放射性损伤,已在头颈部恶性肿瘤如唾液腺恶性肿瘤、软组织肉瘤等方面取得较好疗效[2-3]。本研究旨在单纯应用125I放射性粒子组织间植入治疗局部晚期腮腺腺样囊性癌,评估其局部控制、区域及远处转移,并对预后影响因素进行分析,为局部晚期腮腺腺样囊性癌的治疗提供临床参考。
资料与方法1. 一般临床资料:本研究回顾性纳入2007年8月至2018年1月就诊于北京大学口腔医院,接受单纯应用125I放射性粒子植入治疗的局部晚期腮腺腺样囊性癌患者。入选标准:组织病理学明确诊断的腮腺来源的原发腺样囊性癌;不能手术治疗的患者(包括局部进展期的原发腮腺腺样囊性癌不能完整切除者,肿瘤临床分期为T4b如包绕动脉、侵犯颅底等,合并其他疾病不能耐受手术或拒绝手术者);Karnofsky评分≥60;预计生存期≥6个月。排除标准:既往头颈部肿瘤放射治疗史、化学药物治疗史;临床显著的心脑血管疾病、系统性疾病等影响麻醉及放射性粒子穿刺植入;局部区域感染、破溃。本研究已经北京大学口腔医院伦理委员会批准。
2. 125I放射性粒子植入:结合临床检查、影像学检查与病理分型,基于导入计划设计系统(treatment planning system, TPS)的CT数据,勾画肿瘤临床靶区及毗邻重要器官,设计计划靶区(planned tumor volume, PTV):肿瘤未侵犯颅底者,计划剂量(planned dose, PD)为120 Gy,危及器官包括泪腺、视神经、颅底、中耳及皮肤;侵犯颅底者PD为140 Gy,根据面神经走行区域勾画颅底靶区,危及器官还包括斜坡及周围神经孔。根据剂量分布曲线调整粒子植入计划,D90>PD;V100>90%,V150 < 50%;以TD5/5(治疗后5年,因放射治疗造成严重放射损伤的患者不超过5%的损伤剂量)作为危及器官的最大耐受剂量,危及器官不超过耐受剂量:颞叶60 Gy,脑干50 Gy,视神经50 Gy,中耳50 Gy,耳蜗30 Gy。
全麻下于患侧腮腺区安放3D打印个体化穿刺引导模板,并在其引导下完成植入针穿刺与放射性粒子植入,粒子植入术后48 h内行CT检查验证粒子分布、实际临床靶区及剂量等治疗计划内容。
3. 疗效评价与统计分析:在粒子植入术后半年内每2个月复查1次,6~24个月每3个月复查1次,之后每半年复查1次。随访过程中,对原发肿瘤局部控制率(local control rate, LCR)、总生存率(overall survival, OS)、无进展生存率(progression-free survival, PFS)、颈部淋巴结转移情况、远处转移情况进行评估;依据RTOG/EORTC标准评价放疗相关近远期不良反应。
4. 统计学处理:应用SPSS 20.0统计学软件对LCR、OS、PFS进行Kaplan-Meier生存分析,应用Log-rank检验及Logistics分析预后相关影响因素。P<0.05为差异有统计学意义。
结果1. 基本情况:本组病例共16例,多以患侧疼痛(10/16,62.5%)或面神经瘫痪(9/16,56.3%)就诊,其中女性占多数(11/16,68.7%),年龄范围为30~80岁,中位年龄55.4岁,详细情况见表 1。本组病例中肿瘤临床分期皆为T4bN0M0,按照美国癌症联合委员会(AJCC)分期[4],中晚期患者共5例,侵犯下颌骨(3/16,18.75%)、面神经(2/18,11.11%)、皮肤(2/18,11.11%)、外耳道者(2/18,11.11%);重度晚期者共11例,分别侵犯颅底(6/16,37.5%)、翼腭板(1/18,6.25%)、包绕颈动脉(8/16,50%)。经粗空心针穿刺取活检,进行病理学诊断,可分型者分为实性型、筛孔型、腺样管状型。
|
|
表 1 单纯应用125I放射性粒子植入近距离治疗病例临床资料 Table 1 Clinical characteristics of the patients who received 125I interstitial brachytherapy |
2. 125I放射性粒子植入:16例患者均1次顺利完成,未发生穿刺区大出血等并发症;平均植入粒子数目89.2颗,粒子放射活度0.6~0.7 mCi/颗(1 Ci=3.7×1010 Bq),经TPS验证符合治疗计划设计要求。
3. 临床预后
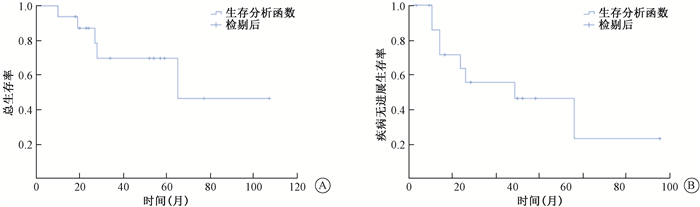
(1) 总生存率:随访8~104个月(中位随访时间41.5个月),1、3、5年OS分别为86.7%、72%、54%,见图 1。4例患者死亡:1例第60月时因肺部及双颈淋巴结多发转移、肿物侵犯颈内动脉、全身恶液质及咽旁瘘死亡;1例第36个月时死于肺、肝、骨多发转移;1例腮腺区域局部控制,第22个月出现上颌前部、颞部复发,伴坐骨、腰椎、肝、肺转移,死于远处转移;1例肿瘤局部缓解,在治疗后第9个月时因肝脏转移后死亡。不同病理类型的局部晚期腮腺腺样囊性癌OS(P=0.646)、PFS(P=0.954)差异无统计学意义。
|
图 1 单纯应用125I放射性粒子近距离治疗局部晚期腮腺腺样囊性癌的生存分析 A.总生存率;B.疾病无进展生存率 Figure 1 Overall survival and progression free survival in patients treated with 125I interstitial brachytherapy for local advanced parotid adenoid cystic carcinoma A.Overall survival; B.Progression free survival |
(2) 局部复发与颈淋巴结转移:5例(5/16,31.2%)患者出现局部复发,1、3、5年LCR分别为93.7%、80%、68.7%,1、3、5年PFS为74%、53%、18.9%。其中3例分别在第13、23、24个月出现上颌骨及周围肌肉受侵,同侧眼球运动障碍与视力减退;1例第9个月时肿瘤进展,侵犯颅底骨质且范围广,出现进食吞咽困难、面瘫等加重,1例局部肿物复发累及颅内动脉伴右咽旁瘘、恶液质。1例患者术后1个月出现颈淋巴结转移,接受了颈淋巴结清除及颈部放射治疗后,随访5年无复发。
(3) 远处转移:9例(56.2%)患者出现不同远位器官转移,以颅内转移(6/16,37.5%)、肺转移(5/16,31.25%)常见;其中6例术前伴有颅底骨质侵犯者出现多器官转移,4例骨转移,3例肝转移。单因素分析示颈淋巴结转移(P=0.994)、神经周侵犯(P=0.239)、颅底骨质破坏(P=0.350)均不是远处转移的危险因素,但包绕颈动脉与远处转移显著相关(HR=12, 95%CI=0.956~150.688, P=0.045)。1、3、5年OS分别为77.8%、58.3%、26.7%,1、3、5年PFS分别为62.5%、50%、37.5%;无远处转移者1、3、5年OS均为100%,1、3、5年PFS分别为85.7%、62.5%、62.5%。
(4) 肿瘤周围侵犯情况对疗效的影响:6例患者肿瘤侵犯颅底,1年OS、PFS为80%、62.5%,未侵犯颅底者1年OS、PFS为90%、80%。8例肿瘤包绕颈动脉,1、3、5年OS分别为85.7%、64.3%、32.1%,1、3、5年PFS分别为71.4%、53.6%、35.7%;未包绕颈动脉者1、3、5年OS分别为87.5%、75%、75%,1、3、5年PFS分别为76.2%、50.8%、38.1%。
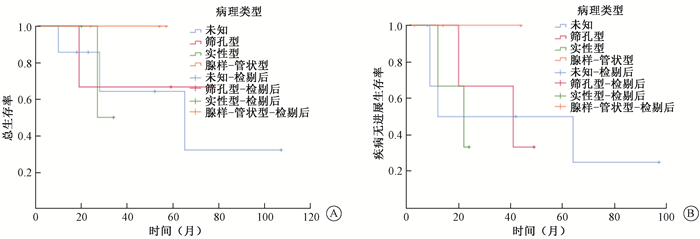
9例患者存在神经周侵犯,1、3、5年OS为85.7%、51.4%、25.7%,1、3、5年PFS为83.3%、50%、25%;无神经周侵犯者1、3、5年OS为85.7%、51.4%、25.7%,1、3、5年PFS分别为77.8%、50%、25%,见图 2。局部晚期腮腺腺样囊性癌的神经周侵犯显著影响OS(HR=3.636, 95%CI=0.607~21.780,P=0.049),但未影响PFS(P=0.696)。
|
图 2 神经周侵犯对局部晚期腮腺腺样囊性癌的生存的影响 A.总生存率;B.疾病无进展生存率 Figure 2 Effects of perineural invasion on overall survival and progression free survival in patients with local advanced parotid adenoid cystic carcinoma A.Overall survival; B.Progression free survival |
(5) 远期放射不良反应:8例(8/16,50%)患者出现3~4级远期放射性不良反应,多数表现为放射性皮炎,靶区表面局部皮肤萎缩,毛细血管扩张,未出现继发面神经损伤。2例出现3~4级皮肤溃疡。2例患者出现外耳道流脓、听力损伤;2例患者接受治疗后出现渐进性开口受限,经过开口训练后逐渐缓解。4例患者出现眼放射性损伤,其中2例患者肿瘤浸润视神经出现同侧失明。
讨论腮腺腺样囊性癌多采取以手术为主的综合治疗手段,治疗失败主要原因是远处转移与局部复发[5]。无法手术的腮腺腺样囊性癌多为局部晚期、患者因年龄及全身因素无法耐受手术、全身多发转移等,其治疗原则是控制肿瘤进展、延长患者生存期及减少治疗所致不良反应。
腮腺腺样囊性癌的治疗以综合治疗为主,单纯应用放射治疗的局部控制率为4%~50%[6],局部晚期腺样囊性癌的远期局部控制率更低。质子、碳离子放疗利用物理剂量分布,可克服传统放疗靶区设计困难的缺点,提高头颈部腺样囊性癌的5年局部控制率至83%~90%[7]。125I放射性粒子植入治疗具有高度适形的优势,其应用于颅底腺样囊性癌[2]、侵犯颅底的软组织肉瘤[3]已有报道研究。本组病例的预后结果初步显示,共有2例患者肿瘤完全缓解,发生新发颈淋巴结转移少,但远期预后仍然不满意,多数出现远位器官转移,且颅底骨质侵犯者出现局部进展(2/6, 33.3%)或远位多器官转移。Sulaiman等[8]研究中侵犯颅底者易发生靶区边缘复发,5年LCR为68%,伴有颅底骨质破坏者5年总生存率显著降低(44.0% vs. 83.1%)。与既往文献相比,近距离治疗局部晚期腮腺腺样囊性癌的局部控制率稍高、总生存率较低,这与纳入病例的肿瘤体积大、包绕颈动脉者比例高有关,伴有远处转移者总生存率显著降低(26.7% vs. 100%),提示局部复发与远处转移仍是局部晚期腺样囊性癌治疗失败的主要原因。
传统放射治疗中颌骨的骨性遮挡使得射线不能穿透,或增加原有的照射剂量致不良反应加重,或局部照射剂量不足出现“冷区”。常见腮腺区放射不良反应有面神经功能受损、听力受损、乳突炎和颞骨骨髓炎,重度放射不良反应如中枢神经系统损伤、更有大出血等危及生命的可能。Koto等[7]在碳离子治疗16例腺样囊性癌的研究中,5例患者出现继发面神经瘫痪,1例放射性骨坏死,5例2级以上放射性脑损伤。本组腮腺腺样囊性癌病例放疗PTV包括全腮腺、咽旁间隙及颞下窝,部分PTV沿面神经主干走行区域覆盖颅底。多数远期放射不良反应表现为放射性皮炎,3~4级中重度放射性损伤发生率为50%,未出现继发面神经损伤、颅脑损伤等。与传统外照射治疗、碳离子放疗或质子放疗相比,近距离放射性不良反应较轻,主要为皮肤、外耳道损伤。靶区的术前设计、3D打印个体化穿刺引导模板的应用实现了粒子精确植入、靶区剂量均匀分布,减少了放射不良反应。
受颅底周围解剖结构限制,腮腺颅底放射靶区的勾画与实现显著影响局部复发率,发生颅底骨质侵犯者预后更差。Chen等[9]报道根治性放疗后发生颅底骨质侵犯者总生存率显著降低(19% vs. 91%,P<0.001)。一般认为腺样囊性癌的局部控制失败与其嗜神经跳跃性转移、淋巴血管浸润有关;原发于腮腺区的腺样囊性癌可能沿面神经浸润茎乳孔、颞骨岩部、内耳道,或沿三叉神经耳颞支浸润咀嚼肌[10]。本组病例中5例局部复发患者均为靶区边缘复发,肿瘤局部进展致周围肌肉浸润、上颌骨骨质破坏、颅底骨质破坏进展至颅内。本研究中肿瘤包绕颈动脉显著影响远处转移率,提示肿瘤发生血管浸润更易发生远处转移,但尚无证据证明单纯近距离放射治疗对局部晚期腮腺腺样囊性癌发生远处转移的影响。
单纯应用125I放射性粒子植入治疗不能手术的局部晚期腮腺腺样囊性癌的5年局部控制率达到68.7%,其为无法手术的腮腺腺样囊性癌患者提供了一种微创且局部控制率高的治疗方法。初步研究结果提示,颅底骨质破坏、颈动脉包绕是不可手术的局部晚期(cT4b)腺样囊性癌预后差、发生多器官远处转移的重要预后因素。
利益冲突 无
作者贡献声明 高雅负责资料收集、数据整理分析及论文撰写;张杰、刘树铭、郑磊、黄明伟负责方法具体实施、定期随访;张建国负责论文撰写与设计课题
| [1] |
Morimoto K, Demizu Y, Hashimoto N, et al. Particle radiotherapy using protons or carbon ions for unresectable locally advanced head and neck cancers with skull base invasion[J]. Jpn J Clin Oncol, 2014, 44(5): 428-434. DOI:10.1093/jjco/hyu010 |
| [2] |
Xu N, Zheng L, Wu WJ, et al. Definitive 125I brachytherapy of locally advanced adenoid cystic carcinoma involving the skull base with satisfying efficacy and safety[J]. J Oral Maxillofac Surg, 2019, 77(10): 2143-2153. DOI:10.1016/j.joms.2019.03.031 |
| [3] |
赵丹, 郑磊, 吕晓鸣, 等. 125I放射性粒子植入近距离放疗在儿童口腔颌面-头颈部肉瘤治疗中的应用[J]. 中华医学杂志, 2017, 97(1): 33-37. Zhao D, Zheng L, Lyu XM, et al. Application of 125I radioactive seed implantation brachytherapy in the treatment of oral and maxillofacial-head and neck sarcoma in Children[J]. Chin J Med, 2017, 97(1): 33-37. DOI:10.3760/cma.j.issn.0376-2491.2017.01.009 |
| [4] |
Edge SB, Compton CC. The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471-1474. DOI:10.1245/s10434-010-0985-4 |
| [5] |
Gao M, Hao Y, Huang MX, et al. Clinicopathological study of distant metastases of salivary adenoid cystic carcinoma[J]. Int J Oral Maxillofac Surg, 2013, 42(8): 923-928. DOI:10.1016/j.ijom.2013.04.006 |
| [6] |
Bjørndal K, Krogdahl A, Therkildsen MH, et al. Salivary adenoid cystic carcinoma in Denmark 1990-2005:outcome and independent prognostic factors including the benefit of radiotherapy. Results of the Danish Head and Neck Cancer Group (DAHANCA)[J]. Oral Oncol, 2015, 51(12): 1138-1142. DOI:10.1016/j.oraloncology.2015.10.002 |
| [7] |
Koto M, Demizu Y, Saitoh JI, et al. Definitive carbon-ion radiation therapy for locally advanced sinonasal malignant tumors:subgroup analysis of a multicenter study by the Japan Carbon-Ion Radiation Oncology Study Group (J-CROS)[J]. Int J Radiat Oncol Biol Phys, 2018, 102(2): 353-361. DOI:10.1016/j.ijrobp.2018.05.074 |
| [8] |
Sulaiman NS, Demizu Y, Koto M, et al. Multicenter study of carbon-ion radiation therapy for adenoid cystic carcinoma of the head and neck:subanalysis of the Japan Carbon-Ion Radiation Oncology Study Group (J-CROS) study (1402 HN)[J]. Int J Radiat Oncol Biol Phys, 2018, 100(3): 639-646. DOI:10.1016/j.ijrobp.2017.11.010 |
| [9] |
Chen AM, Garcia J, Granchi P, et al. Base of skull recurrences after treatment of salivary gland cancer with perineural invasion reduced by postoperative radiotherapy[J]. Clin Otolaryngol, 2009, 34(6): 539-545. DOI:10.1111/j.1749-4486.2009.02036.x |
| [10] |
Singh FM, Mak SY, Bonington SC. Patterns of spread of head and neck adenoid cystic carcinoma[J]. Clin Radiol, 2015, 70(6): 644-653. DOI:10.1016/j.crad.2015.01.013 |
 2021, Vol. 41
2021, Vol. 41


