2. 东软医疗系统股份有限公司CT产品事业部, 沈阳 110167
2. CT Business Unit, Neusoft Medical System Co., Ltd, Shenyang 110167, China
随着CT技术发展,CT扫描逐渐成为肺部疾病检查的重要影像学方法,但由其电离辐射而引发的安全问题也逐渐受到人们的关注[1]。相关研究表明,CT辐射剂量每增加1 mSv,患者恶性肿瘤的发病率将增加0.05‰[2]。目前,低剂量已成为胸部CT扫描的研究热点,该方式鼓励临床以不影响诊断为前提,尽可能降低患者所受辐射剂量[3]。与此同时,迭代重建(iterative reconstruction, IR)算法的引入,在一定程度上解决了由于剂量降低而导致图像质量下降的问题,使得低剂量CT检查得到了进一步的发展[4]。IR算法以循环迭代的方式来降低图像噪声并抑制硬化伪影等产生,但在该过程中易发生图像过于平滑或细节丢失等问题[5]。随着人工智能(artificial intelligence, AI)技术的发展,基于深度学习的AI算法逐渐应用于医学图像的优化,为提高CT图像质量提供了新的思路[6-8]。本研究通过AI图像优化技术对图像质量及辐射剂量的影响,探讨AI图像优化技术对低剂量胸部CT检查的价值。
1、资料与方法1.一般资料:前瞻性连续纳入2019年7月至8月于吉林大学第一医院128层CT行胸部平扫的80例患者。纳入标准:年龄大于18岁者;具有完整临床资料者。排除标准:呼吸无法自主配合检查者;妊娠期妇女。本研究经院伦理委员会批准[(2019年)临审第(2019-311)号],所有患者检查前均签署知情同意书。共纳入男43例、女37例,年龄18~80岁,平均年龄(51.9±12.9)岁,体质量指数(BMI)为(23.91±3.08)kg/m2。采用随机数表法将80例患者分为A、B两组,每组各40例。A组年龄18~80岁,平均年龄(52.00±12.37)岁,BMI(24.05±3.69)kg/m2,;B组年龄18~76岁,平均年龄(51.85±13.65)岁,BMI(23.78±2.35)kg/m2。
2.检查方法:所有患者均采用NeuViz Prime CT(中国沈阳东软医疗系统股份有限公司)行胸部平扫。患者扫描前进行呼吸训练,采用仰卧位,扫描范围为肺尖至肺底。所有患者均采用O-Dose自动管电流调制技术,A组(低剂量组)参考电流70 mAs,管电压100 kVp;B组(常规剂量组)参考电流140 mAs,管电压120 kVp。两组除管电压及电流外,其他扫描参数基本保持一致,分别为转速0.5 s,准直128×0.625 mm,螺距1.0,扫描视野500 mm×500 mm。所有图像采用肺窗轴位重建,窗宽1 500 HU,窗位-700 HU,重建矩阵512×512,重建层厚1.0 mm,滤波参数Lung20。
3.图像后处理及AI优化:A组图像首先进行50% ClearView迭代重建,将重建图像作为A1组,用于临床诊断使用;随后应用AI成像优化平台进行图像重建,将重建结果作为A2组。该平台以高噪声的体模及人体胸部CT图像作为训练数据输入,以常规剂量优质胸部CT图像作为输出,利用半监督的生成对抗网络进行CT噪声分布特征的学习,建立定制化的图像优化模型,可准确地将A1组图像的噪声伪影进行精准分离而不影响其解剖结构的显示。B组仅采用50% ClearView迭代算法重建图像。
4.图像质量分析:将所有图像传入东软医疗AVW 2.0工作站进行图像质量分析。
(1) 客观评价:分别取主动脉弓、气管隆突下及上腹肝门3个层面的图像,于每一层面皮下脂肪及主动脉内分别放置2个面积为30~50 mm2的感兴趣区(region of interest, ROI)。测量各ROI的CT值及标准差(standard deviation, SD),SD值代表相应组织的噪声值。分别计算每例图像3个层面脂肪CT值平均值(CT脂肪)、主动脉血管内CT值(CT血管)的均值及SD均值。通过公式计算图像信噪比(signal to noise ratio, SNR):SNR=CT血管/SD,对比噪声比(contrast to noise ratio, CNR): CNR=(CT血管-CT脂肪)/SD[9]。
(2) 主观评价:由两名高年资放射科医生采用Likert 5级评分法[10],从主观噪声及肺内结构(血管和支气管)的显示情况等方面对所有图像进行评分。主观噪声评分标准为:5分,图像质量优良,噪声小;4分,图像质量好,轻微噪声;3分,图像质量中等,噪声情况一般;2分,图像质量较差,噪声较多;1分,图像质量极差,噪声情况严重。肺内结构(血管及支气管)清晰度的评分标准为:5分,出色的可视度,边界锐利,细节显示清晰;4分,可视程度超过平均水平,边界及细节显示良好;3分,可接受的可视程度,边界及细节显示一般;2分,欠佳的可视程度,边界模糊,细节显示不清;1分,无法接受的可视程度,无法区分边界及细节。图像主观评分≥3分即认为图像可被临床接受。
5.辐射剂量的计算:记录A、B两组患者剂量报告内的电压、电流、容积CT剂量指数(CT dose index, CTDIvol)及剂量长度乘积(dose length product, DLP)并计算有效辐射剂量(effective dose, E),其中E=DLP×k,式中k为CT扫描转换因子,参考欧盟委员会(EC)CT质量标准指南,胸部k值为0.014 mSv·mGy-1·cm-1 [11]。
6.统计学处理:采用SPSS 25.0统计软件进行分析。连续变量采用x±s或中位数(第一四分位数-第三四分位数)表示,分类变量用频数表示。对连续变量采用Shapiro-Wilk检验进行正态分布检验。对符合正态分布的数据采用独立样本t检验或配对样本t检验;对不符合正态分布的数据采用Mann-Whitney U或Wilcoxion秩和检验。采用卡方检验对图像主观评分进行比较,两名医师主观评分一致性分析采用Cohen Kappa检验。P < 0.05为差异有统计学意义。
2、结果1.一般资料:80例患者均一次性完成胸部CT平扫检查,扫描数据均满足要求。A、B两组患者的年龄、性别、BMI及扫描长度比较差异均无统计学意义(P>0.05, 表 1)。
|
|
表 1 3组图像的客观评价指标比较(x±s) Table 1 Comparison of objective evaluation indexes of the images in groups A1, A2 and B(x±s) |
2.图像质量分析:客观图像质量评价通过比较A1和A2两组图像的CT值以及A1组、A2组及B组3组图像在SD、SNR及CNR的差异而得出。在CT值方面,经AI优化后的A2组与A1组在血管及脂肪CT值的比较差异无统计学意义(P>0.05)。在图像SD、SNR及CNR方面,低剂量迭代组(A1组)的SD显著高于常规剂量组(B组),而SNR及CNR均显著低于B组(ZSD=-4.24、ZSNR=-2.54、tCNR=-2.27,P < 0.05);而A1组经AI优化后得到的低剂量AI组(A2组)的SD显著低于B组(图 1),且SNR及CNR显著高于B组(tSD=-28.24、tSNR=19.43、tCNR=25.65,P < 0.001)(表 1)。A2组与A1组相比,图像SD降低约73.4%,SNR及CNR分别提高了约272.5%、268.5%。
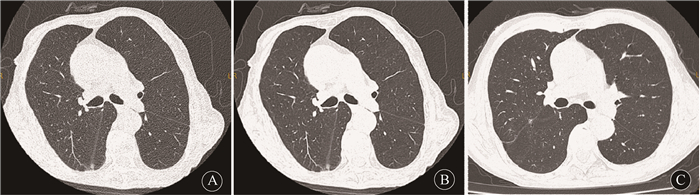
|
A、B.(100 kV,39 mAs)低剂量组图像,分别采用IR及AI重建算法,图像噪声分别为155.1及48.3;C.(120 kV,96 mAs)常规剂量扫描及IR重建图像,图像噪声为119.3 图 1 A1组、A2组及B组的胸部CT图像对比 A1, A2 and B A, B. (100 kV, 39 mAs) The images of low dose groups which were reconstructed by iterative algorithm and AI optimization respectively, and the SD were 155.1 and 48.3, respectively; C. A standard dose scanning protocol (120 kV, 96 mAs) and iterative reconstruction, and the image SD was 119.3 Figure 1 Comparison of chest CT images of groups |
图像主观评价结果显示两名医师对A1组、A2组及B组图像主观评分的一致性良好。两位医师图像噪声主观评价Kappa值分别为0.94、0.89、0.90,组织结构(血管及支气管)的显示主观评价Kappa值分别为0.90、0.87、0.94。两名医师对A2组与A1组的主观评分比较结果在图像噪声(χ2=28.31、29.02,P < 0.001)及组织结构显示(χ2=18.95、13.09,P < 0.001)中差异均具有统计学意义(见表 2,图 2)。A2组与B组图像噪声的主观评分差异无统计学意义,而肺内组织结构显示的主观评分差异有统计学意义(χ2=4.96、7.04,P < 0.05),B组图像的肺内组织的显示情况优于A2组图像(表 2)。
|
|
表 2 3组图像质量主观评分比较(x±s) Table 2 Comparison of subjective scores of the images in groups A1, A2 and B(x±s) |
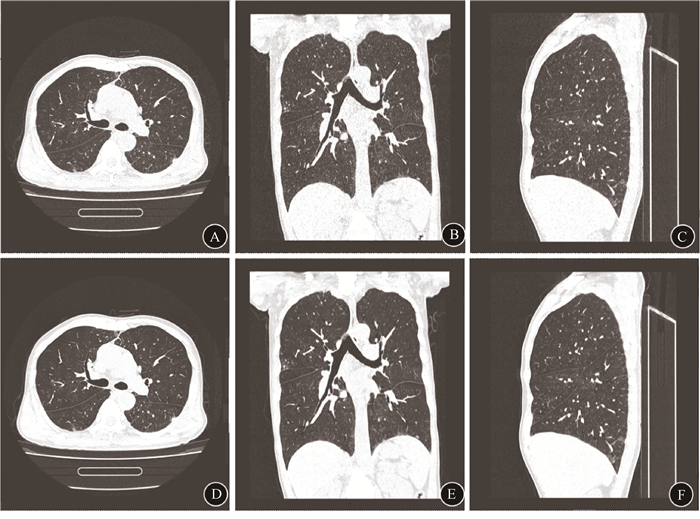
|
A~C.50% ClearView迭代重建的MPR图像;D~F.50% ClearView迭代重建基础上应用AI优化的MPR图像 图 2 AI优化前后的胸部MPR图像对比 A-C. MPR images underwent 50% ClearView iterative algorithm; D-F. MPR images reconstructed by 50% ClearView iterative reconstruction and AI techniques Figure 2 Comparison of chest MPR images before and after AI optimization |
3.辐射剂量比较:低剂量组(A组)在各辐射剂量指标上均显著低于常规剂量组(B组),电流、CTDIvol、DLP及E的比较差异均具有统计学意义(Z=-6.78、-7.70、-7.69、-7.69,P < 0.001,见表 3。与B组相比,A组有效辐射剂量E降低约72.1%。
|
|
表 3 两组辐射剂量指标的比较(x±s) Table 3 Comparison of radiation dose between groups A and B(x±s) |
3、讨论
CT图像质量是影响诊断准确性的重要因素之一,增加CT辐射剂量能够提高图像质量,但由此引发的电离辐射安全问题同样需要重视,为此,低剂量CT扫描得到学术界的普遍认可[3]。而如何平衡CT辐射剂量与图像质量的关系,仍是临床研究的重点[12]。本研究利用AI图像优化技术,对IR重建的低剂量CT图像进行再次优化,并将优化后的图像与常规剂量CT图像进行对比。结果显示,经AI优化后的低剂量IR组,其图像质量的客观及主观评价指标均能达到常规剂量CT图像的标准,实现了降低辐射剂量的同时,图像质量不受影响。
近年来,IR重建技术已被证实能够有效减小图像的噪声及伪影情况,提高低剂量CT扫描的图像质量[13]。但有研究显示,通过IR技术提高CT图像质量的程度有限,在SD降低50%或CNR提高100%后,IR技术提高图像质量的能力有所下降[14]。而过度提高IR权重可能会使CT图像出现过于平滑等伪自然现象,存在细节丢失的风险[13]。随着AI技术的发展,基于深度学习重建(deep learning reconstruction, DLR)算法的低剂量CT图像优化技术已成为当下研究的热点[15]。Wang等[6]研究采用AI算法进一步优化50% IR重建的低剂量主动脉CTA图像,并将其与常规剂量图像对比;研究显示,AI图像优化技术可显著提高图像质量。Akagi等[8]对比了DLR及两种IR算法对腹部CT图像质量的提升效果,结果显示,经DLR重建图像的整体质量优于其余两组IR图像。可见,AI技术相较于IR,在CT图像质量的提升方面存在更大潜力。
本研究中的AI图像优化技术应用DLR算法对胸部CT图像进行处理,其原理是将高噪声图像作为神经网络的输入,以低噪声或无噪声图像作为目标,利用神经网络对图像中的噪声分布进行训练,并将训练所得模型作用于后续图像的噪声识别及分离,从而对CT图像精准降噪优化。因此,应用该方式的图像优化技术可以极大地保留CT图像的细节。此外,本研究中AI算法的开发以真实CT图像作为训练集,能够直接应用于CT图像重建的流程中,可在迭代重建的基础上进一步修正图像噪声情况。本研究结果显示,在50% ClearView迭代重建的基础上应用AI图像优化技术,使得低剂量CT图像的SD进一步降低,SNR及CNR提高,且SD、SNR、CNR等客观指标仍优于常规剂量图像。本研究以50%作为最佳IR挡位,主要参考了此前的相关研究[6, 14]。
Greffier等[16]采用体模实验的方式,在获得基本相同质量CT图像的情况下,相比于50%权重的IR,AI技术可减少56%的辐射剂量。本试验根据以往研究中的低剂量及常规剂量标准(低剂量1~2 mSv、常规剂量5~7 mSv)[7],设置了低剂量组及常规剂量组。结果显示,低剂量组相较于常规剂量组辐射剂量降低约72.1%,而低剂量AI组与常规剂量组相比,图像整体噪声的主观评分差异无统计学意义,虽然其肺内组织结构显示的主观评分较常规剂量组偏低,但仍优于低剂量迭代组。可见,AI图像优化技术在低剂量胸部CT检查中存在潜力,仍具有应用更低剂量扫描的可能。
本研究的局限性在于:①入组患者的BMI普遍偏大,未考虑个体差异对CT图像质量的影响。②仅选择一组低剂量扫描方案,没有对更低剂量扫描方案进行尝试。③图像主观评价只考虑图像整体的细节显示及噪声情况,未区分阴性及阳性病例,未对疾病进行分类。④由于AI技术的应用效果与其开发过程中输入的训练数据特征直接相关,AI算法的使用需要匹配其训练数据的解剖部位才能保证其优化效果,因此,其泛化能力较弱,本研究所用的胸部AI算法仅在应用于胸部CT图像的优化时才能发挥最大能效,因此,本试验也仅能验证其在胸部图像的优化效果。以上内容将在今后的研究中进一步探讨。
综上所述,AI成像优化技术可进一步降低迭代重建的低剂量CT图像的噪声、提高其信噪比及对比噪声比,且对图像细节保留良好。因此,人工智能成像优化技术可为低剂量胸部CT图像质量的改善提供更多可能。
利益冲突 本研究具有独立性与科学性,研究设计、收集、分析和文章撰写均由本文的共同作者完成,共同作者间无利益冲突关系。本研究与商业机构间无财务往来
作者贡献声明 张磊负责设计研究方案,撰写论文;时洪坤负责图像采集;董书杉协助图像分析及撰写论文;朱万安负责写作指导及对文章内容作批评性审阅
| [1] |
National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409. DOI:10.1056/NEJMoa1102873 |
| [2] |
Moos SI, van Vemde DNH, Stoker J, et al. Contrast induced nephropathy in patients undergoing intravenous (IV) contrast enhanced computed tomography (CECT) and the relationship with risk factors:a meta-analysis[J]. Eur J Radiol, 2013, 82(9): e387-399. DOI:10.1016/j.ejrad.2013.04.029 |
| [3] |
刘士远, 于红. 积极推进胸部低剂量CT扫描的临床应用[J]. 中华放射学杂志, 2010, 44(1): 6-7. Liu SY, Yu H. Actively promote the clinical applications of low-dose chest CT scans[J]. Chin J Radiol, 2010, 44(1): 6-7. DOI:10.3760/cma.j.issn.1005-1201.2010.01.002 |
| [4] |
Prakash P, Kalra MK, Ackman JB, et al. Diffuse lung disease:CT of the chest with adaptive statistical iterative reconstruction technique[J]. Radiology, 2010, 256(1): 261-269. DOI:10.1148/radiol.10091487 |
| [5] |
Christe A, Charimo-Torrente J, Roychoudhury K, et al. Accuracy of low-dose computed tomography (CT) for detecting and characterizing the most common CT patterns of pul-monary disease[J]. Eur J Radiol, 2013, 82(3): e142-e150. DOI:10.1016/j.ejrad.2012.09.025 |
| [6] |
Wang Y, Yu M, Wang M, et al. Application of artificial intelligence-based image optimization for computed tomography angiography of the aorta with low tube voltage and reduced contrast medium volume[J]. J Thoracic Imaging, 2019, 34(6): 393-399. DOI:10.1097/RTI.0000000000000438 |
| [7] |
Kanii Y, Ichikawa Y, Nakayama R, et al. Usefulness of dictionary learning based processing for improving image quality of sub millisievert low dose chest CT:initial experience[J]. Jpn J Radiol, 2020, 38(3): 215-221. DOI:10.1007/s11604-019-00912-5 |
| [8] |
Akagi M, Nakamura Y, Higaki T, et al. Deep learning reconstruction improves image quality of abdominal ultra-high-resolution CT[J]. Eur J Radiol, 2019, 29(11): 6163-6171. DOI:10.1007/s00330-019-06170-3 |
| [9] |
Xin X, Shen J, Yang S, et al. Improved image quality of low-dose CT combining with iterative model reconstruction algorithm for response assessment in patients after treatment of malignant tumor[J]. Quant Imaging Med Surg, 2018, 8(7): 648-657. DOI:10.21037/qims.2018.08.05 |
| [10] |
Phelps AS, Naeger DM, Courtier JL, et al. Pairwise comparison versus likert scale for biomedical image assessment[J]. AJR Am J Roentgenol, 2015, 204(1): 8-14. DOI:10.2214/AJR.14.13022 |
| [11] |
Hata A, Yanagawa M, Honda O, et al. Ultra-low-dose chest computed tomography for interstitial lung disease using model-based iterative reconstruction with or without the lung setting[J]. Medicine(Baltimore), 2019, 98(22): e15936. DOI:10.1097/MD.0000000000015936 |
| [12] |
中华医学会放射学分会质量管理与安全管理学组. CT辐射剂量诊断参考水平专家共识[J]. 中华放射学杂志, 2017, 51(11): 817-822. Quality Management and Safety Management Group, Radiology Branch, Chinese Medical Association. Expert consensus on reference level of CT radiation dose diagnosis[J]. Chin J Radiol, 2017, 51(11): 817-822. DOI:10.3760/cma.j.issn.1005-1201.2017.11.001 |
| [13] |
Geyer LL, Schoepf UJ, Meinel FG, et al. State of the art:Iterative CT reconstruction techniques[J]. Radiology, 2015, 276(2): 339-357. DOI:10.1148/radiol.2015132766 |
| [14] |
Barca P, Giannelli M, Fantacci ME, et al. Computed tomography imaging with the adaptive statistical iterative reconstruction (ASIR) algorithm:dependence of image quality on the blending level of reconstruction[J]. Australas Phys Eng Sci Med, 2018, 41(2): 463-473. DOI:10.1007/s13246-018-0645-8 |
| [15] |
Chen H, Zhang Y, Zhang W, et al. Low-dose CT via convolutional neural network[J]. Biomed Opt Express, 2017, 8(2): 679-694. DOI:10.1364/BOE.8.000679 |
| [16] |
Greffier J, Hamard A, Pereira F, et al. Image quality and dose reduction opportunity of deep learning image reconstruction algorithm for CT:a phantom study[J]. Eur Radiol, 2020, 30(7): 3951-3959. DOI:10.1007/s00330-020-06724-w |
 2020, Vol. 40
2020, Vol. 40


