宫颈癌是我国最常见的女性生殖道恶性肿瘤。作为宫颈癌的一种独特病理类型,宫颈小细胞神经内分泌癌(small cell neuroendocrine carcinoma of the cervix,SCNEC)来源于神经内分泌细胞[1],具有发病率低、侵袭性强及预后差的特点[2-4]。由于SCNEC仅占所有宫颈癌病例不足3%[2-5],因此关于SCNEC的文献报道较少,且多为临床病例报告或小样本回顾性分析,缺乏前瞻性病例对照研究,目前SCNEC患者的标准治疗方案和预后危险因素并未达成共识[6]。虽然已有宫颈癌临床治疗指南和大量研究文献可供参考,但临床证明宫颈癌常见病理类型(鳞癌和腺癌)的治疗方案及预后因素并不完全适用于SCNEC这种罕见的病理类型,据Zhou等[7]报道,SCNEC患者5年生存率远远低于宫颈鳞癌患者(29.4% vs.74.1%)。SEER数据库是美国癌症数据的权威来源,它基于人群收集并发布癌症患者的重要临床资料,覆盖28%的美国人口。本研究利用SEER数据库,探讨术后辅助放疗对不同国际妇产联盟(Federation International of Gynecology and Obstetrics,FIGO)分期SCNEC患者生存的影响及预后因素分析,以期为SCNEC临床治疗提供参考。
资料与方法1.数据来源:利用SEER Stat软件(8.3.6版本)获取2004—2016年确诊为宫颈小细胞神经内分泌癌的病例,并根据以下纳入与排除标准筛选出269例患者作为研究对象。纳入标准:根据国际肿瘤学疾病分类第3版(ICD-O-3),小细胞癌组织学代码为8041/3和8045/3;已行化疗;具有完整的随访数据。排除标准:非第一原发肿瘤;手术数据不详;放疗数据不详;随访数据不完整。其中,SEER数据库虽然登记了患者是否接受化疗和术后辅助放疗的信息,但并未指明具体的化疗方案(如新辅助化疗、术后辅助化疗或同步放化疗)和放疗的准确剂量。
2.患者分组:本研究纳入269例接受化疗的SCNEC患者, 其中早期(Ⅰ~ⅡA)72例,中晚期(ⅡB~Ⅳ)197例。根据不同的治疗方案将患者分为4组:化疗+术后放疗组、化疗+手术组、化疗+放疗组及单纯化疗组。按年龄(≤60岁和>60岁)、种族(白种人、黑种人和其他)、婚姻状况(已婚、未婚和不详)、病理(单纯型和混合型)、肿瘤大小(﹤4 cm和≥4 cm)、淋巴结转移(阳性、阴性和不详)和肿瘤分期(Ⅰ~ⅡA和ⅡB~Ⅳ)进行纵向分类,并计算绝对数值及所占比例,同时比较这些要素在4个治疗方案组中的分布情况, 比较Ⅰ~ⅡA期和和ⅡB~Ⅳ期患者在4种治疗方案下的总生存情况。
3.统计学处理:利用SPSS 23.0软件对所有数据进行统计学分析。采用χ2检验比较4组数据分布的差异,采用Kaplan-Meier曲线获取不同国际妇产联盟(FIGO)分期(2009版) SCNEC患者的总生存(overall survival, OS)信息,采用Log-rank检验及Cox回归分析评估不同变量对SCNEC患者预后的影响。多变量Cox分析中使用简化模型,仅对单变量Cox分析中预后显著相关的变量进行分析。P < 0.05为差异有统计学意义。
结果1.患者总体特征:269例SCNEC患者中,69例(25.7%)接受化疗联合术后辅助放疗,46例(17.1%)接受化疗联合手术,109例(40.5%)接受化疗联合放疗,45例(16.7%)接受单纯化疗。变量具体分布情况,详见表 1。中位随访时间为59个月(0~150个月),5年OS率为25.5%,中位OS期为21个月。确诊时的中位年龄为45岁(21~85岁)。在化疗联合术后辅助放疗的患者中,肿瘤直径≥4 cm者38例(55.1%),发生淋巴结转移者36例(52.2%),ⅡB~Ⅳ期患者38例(55.1%),这3个因素的分布差异均达到显著水平(χ2=35.624、22.723、26.457, P<0.001)。
|
|
表 1 269例宫颈小细胞神经内分泌癌患者临床资料 Table 1 Characteristics of 269 patients with SCNEC |
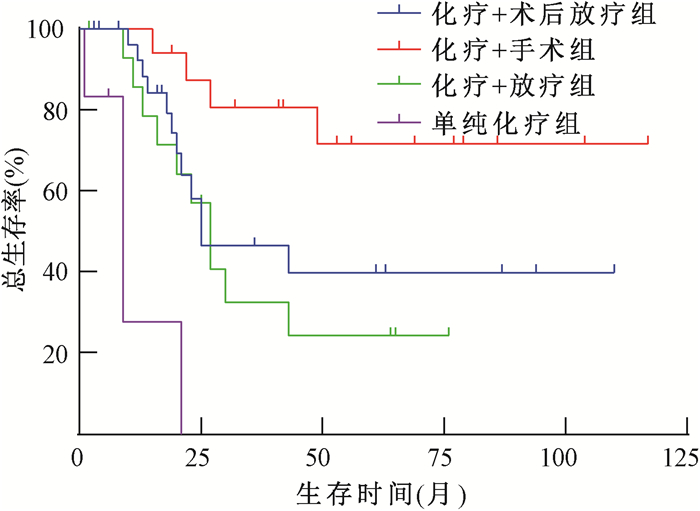
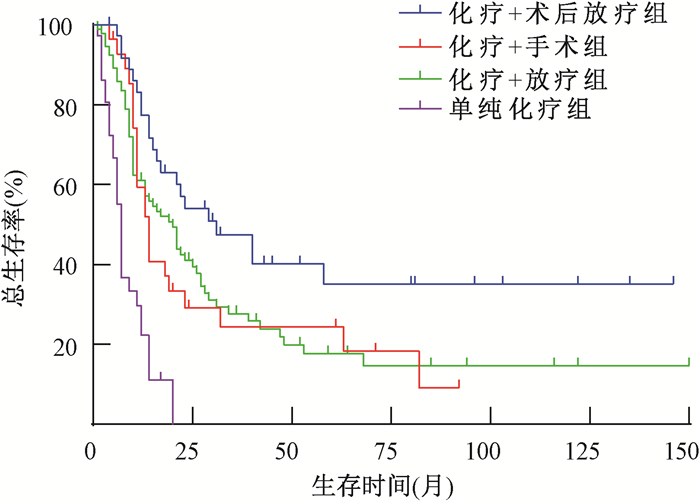
2.化疗联合术后辅助放疗对早期和中晚期患者生存的影响:对于Ⅰ~ⅡA期患者,化疗+术后放疗组、化疗+手术组、化疗+放疗组及单纯化疗组5年OS率分别为39.9%、71.7%、24.5%和0(图 1),化疗+术后放疗组的生存优势与化疗+放疗组相当(P>0.05),低于化疗+手术组(χ2=4.384, P=0.036),且远高于单纯化疗组(χ2=16.811, P<0.001)。对于ⅡB~Ⅳ期患者,化疗+术后放疗组、化疗+手术组、化疗+放疗组及单纯化疗组5年OS率分别为35.2%、24.3%、17.7%和0(图 2),与化疗+手术组、化疗+放疗组及单纯化疗组相比,化疗+术后放疗组最有生存优势(χ2=4.578、5.181、34.951, P<0.05)。
|
注:化疗+手术组、单纯化疗组分别与化疗+术后放疗组比较,χ2=4.384、16.811, P<0.05 图 1 Ⅰ~ⅡA期宫颈小细胞神经内分泌癌4种治疗方案的总生存比较 Figure 1 Comparison of OS among four treatment regimens for SCNEC patients with stage Ⅰ-ⅡA |
|
注:化疗+手术组、化疗+放疗组、单纯化疗组分别与化疗+术后放疗组比较,χ2=4.578、5.181、34.951, P<0.05 图 2 ⅡB~Ⅳ期宫颈小细胞神经内分泌癌4种治疗方案的总生存率比较 Figure 2 Comparison of OS among four treatment regimens for SCNEC patients with stage ⅡB-Ⅳ |
3.Cox回归分析:首先分别对年龄、种族、婚姻状况、病理、肿瘤大小、淋巴结转移和肿瘤分期进行单因素分析,结果显示年龄、肿瘤大小和治疗方案会对Ⅰ~ⅡA期和ⅡB~Ⅳ期SCNEC患者的OS产生显著影响(表 2)。然后对这3个变量进行Cox多因素分析,结果显示年龄、肿瘤大小和治疗方案是Ⅰ~ⅡA期和ⅡB~Ⅳ期SCNEC患者的预后独立危险因素(表 3)。对于Ⅰ~ⅡA期和ⅡB~Ⅳ期患者,年龄>60岁患者的死亡风险分别是年龄≤60岁患者的7.868和1.465倍(HR 7.868, 95% CI: 3.032~20.415; HR 1.465, 95% CI: 1.006~2.435, P<0.05),肿瘤直径≥4 cm患者的死亡风险分别是肿瘤直径﹤4 cm患者的2.576和1.965倍(HR 2.576, 95% CI: 1.056~6.287; HR 1.965, 95% CI: 1.026~3.766, P<0.05)。另外,Cox回归分析结果显示选择不同的治疗方案会显著影响SCNEC患者的预后。对于Ⅰ~ⅡA期患者,接受化疗联合手术的患者预后最好,其死亡风险仅是化疗联合术后辅助放疗患者的0.403倍(HR 0.403, 95% CI: 0.112~1.112, P=0.047)。对于ⅡB~Ⅳ期患者,接受化疗联合术后辅助放疗的患者预后最好,化疗联合手术、化疗联合放疗及单纯化疗的死亡风险分别是化疗联合术后辅助放疗的1.726倍、1.605倍和5.632倍(HR 1.726, 95% CI: 0.944~3.157; HR 1.605, 95% CI: 0.968~2.661; HR 5.632, 95% CI: 3.143~10.093, P<0.05)。
|
|
表 2 Ⅰ~ⅡA期和ⅡB~Ⅳ期宫颈小细胞神经内分泌癌患者总生存的单因素分析 Table 2 Univariate analysis of OS for SCNEC patients with stage Ⅰ-ⅡA and ⅡB-Ⅳ |
|
|
表 3 Ⅰ~ⅡA期和ⅡB~Ⅳ期宫颈小细胞神经内分泌癌患者总生存的多因素分析 Table 3 Multivariate analysis of OS for SCNEC patients with stage Ⅰ-ⅡA and ⅡB-Ⅳ |
讨论
SCNEC年平均发病率仅为0.06×10-5[8],极易发生淋巴结转移和远处转移,复发率和死亡率较高[9],即使是早期患者预后也不理想[10-11],至今仍缺乏标准的治疗方案,预后影响因素也未达成共识。大多数学者认为,根据SCNEC侵袭性强和易转移的特点,各期患者均应给予全身化疗[6]。本研究对SEER数据库中269例接受化疗的SCNEC患者进行回顾性分析,发现化疗联合术后辅助放疗并未对早期(Ⅰ~ⅡA)患者产生存获益, 但可显著改善中晚期(ⅡB~Ⅳ)患者的OS,年龄、肿瘤大小和治疗方案是影响其预后的独立危险因素。
对于早期SCNEC患者,治疗原则上应以根治性手术和化疗为主,至于是否需要辅助术后放疗尚存争议。Chen等[8]和Lee等[9]报道即使对于早期SCNEC患者,也应考虑术后常规行辅助放疗。而Gardner等[12]认为早期SCNEC患者行根治性手术后仅行化疗即可,不应辅助放疗。本研究结果显示,化疗联合术后辅助放疗并未显著改善早期(Ⅰ~ⅡA)SCNEC患者的OS,反而是化疗联合手术的治疗方式能对早期患者产生明显的生存获益,这个结论与Gardner等[12]的观点一致。对于中晚期SCNEC患者,由于局部肿瘤较大和期别较晚的问题会对手术治疗造成很大的困难,治疗上应以化疗和放疗为主,但根据SEER数据库得到的患者信息,在ⅡB期以上的宫颈小细胞神经内分泌癌患者中,接受手术治疗者占比达25%以上,这可能是新辅助放疗的广泛应用为中晚期患者带来了手术机会。因此有学者建议,对于分期较晚的SCNEC患者,应考虑在新辅助化疗改善局部条件后进行手术治疗,最后根据手术情况,再决定补充辅助放疗或化疗[6]。本研究结果显示,化疗联合术后辅助放疗能显著改善中晚期(ⅡB~Ⅳ)SCNEC患者的OS,因此对于期别较晚的患者,综合治疗的地位显得更为重要,新辅助化疗可为患者争取手术机会,术后辅助放疗可提高局部控制率,化疗可降低远处转移率,从而达到延长生命、提高生活质量的目的。另外,Xie等[13]认为术后辅助放疗仅对混合病理组织患者的预后有改善作用,但在本研究过程中并未观察到这种结果。至于具有预后不良因素的SCNEC患者是否需要术后辅助放疗,未来还需更多研究提供临床证据。还有学者则认为术后辅助放疗不是SCNEC患者的预后影响因素[14-15]。这些研究中所纳入的SCNEC病例样本数较少,肿瘤分期不尽相同,是否联合化疗也存在差别,这在很大程度上会影响研究结果。
SCNEC患者的预后影响因素仍缺乏共识,目前大多研究报道参考宫颈鳞癌、腺癌的危险因素作为辅助治疗指征。Intaraphet等[10]报道,年龄>60岁既是早期也是晚期患者的预后影响因素(HR4.9, P=0.007; HR9.9, P<0.001),与本研究结果完全一致。另外,还有周莎莎[16]认为年龄不是SCNEC的独立预后因素,但这个结论是把患者年龄分为≤42岁和>42岁比较得到的。
据现有文献报道,肿瘤大小对预后的影响仍未有统一的观点。Liao等[17]对293例SCNEC患者行COX多因素分析,结果显示肿瘤直径是影响SCNEC预后的独立危险因素(HR2.37, P=0.006)。而Zhou等[7]报道,肿瘤直径<4 cm的患者和肿瘤直径≥4 cm的患者之间5年生存率并无差异。而本研究结果认为肿瘤大小是SCNEC患者的预后独立危险因素,与Liao等[17]观点一致。
淋巴结转移是宫颈鳞癌及腺癌预后的独立危险因素,但是否能影响SCNEC患者的预后,目前的研究结论仍有很大差异。Wang等[18]报道的94例患者中,盆腔淋巴结转移组和无淋巴结转移组的5年OS有明显差异(52.9%vs. 28.7%, P=0.0001)。而Roy等[19]认为淋巴结转移并未显著影响患者长期生存(P=0.06);Lee等[20]对68例SCNEC患者进行预后分析发现淋巴结转移不是SCNEC患者的预后影响因素。本研究结果与Roy等[19]和Lee等[20]的观点相符。另外,Huang等[21]认为肿瘤病理成分(单纯型或混合型)对SCNEC患者总生存期及复发情况无显著影响,本研究结果也并未发现病理成分对SCNEC患者产生预后影响。
SCNEC发病率很低,单中心研究难以积累足够数量的临床病例。因此,本研究使用了一个以人群为基础的大型癌症患者登记系统——SEER数据库,以便更有效地评估术后辅助放疗对SCNEC患者预后的影响。虽然本研究纳入的SCNEC病例数量远大于以往的文献报道,但应当承认其中仍存在着一些局限性:①本研究仅纳入随访信息完整的患者进行回顾性研究,可能存在选择偏倚。②SEER数据库缺乏缺少局部控制和复发进展信息,因此本研究仅对患者的总生存率进行分析。③SEER数据库不包含放疗剂量、具体化疗方案等治疗信息,如果以后的研究中能加入这些变量则会对SCNEC治疗方案的选择提供更全面的指导。④SEER数据库提供的是美国人群的信息,本研究结论是否完全符合我国人群尚待进一步研究。
综上所述,化疗联合术后辅助放疗未能改善早期(Ⅰ~ⅡA)SCNEC患者的OS,但可对中晚期(ⅡB~Ⅳ)患者产生显著的生存获益,年龄、肿瘤大小和治疗方案是影响其预后的独立危险因素。化疗联合术后辅助放疗在SCNEC治疗中的作用机制还需前瞻性随机对照研究进一步提供临床证据。
利益冲突 全体作者声明本文不存在任何利益冲突,进行该研究未接受任何不正当职务及财务获益,并对本研究的独立性和科学性予以保证
作者贡献声明 李良负责数据分析、论文撰写;谢家存、王志斌负责病例收集和数据处理;梁恒坡负责数据核对和文献整理;吴广银负责选题设计和论文审核
| [1] |
Gadducci A, Carinelli S, Aletti G. Neuroendrocrine tumors of the uterine cervix:A therapeutic challenge for gynecologic oncologists[J]. Gynecol Oncol, 2017, 144(3): 637-646. DOI:10.106/j.ygyno.2016.12.003 |
| [2] |
Cohen JG, Kapp DS, Shin JY, et al. Small cell carcinoma of thecervix:treatment and survival outcomes of 188 patients[J]. Am J Obstet Gynecol, 2010, 203(4): 341-347. DOI:10.1016/j.ajog.2010.04.019 |
| [3] |
Sodsanrat K, Saeaib N, Liabsuetrakul T. Comparison of clinical manifestations and survival outcomes between neuroendocrine tumor and squamous cell carcinoma of the uterine cervix:Results from a Tertiary Center in Southern Thailand[J]. J Med AssocThai, 2015, 98(8): 725-733. DOI:10.1371/journal.pone.0112184 |
| [4] |
Pei X, Xiang L, Ye S, et al. Cycles of cisplatin and etoposide affect treatment outcomes in patients with FIGO stage Ⅰ-Ⅱ small cell neuroendocrine carcinoma of the cervix[J]. Gynecol Oncol, 2017, 147(3): 589-596. DOI:10.1016/j.ygyno.2017.09.022 |
| [5] |
Margolis B, Tergas AI, Chen L, et al. Natural history and outcome of neuroendocrine carcinoma of the cervix[J]. Gynecol Oncol, 2016, 141(2): 247-254. DOI:10.1016/j.ygyno.2016.02.008 |
| [6] |
刘晨晨, 陈晓斐, 张盈, 等. 宫颈小细胞神经内分泌癌的诊疗进展[J]. 医学综述, 2019, 25(15): 3029-3034. Liu CC, Chen XF, Zhang Y, et al. Progress in diagnosis and treatment of small cell neuroendocrine carcinoma of cervix[J]. Med Recapitulate, 2019, 25(15): 3029-3034. DOI:10.3969/j.issn.1006-2084.2019.15.022 |
| [7] |
Zhou J, Wu SG, Sun JY, et al. Clinicopathological features of small cell carcinoma of the uterine cervix in the surveillance, epidemiology, and end results database[J]. Oncotarget, 2017, 8(25): 40425-40433. DOI:10.18632/oncotarget.16390 |
| [8] |
Chen J, Macdonald OK, Gaffney DK. Incidence, mortality, and prognostic factors of small cell carcinoma of the cervix[J]. Obstet Gynecol, 2008, 111(6): 1394-1402. DOI:10.1097/AOG.0b013e318173570b |
| [9] |
Lee SW, Lim KT, Bae DS, et al. A multicenter study of the importance of systemic chemotherapy for patients with small-cell neuroendocrine carcinoma of the uterine cervix[J]. Gynecol Obstet Invest, 2015, 79(3): 172-178. DOI:10.1159/000367920 |
| [10] |
Intaraphet S, Kasatpibal N, Siriaunkgul S, et al. Prognostic factors for small cell neuroendocrine carcinoma of the uterine cervix:an institutional experience[J]. Int J Gynecol Cancer, 2014, 24(2): 272-279. DOI:10.1097/IGC.0000000000000059 |
| [11] |
Viswanathan AN, Deavers MT, Jhingran A, et al. Small cell neuroendocrine carcinoma of the cervix:Outcome and patterns of recurrence[J]. Gynecol Oncol, 2004, 93(1): 27-33. DOI:10.1016/j.ygyno.2003.12.027 |
| [12] |
Gardner GJ, Reidy-Lagunes D, Gehrig PA. Neuroendocrine tumors of the gynecologic tract:a Society of Gynecologic Oncology (SGO) clinical document[J]. Gynecol Oncol, 2011, 122(1): 190-198. DOI:10.1016/j.ygyno.2011.04.011 |
| [13] |
Xie S, Song L, Yang F, et al. Enhanced efficacy of adjuvant chemotherapy and radiotherapy in selected cases of surgically resected neuroendocrine carcinoma of the uterine cervix:a retrospective cohort study[J]. Medicine (Baltimore), 2017, 96(11): e6361. DOI:10.1097/MD.0000000000006361 |
| [14] |
Xu F, Ma J, Yi H, et al. Clinic opathological aspects of small cell neuroendocrine carcinoma of the uterine cervix:a multicenter retrospective study and meta-analysis[J]. Cell Physiol Biochem, 2018, 50(3): 1113-1122. DOI:10.1159/000494538 |
| [15] |
梁胜砚.宫颈小细胞神经内分泌癌预后因素的分析[D].南宁: 广西医科大学, 2019. Liang SY. Analysis of the prognostic factors for small cell neuroendocrine carcinoma of the uterine cervix[D]. Nanning: Guangxi Medical University, 2019. |
| [16] |
周莎莎.265例宫颈小细胞癌的临床病理因素及预后相关分析[D].武汉: 华中科技大学, 2017. Zhou SS. Analysis of clinicopathologic factors and prognosis of 265 cases of small cell carcinomaof the cervix[D]. Wuhan: Huazhong University of Science and Technology, 2017. |
| [17] |
Liao LM, Zhang X, Ren YF, et al. Chromogranin A (CgA) as poor prognostic factor in patients with small cell carcinoma of the cervix:results of a retrospective study of 293 patients[J]. PLoS One, 2012, 7(4): e33674. DOI:10.1371/journal.pone.0033674 |
| [18] |
Wang KL, Chang TC, Jung SM, et al. Primary treatment and prognostic factors of small cell neuroendocrine carcinoma of the uterine cervix:a Taiwanese Gynecologic Oncology Group study[J]. Eur J Cancer, 2012, 48(10): 1484-1494. DOI:10.1016/j.ejca.2011.12.014 |
| [19] |
Roy S, Ko JJ, Bahl G. Small cell carcinoma of cervix:a population-based study evaluating standardized provincial treatment protocols[J]. Gynecol Oncol Rep, 2019, 27: 54-59. DOI:10.1016/j.gore.2019.01.003 |
| [20] |
Lee JM, Lee KB, Nam JH, et al. Prognostic factors in FIGO stage ⅠB-ⅡA small cell neuroendocrine carcinoma of the uterine cervix treated surgically:results of a multi-center retrospective Korean study[J]. Ann Oncol, 2008, 19(2): 321-326. DOI:10.1093/annonc/mdm465 |
| [21] |
Huang L, Liao LM, Liu AW, et al. Analysis of the impact of platinum-based combination chemotherapy in small cell cervical carcinoma:a multicenter retrospective study in Chinese patients[J]. BMC Cancer, 2014, 14: 140. DOI:10.1186/1471-2407-14-140 |
 2020, Vol. 40
2020, Vol. 40


