2. 苏州大学附属第二医院放射治疗科 215004
2. Department of Radiotherapy&Oncology, Second Affiliated Hospital of Soochow University, Suzhou 215004, China
放疗技术的飞速发展使得放疗后脑肿瘤患者的总体生存期显著延长。但放疗带来的放射性脑损伤却因严重降低患者治疗后的生存质量而受到越来越多的关注。研究发现电离辐射对神经发生(neurogenesis)的抑制在放射性认知障碍的发生中发挥着重要作用[1]。神经发生是神经干/前体细胞分化成神经元,神经元与神经元之间建立突触联系,构成海马网络处理系统产生神经功能的过程,此过程可持续终生[2]。研究发现,电离辐射可以抑制神经发生[3]。电离辐射可直接损伤神经干细胞(neural stem cells, NSCs),降低其增殖和分化能力,并且神经干/祖细胞存在于包含多种类型细胞的微环境中,易受微环境中其他细胞的影响,如受照肿瘤细胞可通过旁效应导致NSCs凋亡[4]。电离辐射诱导的旁效应(radiation-induced bystander effects, RIBEs)是指未受照细胞接收到受照射细胞传递的分子信号后,产生DNA损伤、基因表达改变、炎症反应、细胞死亡等生物学变化的现象[5-8]。目前,旁效应在放射性认知障碍的发生中是否发挥作用尚不清楚。因此,本研究采用共培养模型在体外探究受照脑胶质瘤细胞对未受照神经干细胞的影响。
材料与方法1.主要试剂与仪器:U251胶质瘤细胞购于中国科学院细胞库,原代神经干细胞(NSCs)取自孕12.5 d的C57 BL/6胎鼠;DMEM高糖培养基、DMEM/F12培养基、Retinoic acid购于美国Sigma-Aldrich公司;胎牛血清(FBS)购于美国Hyclone公司;青霉素-链霉素、胰蛋白酶细胞消化液、DMSO、Forskolin(腺苷酸环化酶激活剂)、DAPI染色液、Nestin抗体(小鼠单抗)、Neuronal Class Ⅲ β-Tubulin(Tuj1)抗体(小鼠单抗)、Poly-D-lysine溶液均购于上海碧云天生物技术研究所;Anti-GFAP抗体购于英国Abcam公司;B27细胞培养添加物、Accutase enzyme购于美国GIBCO公司;Recombinant Human EGF Protein购于美国R&D公司。采用扫描型激光共聚焦显微镜(日本Olympus FV1200)观察免疫荧光标记的细胞。
2.实验分组:将细胞分为NSCs组(单独培养48 h的NSCs)、NSCs+U251组(与U251共培养的NSCs)、NSCs+受照U251组(与10 Gy X射线照射后的U251共培养的NSCs)。
3.小鼠神经干细胞的提取与培养:在预冷的磷酸盐缓冲液(PBS)中分离出孕鼠胚胎大脑皮层,在完全培养基(含2% B27、20 ng/ml碱性成纤维细胞生长因子、20 ng/ml表皮生长因子和1%青霉素-链霉素的DMEM/F12培养基)中剪碎组织,1000 r/min,离心半径1.28 cm,离心5 min后加入胰蛋白酶消化液(Accutase enzyme)混匀,37℃恒温培养箱孵育10 min,加入完全培养基重悬,使用40 μm的滤膜过滤细胞悬液,计数单细胞个数,以2×105/ml的密度种入低吸附培养瓶内,置于恒温培养箱,72 h后传代,选用第3~6代细胞进行实验。本实验经苏州大学伦理委员会审核批准。
4.照射:细胞采用X射线机(美国RAD Source公司,RS 2000)室温下照射,能量160 kVp,源靶距48 cm,剂量率1.16 Gy/min。鉴于电离辐射旁效应在饱和后不依赖于照射剂量,且U251胶质瘤细胞对X射线较为耐受,故选取临床照射相关剂量10 Gy。
5.建立共培养模型:U251作为辐射信号细胞,NSCs作为未照射旁效应细胞,二者通过Transwell小室共享培养基。将U251细胞接种于含无菌盖玻片的孔板内,贴壁生长24 h,换为新鲜的神经干细胞培养基,使用X射线机照射U251细胞;另计数2×105 NSCs种入低吸附6孔板内,插入共培养小室,将长有U251细胞的玻片挑入小室内,补加新鲜培养基,置于5% CO2、37℃培养箱中培养。
6.细胞计数检测细胞的增殖能力:收集共培养处理后的各组细胞处理制成单细胞悬液,使用Millipore scepter 2.0电子计数枪计数细胞数目。
7. NSCs成球能力的检测:NSCs与U251细胞共培养48 h后,使用Olympus荧光显微镜(IX73)拍摄神经球,每组拍摄>100个神经球。使用Image J测量神经球直径,绘制神经球直径的频数分布图,实验重复3次。
8.免疫荧光染色检测Nestin蛋白的表达:获得共培养处理的各组NSCs单细胞,将其种入带有Poly-D-lysine包被盖玻片的6孔板中,放入培养箱培养;2 h后使用4%多聚甲醛固定,PBS清洗5 min×3次,室温孵育封闭液(含0.1% Triton X-100和5%山羊血清)2 h,4℃孵育一抗(Nestin抗体)过夜,PBS清洗5 min×3次,避光室温孵育二抗[Cy3标记山羊抗小鼠IgG(H+L)]2 h,PBS清洗5 min×3次,使用10 μg/ml DAPI染色液染细胞核后,用PBS漂洗后封片。使用扫描型激光共聚焦显微镜(FV1200,×400)拍摄照片并计数Nestin阳性细胞比例。每组计数>25个视野中的至少300个细胞,实验重复3次。
9.免疫荧光染色检测Tuj1和GFAP蛋白的表达:收集经共培养处理后的各组NSCs单细胞,使用分化培养基[神经元分化培养基含0.5% FBS、1%青霉素-链霉素、2% B27和5 μmol/L Retinoic acid的DMEM/F12;胶质细胞分化培养基含1%FBS、1%青霉素-链霉素、2%B27和5 μmol/L Forskolin的DMEM/F12]重悬细胞,将其种在Poly-D-lysine包被的盖玻片上,放入培养箱中培养,72 h后收取玻片进行细胞固定和免疫荧光染色。使用Neuronal Class Ⅲ β-Tubulin(Tuj1)抗体,Anti-GFAP抗体,使用扫描型激光共聚焦显微镜(FV1200)拍摄照片并分析,每组>25个视野,每组>300个细胞,实验重复3次。
10.统计学处理:采用Origin 8.0统计学软件分析,计量资料符合正态分布,以x±s表示,组间比较采用配对样本t检验。P < 0.05为差异有统计学意义。
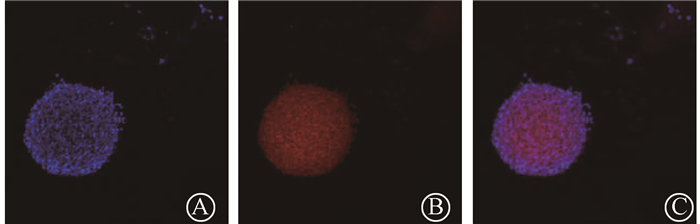
结果1. NSCs的鉴定:分离的NSCs在培养2~3 d后形成神经球悬浮于培养基中,采用免疫荧光染色的方法检测神经球中巢蛋白Nestin的表达以确认分离提取的细胞为神经干细胞。
2.电离辐射对胶质瘤U251细胞的影响:U251细胞接受10 Gy X射线照射后48 h,其细胞数目(32.8±4.6)×104较未受照U251细胞(9.4±1.7)×104降低了71.4%(t=6.40,P < 0.05),表明本研究所用照射条件可显著抑制U251细胞的增殖。
3. NSCs与受照U251细胞共培养48 h后其细胞数目的变化:与NSCs组(61.6±32.0)×104相比,NSCs+受照U251组(45.7±21.9)×104细胞数量下降了25.8%(t=3.80, P < 0.05);与NSCs+U251组(52.3±30.5)×104相比,NSCs+受照U251组细胞数量下降12.6%(t=2.52, P < 0.05),表明肿瘤细胞本身可通过培养基介导的机制抑制NSCs的增殖,而受照肿瘤细胞会进一步增加这种抑制作用。
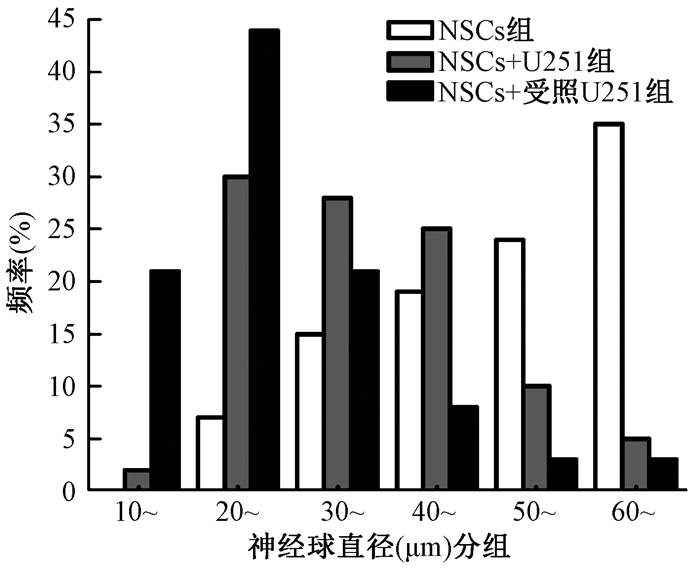
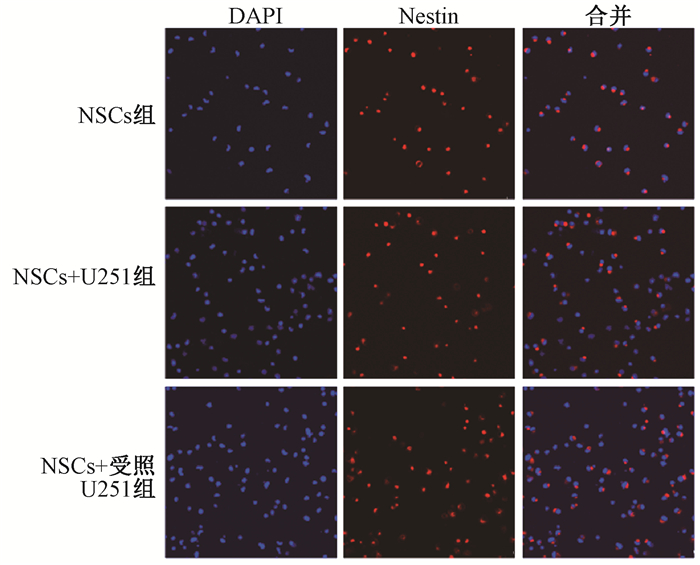
4. NSCs与U251细胞共培养48 h后成球及干性维持情况:如图 2,3所示,相较于单独培养的NSCs,与U251细胞共培养后NSCs形成的神经球直径变小;而与受照U251细胞共培养后NSCs形成的神经球直径进一步变小。各组NSCs的Nestin蛋白表达情况如图 4,与NSCs组(80.8±13.5)%相比,NSCs+受照U251组(69.3±11.9)% Nestin阳性率下降14.2%(t=4.65,P < 0.05);与NSCs+U251组(78.4±13.1)%相比,NSCs+受照U251组Nestin阳性率下降11.6%(t=-3.50,P < 0.05)。以上结果表明,NSCs与U251细胞共培养后成球能力及干性维持能力降低,而与受照U251细胞共培养增强了这种抑制作用。
|
A.DAPI;B.Nestin;C.融合 图 1 对NSCs进行Nestin免疫荧光染色鉴定×200 A.DAPI staining; B. Nestin staining; C. Merged image Figure 1 NSCs were identified by Nestin immunofluorescence staining ×200 |

|
A. NSCs组;B. NSCs+U251组(与U251共培养的NSCs);C. NSCs+U251组(与受照U251共培养的NSCs) 图 2 与U251细胞共培养48 h后各组神经干细胞成球的照片×200 A. NSCs group; B. NSCs co-cultured with 0 Gy irradiated U251 cells; C. NSCs co-cultured with 10 Gy irradiated U251 cells Figure 2 Images of neurospheres formed by NSCs after co-culture with U251 cells for 48 h ×200 |
|
注:NSCs+U251组.与未照射U251共培养的NSCs;NSCs+受照U251组.与10 Gy X射线照射后的U251共培养的NSCs 图 3 与U251细胞共培养48 h后各组神经球直径的变化情况 Figure 3 3 Changes in the diameter of neurospheres formed by NSCs after co-culture with U251 cells for 48 h |
|
注:NSCs+U251组.与未照射U251共培养的NSCs;NSCs+受照U251组.与10 Gy X射线照射后的U251共培养的NSCs 图 4 与U251细胞共培养48 h后各组NSCs的Nestin蛋白表达免疫荧光染色×400 Figure 4 Nestin expression of NSCs after co-culture with U251 cells for 48 h Nestin staining ×400 |
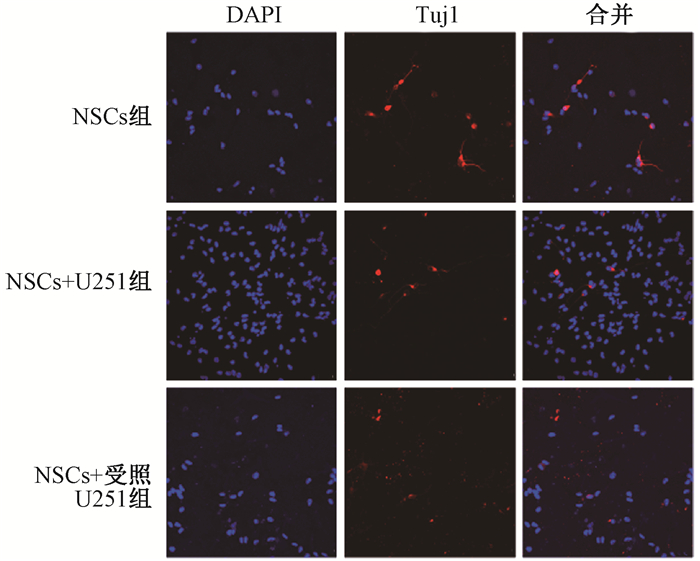
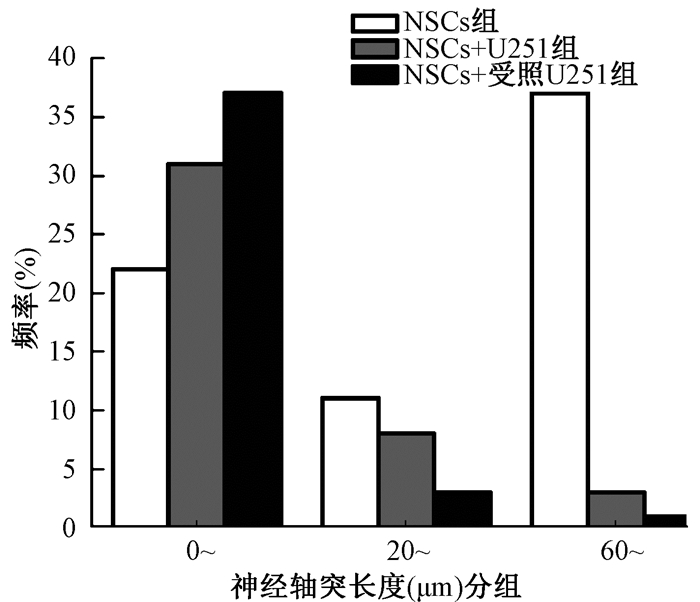
5. NSCs与U251细胞共培养48 h后分化能力的变化:NSCs中Tuj1蛋白的表达情况如图 5和表 1所示,与NSCs组相比,NSCs+U251组和NSCs+受照U251组向神经元分化的阳性率均下降,且NSCs+受照U251组下降显著(t=4.18, P < 0.05);对各组40个神经细胞树突数量计数结果发现,与NSCs组相比,NSCs+受照U251组的神经细胞树突总数目显著下降(t=-4.09, P < 0.05),且与NSCs+U251组相比,NSCs+受照U251组的神经细胞树突总数目亦显著下降(t=10.40, P < 0.05);神经细胞的平均轴突长度结果显示,与NSCs组相比、NSCs+受照U251组的神经细胞平均突触长度显著下降(t=-5.90, P < 0.05),与NSCs+U251组相比,NSCs+受照U251组的神经细胞平均突触长度亦显著下降(t=21.90, P < 0.05)。此外,NSCs组分化的神经元轴突长度峰值在60 μm以上,NSCs+U251组和NSCs+受照U251组分化的神经细胞轴突长度峰值都在0~20 μm之间,但在20~40 μm的区间内,NSCs+U251组的频数值大于NSCs+受照U251组(图 6)。结果表明,与U251细胞共培养后NSCs定向分化为神经元细胞的能力和程度下降,与受照U251细胞共培养的NSCs分化能力和程度下降幅度更大,即受照胶质瘤细胞对神经干细胞向神经元细胞分化有显著抑制作用。
|
注:NSCs+U251组.与未照射U251共培养的NSCs;NSCs+受照U251组.与10 Gy X射线照射后的U251共培养的NSCs组 图 5 与U251细胞共培养48 h后各组NSCs诱导分化为神经元的Tuj1蛋白表达免疫荧光染色×400 Figure 5 Tuj1 expression of NSCs differentiating into neuronal cells in each group after co-culture with U251 cells for 48 h Immunofluorescence staining ×400 |
|
|
表 1 与U251细胞共培养48 h后各组NSCs定向分化为神经元的能力变化情况(x±s) Table 1 Changes in the ability of NSCs to differentiate into neuronal cells after co-culture with U251 cells for 48 h(x±s) |
|
图 6 与U251细胞共培养48 h后各组NSCs分化为神经元后轴突长度的频数变化情况 Figure 6 Changes in neurite length of neuronal cells differentiated from NSCs co-cultured with U251 for 48 h |
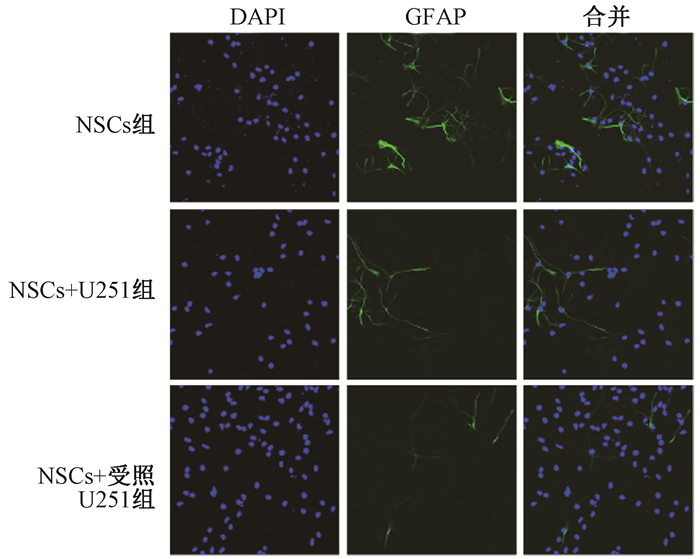
NSCs分化的胶质细胞标志蛋白GFAP表达情况如图 7和表 2,与NSCs组相比、NSCs+受照U251组向胶质细胞分化的阳性率显著下降(t=6.02, P < 0.05), 与NSCs+U251组相比,NSCs+受照U251组胶质细胞分化的阳性率亦显著下降(t=6.09, P < 0.05);计数100个阳性细胞的突起终端个数结果发现,与NSCs组相比,NSCs+受照U251组的胶质细胞突起终端数目下降(t=-5.34, P < 0.05),与NSCs+U251组相比,NSCs+受照U251组的胶质细胞突起终端数目亦显著下降(t=10.09, P < 0.05);此外,测量各组中100个胶质细胞的平均突起长度发现,与NSCs组相比,NSCs+受照U251组的胶质细胞的平均突起长度显著下降(t=-21.52, P < 0.05);与NSCs+U251组相比,NSCs+受照U251组的胶质细胞的平均突起长度也显著下降(t=8.97, P < 0.05)。这些结果表明U251通过细胞间相互作用降低NSCs分化为胶质细胞的能力,而电离辐射进一步增强了这种影响。
|
注:NSCs+U251组.与未照射U251共培养的NSCs;NSCs+受照U251组.与10 Gy X射线照射后的U251共培养的NSCs组 图 7 各组NSCs诱导定向分化为胶质细胞的GFAP蛋白表达免疫荧光染色×400 Figure 7 GFAP expression of NSCs differentiating into glia in each group Immunofluorescence staining ×400 |
|
|
表 2 与U251共培养48 h后,各组NSCs定向分化为胶质细胞的能力变化情况(x±s) Table 2 Changes in the ability of NSCs to differentiate into glia after co-culture with U251 cells for 48 h(x±s) |
讨论
传统放射生物学认为,细胞必须受到直接电离辐射照射才会产生生物学效应。然而,电离辐射诱发的基因组不稳定、适应性反应、旁效应现象等非靶效应的发现挑战了传统放射生物学理论[9-11]。其中,电离辐射旁效应早在1922年就已被发现[12],但直到1992年,Nagasawa和Little[13]用α粒子照射不到1%的细胞,却发现30%的细胞发生了姐妹染色单体互换,明确证实了旁效应的存在后,才引起了极大的关注。然而截至目前,旁效应在放射损伤中究竟发挥何种作用依旧不明确。本研究组之前的研究发现,受照皮肤角质细胞释放的外泌体可抑制小鼠皮肤伤口的愈合[14],提示旁效应可能会贡献于放射性组织损伤。但是,旁效应是否参与放射性认知损害的发生,并不清楚。
随着儿童脑部肿瘤发病率的升高和放疗技术的快速发展,接受放射治疗的患者日益增多且治疗后生存期显著延长,预防放射性认知损害这一放疗不良反应成为当今临床亟待解决的问题之一。近年来,海马功能障碍的机制探究成为放射性认知损害领域的一个研究热点[2, 15]。其中,海马区神经发生抑制,被认为是放射性认知障碍发生的一个关键因素[16]。Mizumatsu等[17]研究发现,单次10 Gy的全脑照射剂量可使海马SGZ区的增殖细胞数下降93%~96%,未成熟神经元数下降40%~60%;Raber等[16]发现,单次10 Gy剂量对小鼠进行全脑照射,小鼠2个月后即发生依赖于海马区变化的学习记忆及认知能力的显著下降。以上研究提示,海马区神经发生的减少在放射性认知能力损害中发挥着重要作用。NSCs的增殖和分化是神经发生的关键过程,易受周围细胞及微环境的影响[18]。颅脑肿瘤患者的放射治疗靶区主要针对肿瘤细胞,但尚不清楚照射后的肿瘤细胞是否会影响NSCs,进而抑制神经发生。
本研究通过共培养胶质瘤细胞与NSCs,观察NSCs的生物学变化,发现受照胶质瘤细胞会影响未受照的NSCs,发生电离辐射诱导的旁效应现象。神经发生的第一步为NSCs的增殖[19-20]。与受照胶质瘤细胞共培养的NSCs数量、成球能力显著下降,提示受照胶质瘤细胞可通过旁效应抑制NSCs的增殖能力。研究发现,干细胞的干性维持能力下降,自我更新速度减慢,其分化能力也随之下降[21-22],新生神经元减少,从而抑制神经发生。而本研究发现NSCs的干性维持能力同样受到受照胶质瘤细胞的抑制,提示辐射诱导的旁效应可以使NSCs的干性维持能力降低。并且,受照胶质瘤细胞使NSCs的分化能力下降,主要表现为向神经细胞及胶质细胞分化的能力和程度均降低。
外泌体首次在绵羊网织红细胞中被发现,广泛的定义为直径为20~200 nm的杯口状囊泡,主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经膜融合的方式释放到细胞外基质中[23]。Al-Mayah等[24]首次发现,外泌体可能是电离辐射旁效应的一种信号传导机制。本课题组前期的研究也发现,受照H460细胞分泌的外泌体能以膜融合的方式进入旁效应细胞内,且增加旁效应细胞的微核形成率[25]。另外,HaCaT细胞分泌的外泌体可以介导电离辐射旁效应,使WS1旁效应细胞内的ROS水平增加、迁移速度减慢[14]。但外泌体是否是本研究所观察到的受照肿瘤细胞在未受照NSCs中诱导旁效应现象的关键信号因子,以及具体的信号分子机制,仍在进一步的探究中。
综上所述,受照胶质瘤细胞可通过电离辐射旁效应对与之共培养的未受照NSCs产生抑制作用,包括对其增殖、干性维持能力和细胞分化能力的抑制。本研究在体外证明电离辐射诱导的旁效应可以抑制神经发生的多个关键过程,提示电离辐射旁效应可能在放射性认知障碍中发挥重要作用。这可能为放射性认知障碍的机制研究提供新的思路。
利益冲突 无
作者贡献声明 杨雪娇完成主要实验,收集数据和撰写论文;施文玉、马佳艳、马琳琳、李梦婷、叶珠静协助部分实验的完成;曹建平和张力元指导实验和论文修改;杨红英设计研究方案、指导实验及论文修改
| [1] |
Greene-Schloesser D, Moore E, Robbins ME. Molecular pathways:radiation-induced cognitive impairment[J]. Clin Cancer Res, 2013, 19(9): 2294-2300. DOI:10.1158/1078-0432.CCR-11-2903 |
| [2] |
Gonçalves JT, Schafer ST, Gage FH. Adult neurogenesis in the hippocampus:from stem cells to behavior[J]. Cell, 2016, 167(4): 897-914. DOI:10.1016/j.cell.2016.10.021 |
| [3] |
Cameron HA, McKay RD. Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus[J]. J Comp Neurol, 2001, 435(4): 406-417. DOI:10.1002/cne.1040 |
| [4] |
Ivanov VN, Hei TK. A role for TRAIL/TRAIL-R2 in radiation-induced apoptosis and radiation-induced bystander response of human neural stem cells[J]. Apoptosis, 2014, 19(3): 399-413. DOI:10.1007/s10495-013-0925-4 |
| [5] |
Zhou H, Randers-Pehrson G, Waldren CA, et al. Induction of a bystander mutagenic effect of α particles in mammalian cells[J]. Proc Natl Acad Sci USA, 2000, 97(5): 2099-2104. DOI:10.1073/pnas.030420797 |
| [6] |
Klammer H, Mladenov E, Li F, et al. Bystander effects as manifestation of intercellular communication of DNA damage and of the cellular oxidative status[J]. Cancer Lett, 2015, 356(1): 58-71. DOI:10.1016/j.canlet.2013.12.017 |
| [7] |
Ponnaiya B, Jenkins-Baker G, Brenner DJ, et al. Biological responses in known bystander cells relative to known microbeam-irradiated cells[J]. Radiat Res, 2004, 162(4): 426-432. DOI:10.1667/rr3236 |
| [8] |
Herok R, Konopacka M, Polanska J, et al. Bystander effects induced by medium from irradiated cells:similar transcriptome responses in irradiated and bystander K562 cells[J]. Int J Radiat Oncol Biol Phys, 2010, 77(1): 244-252. DOI:10.1016/j.ijrobp.2009.11.033 |
| [9] |
Prise KM, Schettino G, Folkard M, et al. New insights on cell death from radiation exposure[J]. Lancet Oncol, 2005, 6(7): 520-528. DOI:10.1016/S1470-2045(05)70246-1 |
| [10] |
Little JB, Lauriston S. Taylor lecture:nontargeted effects of radiation:implications for low-dose exposures[J]. Health Phys, 2006, 91(5): 416-426. DOI:10.1097/01.HP.0000232847.23192.3e |
| [11] |
Morgan WF, Sowa MB. Non-targeted bystander effects induced by ionizing radiation[J]. Mutat Res, 2007, 616(1): 159-164. DOI:10.1016/j.mrfmmm.2006.11.009 |
| [12] |
Al-Mayah AH, Irons SL, Pink RC, et al. Possible role of exosomes containing RNA in mediating nontargeted effect of ionizing radiation[J]. Radiat Res, 2012, 177(5): 539-545. DOI:10.1667/rr2868.1 |
| [13] |
Nagasawa H, Little JB. Induction of sister chromatid exchanges by extremely low doses of alpha-particles[J]. Cancer Res, 1992, 52(22): 6394-6396. DOI:10.1002/1097-0142(19921115)70:10<2576:AID-CNCR2820701029>3.0.CO |
| [14] |
Tan W, Zhang Y, Li M, et al. miR-27a-containing exosomes secreted by irradiated skin keratinocytes delayed the migration of unirradiated skin fibroblasts[J]. Int J Biol Sci, 2019, 15(10): 2240-2255. DOI:10.7150/ijbs.35356 |
| [15] |
Vadodaria KC, Jessberger S. Functional neurogenesis in the adult hippocampus:then and now[J]. Front Neurosci, 2014, 8: 55. DOI:10.3389/fnins.2014.00055 |
| [16] |
Raber J, Rola R, LeFevour A, et al. Radiation-induced cognitive impairments are associated with changes in indicators of hippocampal neurogenesis[J]. Radiat Res, 2004, 162(1): 39-47. DOI:10.1667/rr3206 |
| [17] |
Mizumatsu S, Monje ML, Morhardt DR, et al. Extreme sensitivity of adult neurogenesis to low doses of X-irradiation[J]. Cancer Res, 2003, 63(14): 4021-4027. DOI:10.1016/S0165-4608(03)00013-X |
| [18] |
Shihabuddin LS, Horner PJ, Ray J, et al. Adult spinal cord stem cells generate neurons after transplantation in the adult dentate gyrus[J]. J Neurosci, 2000, 20(23): 8727-8735. DOI:10.1046/j.1365-2826.2000.00585.x |
| [19] |
Le Belle JE, Orozco NM, Paucar AA, et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner[J]. Cell Stem Cell, 2011, 8(1): 59-71. DOI:10.1016/j.stem.2010.11.028 |
| [20] |
Monje ML, Mizumatsu S, Fike JR, et al. Irradiation induces neural precursor-cell dysfunction[J]. Nat Med, 2002, 8(9): 955-962. DOI:10.1038/nm749 |
| [21] |
Mohammad MH, Al-Shammari AM, Al-Juboory AA, et al. Characterization of neural stemness status through the neurogenesis process for bone marrow mesenchymal stem cells[J]. Stem Cells Cloning, 2016, 9: 1-15. DOI:10.2147/SCCAA.S94545 |
| [22] |
Yagi H, Kato K. Functional roles of glycoconjugates in the maintenance of stemness and differentiation process of neural stem cells[J]. Glycoconj J, 2017, 34(6): 757-763. DOI:10.1007/s10719-016-9707-x |
| [23] |
Al-Mayah AH, Irons SL, Pink RC, et al. Possible role of exosomes containing RNA in mediating nontargeted effect of ionizing radiation[J]. Radiat Res, 2012, 177(5): 539-545. DOI:10.1667/rr2868.1 |
| [24] |
Al-Mayah AHJ, Bright SJ, Bowler DA, et al. Exosome-mediated telomere instability in human breast epithelial cancer cells after X irradiation[J]. Radiat Res, 2017, 187(1): 98-106. DOI:10.1667/RR14201.1 |
| [25] |
陈纤, 蒋友芹, 尹晓明, 等. 外泌体——电离辐射诱导旁效应的另一种机制[J]. 辐射研究与辐射工艺学报, 2014, 32(3): 24-30. Chen X, Jiang YQ, Yin XM, et al. Exosomes-another underlying mechanism of radiation-induced bystander effects[J]. J Radiat Res Radiat Proc, 2014, 32(3): 24-30. DOI:10.11889/j.1000-3436.2014.rrj.030203 |
 2020, Vol. 40
2020, Vol. 40


