2. 中国科学院大学附属肿瘤医院 浙江省肿瘤医院病理科, 杭州 310022;
3. 中国科学院大学附属肿瘤医院 浙江省肿瘤医院放疗科, 杭州 310022
2. Department of Pathology, Cancer Hospital of University of Chinese Academy of Sciences, Zhejiang Cancer Hospital, Hangzhou 310022, China;
3. Department of Radiation Oncology, Cancer Hospital of University of Chinese Academy of Sciences, Zhejiang Cancer Hospital, Hangzhou 310022, China
放射性脑损伤是头颈部肿瘤放疗常见的不良反应之一,主要发生机制包括血管内皮损伤[1]、免疫炎症反应[2-3]、神经元直接损伤、神经发生减少以及神经胶质细胞增生[4]。接受放疗后长期存活的患者大部分会发生认知功能的下降,主要表现为海马依赖性学习、记忆和空间信息处理功能的障碍[5]。18F-FDG PET是一种非侵入性功能成像技术,在神经退行性疾病神经元损伤早期伴有轻度认知障碍的患者脑部,即可检测到葡萄糖代谢的减低[6]。本研究通过检测大鼠放射性认知功能障碍模型中神经发生、神经元活性标志物的表达改变,以及大鼠脑部葡萄糖代谢的变化,探讨18F-FDG micro-PET对放射性脑损伤的诊断价值。
材料及方法1.实验动物放射性脑损伤模型的建立:20只SPF级SD大鼠(雄性,3周龄),购于上海斯莱克实验动物有限责任公司[生产许可SCXK(沪)2017-0005]。大鼠饲养于通风良好,相对湿度40%~70%,温度18~25℃,12 h昼夜明暗交替,自由饮水饮食,所有动物实验均获得浙江省肿瘤医院动物伦理委员会批准。将大鼠按照随机数表法分为对照组和全脑照射组,每组10只,全脑照射组应用小动物辐射研究平台(small animal radiation research platform, SARRP)给予单次10 Gy 220 kV X射线照射,每只大鼠采用50 mg/kg剂量的1%浓度戊巴比妥钠腹腔麻醉后俯卧于治疗床,颈部下方放置2 ml注射器针筒,CT模拟定位机扫描定位图片,勾画放疗靶区,包括大鼠全脑,保证后上方斜野照射时整个大鼠脑部包括于照射野内,照射野为10 mm×10 mm,等中心照射,放射源距离中心点100 cm,对照组不予照射(图 1)。
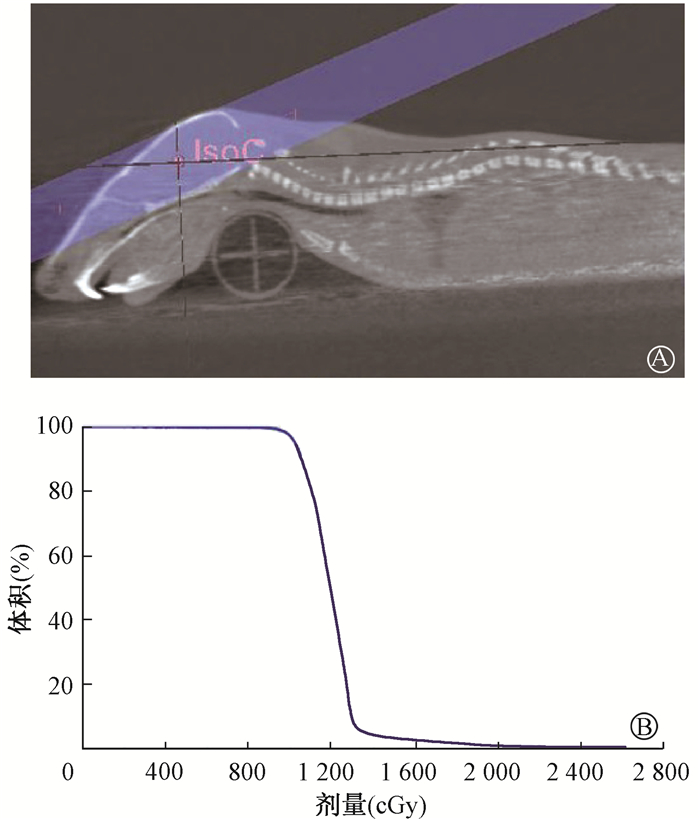
|
A.设野图;B.脑剂量-体积直方图 图 1 SD大鼠10 Gy X射线全脑放疗 A. Radiation field diagram; B. Brain dose-volume histogram (DVH) Figure 1 SD rats exposed to 10 Gy X-ray whole-brain irradiation |
2.Morris水迷宫实验:接受全脑照射后3个月,对两组大鼠进行Morris水迷宫(Morris water maze, MWM)实验。水迷宫实验主要包括两部分:定向航行实验是在实验前4天,每天分别从4个象限的入水点,将大鼠面对水池壁放入水中,利用水迷宫分析仪记录从入水到找到目标象限内隐匿平台的时间,即为潜伏期;空间探索实验是在定向航行实验结束后24 h,撤去目标象限水面下的平台,记录30 s内大鼠在目标象限内游泳的时间占总游泳时间的百分比。
3.18F-FDG micro-PET成像及SPM图像分析:全脑照射后3个月,禁食6 h后给予大鼠腹腔注射约18.5 MBq (0.5 mCi) 18F-FDG,40 min后采用micro-PET R4扫描仪(美国Siemens公司)进行大鼠脑部静态采集20 min,采用OSEM3D/MAP法重建micro-PET数据,将重建后的数据导入计算机,采用统计参数图8.0 (statistical parametric mapping 8.0, SPM8)软件对两组数据进行基于体素水平的图像处理和分析,对转换后的图像进行归一化及平滑处理,有效范围阈值为大于100个像素,并通过族错误率校正(family wise error, FEW)方法校正,最终获得两组间有差异的大脑多层面的投影图。
4.免疫组织化学实验:在Morris水迷宫空间探索实验结束后90 min,采用0.9%生理盐水和4%多聚甲醛对两组大鼠进行心脏灌注,取出大鼠完整脑组织,固定于4%多聚甲醛24 h,石蜡包埋后制作4 μm厚度的脑组织切片,采用大鼠多克隆抗体c-Fos (美国Santa Cruz公司)及适当的二抗孵育切片后行二氨基联苯胺(DAB)法染色。观察切片中出现的棕色颗粒即为高表达的c-Fos蛋白,每个样本染色6张,计算海马区域每张切片200倍视野下出现棕色颗粒的细胞数目的平均值。
5.BrdU标记及免疫荧光染色实验:在预计处死SD大鼠前3周,对SD大鼠连续4 d(2次/d)腹膜注射BrdU(美国Sigma公司),注射剂量为50 mg-1·kg-1·d。采用0.9%生理盐水和4%多聚甲醛对两组大鼠进行心脏灌注,取出大鼠完整脑组织,4%多聚甲醛固定24 h,石蜡包埋后制作成4 μm厚度的脑组织切片,采用大鼠单克隆抗BrdU抗体(美国Abcam公司)、小鼠抗神经元特异性核蛋白(neuron specific nuclear protein, NeuN)抗体(美国Millipore公司)、兔抗双皮质素(doublecortin, DCX)抗体(美国CST公司)及相应的荧光二抗,AlexaFluor® 555标记山羊抗大鼠二抗、AlexaFluor®488标记兔抗小鼠二抗及AlexaFluor®488标记驴抗兔二抗孵育后,采用激光共聚焦显微镜,100倍视野下计数海马齿状回(dentate gyrus, DG)颗粒细胞层及颗粒下层所有DCX阳性的细胞,及BrdU/NeuN双阳性的细胞。每个样本染色6张,计算每张切片海马DG区平均阳性细胞数。
6.统计学处理:18F-FDG micro-PET成像数据通过SPM 8.0软件进行处理分析。两组的脑图像数据采用两独立样本t检验进行组间分析,其他实验数据采用SPSS 17.0软件进行分析,两组数据经正态性检验符合正态分布,以x±s表示,采用独立样本t检验进行比较。P < 0.05为差异有统计学意义。
结果1.大鼠全脑放疗照射野及剂量-体积直方图(dose-volume histogram, DVH):应用CT模拟定位机扫描大鼠摆位后的透视图像,从大鼠后上方设一斜野,中心点位于大鼠脑部中心位置(图 1);剂量-体积直方图表明95%以上的大鼠全脑达到10 Gy X射线照射。照射后的大鼠至少存活3个月,各组大鼠饮食、饮水、体重增长均无明显差异(P>0.05)。
2.大鼠学习记忆能力的改变:对照组大鼠在Morris水迷宫实验过程中的平均游泳速度为(177.5±10.2) mm/s,全脑照射组平均游泳速度为(176.8±6.9) mm/s,差异无统计学意义(P>0.05)。在定向航行实验中,两组大鼠在第1~4天寻找水下隐匿平台的潜伏期均逐渐缩短。对照组1~4 d的潜伏期分别为(42.7±3.4)、(25.0±4.8)、(16.0±4.3)、(13.2±3.5) s,全脑照射组1~4 d的潜伏期分别为(43.9±4.5)、(29.4±4.2)、(22.6±4.5)、(17.9±2.9) s,第2~4天全脑照射组大鼠的潜伏期均明显长于对照组(t=2.179、3.393、3.219, P < 0.05, 表 1);在空间探索测试中,全脑照射组大鼠的目标象限探索时间百分比为27.0%±3.7%,明显少于对照组的36.3%±6.6%(t=3.857, P < 0.01),以上结果表明,全脑照射可以损伤大鼠的学习记忆功能,远期的不良反应主要表现为放射性认知功能障碍。
|
|
表 1 各组大鼠水迷宫定向航行实验潜伏期(s,x±s) Table 1 Latency of each group in MWM place navigation test (s, x±s) |
3.大鼠脑部葡萄糖代谢的变化:全脑照射后3个月,对18F-FDG micro-PET图像进行基于体素的SPM分析显示,与对照组相比,全脑照射大鼠脑内海马18F-FDG的积聚显著减少,差异有统计学意义(t=5.12, P < 0.05, 图 2,3),而其他脑区的葡萄糖代谢并无明显差异(P>0.05)。结果表明,对于照射引起远期脑损伤主要以海马损伤为主。
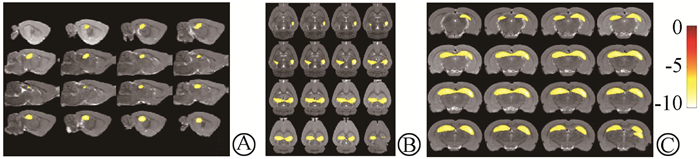
|
A.矢状位;B.冠状位;C.横断位 图 2 18F-FDG micro-PET图像SPM分析显示两组大鼠海马区域葡萄糖代谢的差异 A.Sagittal position; B.Coronal position; C.Transverse position Figure 2 SPM analysis of 18F-FDG micro-PET images to display the difference of glucose metabolism in the hippocampus between two groups |
4.大鼠海马区域c-Fos蛋白表达的差异:照射后3个月,对两组大鼠进行空间探索实验90 min后,免疫组织化学染色结果显示,200倍视野下对照组海马单个视野的c-Fos蛋白阳性表达数为(16.1±1.7)个,全脑照射组单个视野的c-Fos蛋白阳性表达数为(6.8±1.2)个,对照组大鼠海马c-Fos表达明显高于全脑照射组,差异有统计学意义(t=14.22, P < 0.01, 图 3),表明全脑放疗可以导致海马区域神经元活性的下降。
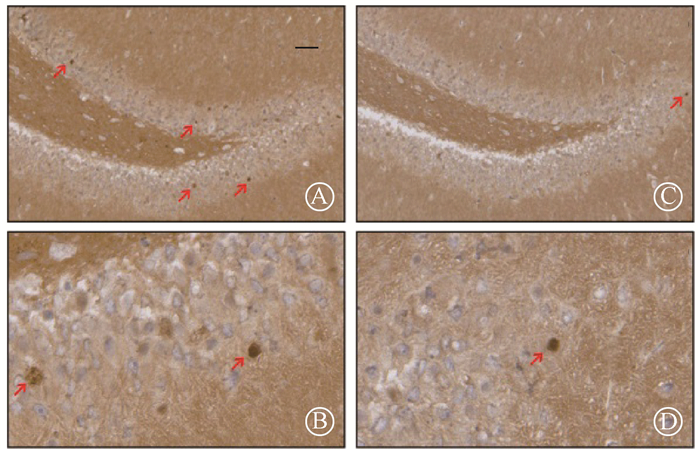
|
A.对照组×100;B.全脑照射组×100;C.对照组×400;D.全脑照射组×400 图 3 两组大鼠神经元活性标志物c-Fos蛋白表达 A. Control group ×100; B. Whole brain irradiated group ×100; C. Control group ×400; D. Whole brain irradiated group ×400 Figure 3 The neuronal active marker c-Fos protein expression of two groups |
5.大鼠海马DG区DCX及BrdU/NeuN阳性表达细胞数的变化:照射后3个月,分别检测两组大鼠海马DG区幼稚神经元标志物DCX及新生成熟神经元标志物BrdU/NeuN阳性表达细胞数,全脑照射组大鼠海马DG区幼稚神经元标志物DCX阳性表达细胞数为(10.8±1.2)个,较对照组的(47.6±6.0)个明显减少(t=18.77, P < 0.01,图 4)。全脑照射组大鼠海马DG区新生成熟神经元标志物BrdU/NeuN阳性细胞数为(2.8±1.2)个,明显少于对照组的(16.6±4.5)个(t=9.304, P < 0.01,图 4)。结果显示,全脑照射可以导致海马DG区幼稚神经元及新生成熟神经元数量的减少,表明全脑照射可以导致海马神经发生减少。
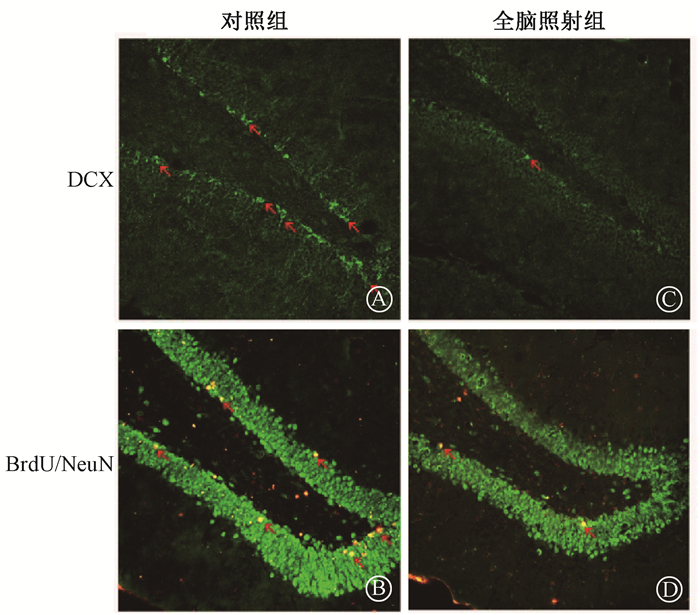
|
图 4 两组大鼠幼稚神经元标志物DCX以及新生成熟神经元标志物BrdU/NeuN的免疫荧光染色结果 Figure 4 The immunofluorescence staining of neuronal precursors marker DCX and newborn mature neurons marker BrdU/NeuN of two groups |
讨论
电离辐射引起的脑损伤按临床发展进程可分为3个阶段:急性期损伤、早期迟发性损伤,以及晚期迟发性损伤。接受脑部放疗后存活6个月以上的患者50%~90%会发生认知功能障碍,这种迟发性的进行性脑损伤是不可逆的,严重影响患者生活质量[7]。
近年来,有研究者发现利用磁共振波谱分析(magnetic resonance spectroscopy, MRS)技术检测到左侧海马N-乙酰天门冬氨酸(N-acetylaspartate, NAA)含量的减低,与全脑放疗患者听觉词语学习测验(auditory verbal learning test, AVLT)中认知功能的下降密切相关[8]。与功能磁共振相比,18F-FDG micro-PET具有可观察脑组织细胞摄取葡萄糖能力及能量代谢活性的优势,在神经系统退行性疾病的诊断中发挥了重要作用,疾病早期即可发现特定脑区葡萄糖代谢的减低,被认为是神经元损伤或变性的生物学标志,并且减低程度与病情发展密切相关,灵敏度高[9]。通过SPM软件分析18F-FDG micro-PET图像数据的技术,近年来已被广泛用于评价人类与啮齿类动物脑部神经元代谢与功能相关性的研究[10-11]。研究表明,患者在接受脑部放疗后中枢神经系统葡糖糖代谢的降低,与处理问题的能力以及认知功能的下降密切相关[12]。本研究结果显示,接受10 Gy X射线照射的大鼠Morris水迷宫实验中空间探索能力以及学习记忆能力均明显下降,而Morris水迷宫任务的迅速完成主要依赖于完整的海马功能。SPM软件分析micro-PET图像结果显示,放射性认知功能障碍大鼠海马区域葡萄糖代谢显著降低。
海马主要与记忆形成、组织和储存密切相关,是认知功能形成的关键结构。海马齿状回的颗粒下区域(subgranular zone, SGZ)和脑室下区域(subventricular zone, SVZ),是脑组织中神经干细胞增殖以及分化形成新生神经元,即神经发生的主要区域,也是对电离辐射最敏感的区域[13]。神经干细胞分化形成新生神经元,进一步介导了海马内,以及海马与其他脑区之间的信息联通[14]。近几十年来,科学家们陆续在各种临床前研究中发现,电离辐射引起的神经认知功能障碍与海马区域神经发生的减少、分化型神经元的损伤以及神经元结构与功能可塑性的丧失密切相关。电离辐射可以引起体外培养的神经干细胞细胞周期进程延迟,增殖能力受阻[15],导致未成熟的神经元神经突起的生长明显受到抑制[16]。动物实验结果表明,电离辐射可以导致大鼠海马区域神经发生减少[17-18],过表达脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的神经干细胞,可以向照射后的大鼠海马颗粒下层区域迁移,进一步分化形成新生神经元,进而改善大鼠认知功能障碍[19]。本研究结果表明,放射性认知功能障碍的大鼠海马区域葡萄糖代谢显著降低,可能与海马区域神经干细胞或神经元损伤、变性,能量代谢与功能障碍密切相关。因此,本研究通过免疫组织学分析大鼠海马区域c-Fos蛋白,DG区幼稚神经元标志物DCX以及新生成熟神经元标志物BrdU/NeuN的表达变化,进一步从病理学角度分析micro-PET用于评估放射性认知功能障碍的潜在机制。
c-fos基因属于即早基因(immediate early genes, IEGs),存在于正常神经元细胞核内,不同类型的刺激,如运动、电刺激,可以迅速诱导c-fos基因表达及c-Fos蛋白合成[20-21]。c-Fos蛋白的表达通常被认为是神经元激活的表现,c-Fos蛋白在学习记忆过程中可以早期、短暂性的表达升高,常被用来评估认知及记忆功能[22]。在本研究中,接受全脑照射的大鼠海马区域的c-Fos蛋白表达量明显低于未照射大鼠,DG区幼稚神经元标志物DCX以及新生成熟神经元标志物BrdU/NeuN阳性细胞数均明显少于未照射大鼠,提示放射性认知功能障碍的发生与海马神经元的活性的下降以及神经发生的减少密切相关。这一现象与micro-PET成像SPM分析得到大鼠海马区域葡萄糖代谢减低的结论相一致。
综上所述,SPM分析micro-PET数据显示放射性认知障碍的大鼠海马区域葡萄糖代谢明显降低,与该部位神经元活性的下降以及神经发生减少相符,表明在临床上采用18F-FDG micro-PET成像评估放射性认知功能障碍具有良好的应用前景。
利益冲突 无
作者贡献声明 嵇建峰负责实验设计、数据分析和论文撰写;刘蕴莹协助完成实验和参与结果分析;孔月参与数据统计;谷庆负责研究设计、论文修改及审核
| [1] |
Boström M, Kalm M, Eriksson Y, et al. A role for endothelial cells in radiation-induced inflammation[J]. Int J Radiat Biol, 2018, 94(3): 259-271. DOI:10.1080/09553002.2018.1431699 |
| [2] |
Zhang P, Chen Y, Zhu H, et al. The effect of gamma-ray-induced central nervous system injury on peripheral immune response:an in vitro and in vivo study[J]. Radiat Res, 2019, 192(4): 440-450. DOI:10.1667/RR15378.1 |
| [3] |
黄旭锐, 黄海威. 放射性脑损伤炎症反应机制的研究进展[J]. 中华放射医学与防护杂志, 2018, 38(11): 870-873. Huang XR, Huang HW. Advances in the mechanism of inflammatory response to radiation-induced brain injury[J]. Chin J Radiol Med Prot, 2018, 38(11): 870-873. DOI:10.3760/cma.j.issn.0254-5098.2018.11.014 |
| [4] |
Bálentová S, Hajtmanová E, Filová B, et al. Effects of fractionated whole-brain irradiation on cellular composition and cognitive function in the rat brain[J]. Int J Radiat Biol, 2018, 94(3): 238-247. DOI:10.1080/09553002.2018.1425805 |
| [5] |
Lawrie TA, Gillespie D, Dowswell T, et al. Long-term neurocognitive and other side effects of radiotherapy, with or without chemotherapy, for glioma[J]. Cochrane Database Syst Rev, 2019, 8: CD013047. DOI:10.1002/14651858.CD013047.pub2 |
| [6] |
Sala A, Caprioglio C, Santangelo R, et al. Brain metabolic signatures across the Alzheimer's disease spectrum[J]. Eur J Nucl Med Mol Imaging, 2020, 47(2): 256-269. DOI:10.1007/s00259-019-04559-2 |
| [7] |
吕明惠, 苏少华, 郑婉君, 等. 放射性脑损伤研究进展[J]. 亚太传统医药, 2017, 13(17): 79-82. Lyu MH, Su SH, Zheng WJ, et al. Advances in research of radiation brain injury[J]. Asia-Pac Trad Med, 2017, 13(17): 79-82. DOI:10.11954/ytctyy.201717025 |
| [8] |
Pospisil P, Kazda T, Hynkova L, et al. Post-WBRT cognitive impairment and hippocampal neuronal depletion measured by in vivo metabolic MR spectroscopy:results of prospective investigational study[J]. Radiother Oncol, 2017, 122(3): 373-379. DOI:10.1016/j.radonc.2016.12.013 |
| [9] |
Ishibashi K, Onishi A, Wagatsuma K, et al. Longitudinal 18F-FDG images in patients with Alzheimer disease over more than 9 years from a preclinical stage[J]. Clin Nucl Med, 2020, 45(4): e185-189. DOI:10.1097/rlu.0000000000002948 |
| [10] |
Ricci M, Chiaravalloti A, Martorana A, et al. The role of epsilon phenotype in brain glucose consumption in Alzheimer's disease[J]. Ann Nucl Med, 2020, 34(4): 254-262. DOI:10.1007/s12149-020-01441-2 |
| [11] |
Cistaro A, Quartuccio N, Piccardo A, et al. (18)F-FDG PET identifies altered brain metabolism in patients with Cri du Chat syndrome[J]. J Nucl Med, 2020, 61(8): 1195-1199. DOI:10.2967/jnumed.119.236893 |
| [12] |
Hahn CA, Zhou SM, Raynor R, et al. Dose-dependent effects of radiation therapy on cerebral blood flow, metabolism, and neurocognitive dysfunction[J]. Int J Radiat Oncol Biol Phys, 2009, 73(4): 1082-1087. DOI:10.1016/j.ijrobp.2008.05.061 |
| [13] |
Naseri S, Moghahi S, Mokhtari T, et al. Radio-protective effects of melatonin on subventricular zone in irradiated rat:decrease in apoptosis and upregulation of nestin[J]. J Mol Neurosci, 2017, 63(2): 198-205. DOI:10.1007/s12031-017-0970-5 |
| [14] |
Alam MJ, Kitamura T, Saitoh Y, et al. Adult neurogenesis conserves hippocampal memory capacity[J]. J Neurosci, 2018, 38(31): 6854-6863. DOI:10.1523/jneurosci.2976-17.2018 |
| [15] |
Chen H, Goodus MT, de Toledo SM, et al. Ionizing radiation perturbs cell cycle progression of neural precursors in the subventricular zone without affecting their long-term self-renewal[J]. ASN Neuro, 2015, 7(3): 1759091415578026. DOI:10.1177/1759091415578026 |
| [16] |
Zhang Q, Li X, He R, et al. The effect of brain-derived neurotrophic factor on radiation-induced neuron architecture impairment is associated with the NFATc4/3 pathway[J]. Brain Res, 2018, 1681: 21-27. DOI:10.1016/j.brainres.2017.12.032 |
| [17] |
Ji JF, Ji SJ, Sun R, et al. Forced running exercise attenuates hippocampal neurogenesis impairment and the neurocognitive deficits induced by whole-brain irradiation via the BDNF-mediated pathway[J]. Biochem Biophys Res Commun, 2014, 443(2): 646-651. DOI:10.1016/j.bbrc.2013.12.031 |
| [18] |
Ji S, Ding X, Ji J, et al. Cranial irradiation inhibits hippocampal neurogenesis via DNMT1 and DNMT3A[J]. Oncol Lett, 2018, 15(3): 2899-2904. DOI:10.3892/ol.2017.7643 |
| [19] |
Zhang Q, Zhong X, Zhang J, et al. Integration of neurons derived from transplanted BDNF-overexpressing neural stem cells into circuit of the irradiated hippocampus[J]. Radiat Res, 2019, 192(3): 345-351. DOI:10.1667/RR15409.1 |
| [20] |
Fan J, Shan W, Yang H, et al. Neural activities in multiple rat brain regions in lithium-pilocarpine-induced status epilepticus model[J]. Front Mol Neurosci, 2019, 12: 323. DOI:10.3389/fnmol.2019.00323 |
| [21] |
Li R, Wang X, Lin F, et al. Mapping accumulative whole-brain activities during environmental enrichment with manganese-enhanced magnetic resonance imaging[J]. Neuroimage, 2020, 210: 116588. DOI:10.1016/j.neuroimage.2020.116588 |
| [22] |
Grinspun N, Fuentealba Y, Falcon R, et al. c-Fos expression in the ascending arousal system induced by physical exercise in rats:Implication for memory performance[J]. Brain Res, 2019, 1723: 146376. DOI:10.1016/j.brainres.2019.146376 |
 2020, Vol. 40
2020, Vol. 40


