脑干胶质瘤(brainstem gliomas,BSG)占儿童颅内肿瘤的10%~20%,约占成人颅内肿瘤的2%~4%[1-2]。目前国内缺乏BSG的系统性流行病学调查。儿童BSG发病率每年0.60/10万人,其中80%为弥散内生型[3]。根据国内外文献报道,BSG患者治疗后中位生存时间(mOS)为10.79~19个月[4-8],儿童弥漫性内生型桥脑胶质瘤(DIPG)患者治疗后mOS为8.5~11个月[9-12]。脑干是人体的呼吸、循环、意识中枢,脑干解剖结构密集复杂,BSG进展危及生命,治疗要求高,风险大,极具挑战,是脑肿瘤中致残率、致死率和复发率最高的肿瘤[2]。Doyle等[4]报道成人高级别脑干胶质瘤完全/近全切除率为19.4%,术后大部分患者需放疗,DIPG放疗为标准治疗,所以放疗在控制BSG治疗中占据重要地位。本研究收集北京大学肿瘤医院放疗科2012年1月至2019年9月接受调强放疗资料完整的BSG患者21例,回顾性分析患者生存及其影响因素。
资料与方法1.入组标准:立体定向活检或手术病理学证实的世界卫生组织(WHO)Ⅰ~Ⅳ级脑干胶质瘤患者;无病理患者,经头颅MRI及临床症状体征和实验室检查,并神经外科、放疗科及影像科高级职称专家认可临床诊断BSG;除外脑干脑炎等其他非肿瘤性疾病;既往未接受过放疗和化疗;患者预期生存期3个月以上;Karnofsky生活质量评分>60;肝肾功能、心脏功能和血常规无明显异常。
2.临床资料:患者资料见表 1。脑干发病部位涉及到多个部位的以其中心处为准。
|
|
表 1 21例脑干胶质瘤患者的一般资料 Table 1 Characteristics of patients with brainstem gliomas |
3.放疗方法:所有患者均采用容积旋转调强(VMAT)技术放疗,热塑头膜固定,采用CT和MRI模拟定位,并行CT/MRI图像融合,确定靶区时参照术前、术后和最近的MRI资料。根据MRI T1增强像、T2加权像、FLAIR像,确定病灶范围勾画影像学可见大体肿瘤体积(GTV),计划靶区(PTV)为脑干肿瘤原发灶或术后残留灶或术后瘤床GTV外扩0.3 cm并适当修回;靶区剂量:95%靶体积PTV放疗剂量范围50~58 Gy,每次剂量1.8~2 Gy,中位放疗剂量54 Gy。
≥10岁患者按替莫唑胺联合放疗方案(STUPP方案),单次剂量75 mg/m2,1次/d;放疗后2~4周开始辅助化疗,28 d为1周期,进行6周期,起始剂量150 mg/m2,连续服药5 d,停药23 d;从第2周期开始,根据前1个周期不良反应情况,剂量可增至200 mg/m2,或减至100 mg/m2,治疗期间每周监测血象,每2周监测肝肾功能;< 10岁儿童未给予同步或辅助化疗。所有患者放射治疗期间,配合使用甘露醇及地塞米松,以减轻放疗引起脑水肿所致的不良反应。
4.随访:通过门诊复查、电话等方式进行随访。患者第1年每3~6个月复查1次,随后每6~12个月复查1次。总体生存时间定义为行放疗之日至死亡或末次随访时间,随访截至2019年10月31日或死亡日期。
5.统计学处理:采用SPSS 17.0统计软件分析数据,应用Kaplan-Meier法进行生存分析及单因素分析,显著性差异采用双尾Log-rank法检验,P < 0.05为差异有统计学意义。
结果1.生存率:随访时间≥3个月的BSG患者共18例,中位随访时间15.5(5.3~25.6)个月。mOS 20(14.1~25.8)个月,1年和2年总生存率分别为86.2%和34.5%(图 1)。
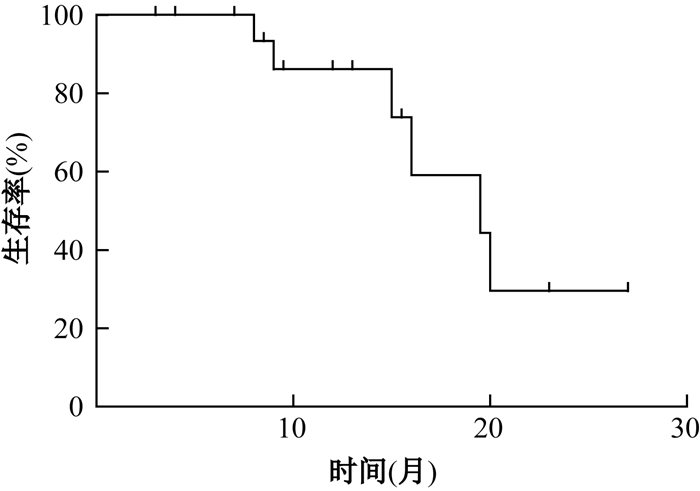
|
图 1 脑干胶质瘤患者生存曲线 Figure 1 Overall survival curve for patients with brainstem glioma |
2.单因素分析:影响BSG患者OS的潜在预后因素中,性别、年龄、出现症状至首次治疗时间、是否化疗、放疗剂量差异无统计学意义(P>0.05);而手术方式、影像学分型、发病部位、WHO分级、放疗方式差异有统计学意义(χ2=9.587、4.829、20.261、10.817、6.957,P < 0.05,表 2)。
|
|
表 2 影响脑干胶质瘤生存的单因素分析 Table 2 Univariate analysis of factors affecting overall survival in brainstem glioma |
讨论
BSG的治疗需要综合治疗,传统的手术、放疗、化疗构成目前主要的治疗手段。2017年脑干胶质瘤专家共识指出,放疗是儿童弥散内生型桥脑胶质瘤(diffuse intrinsic pontine gliomas,DIPG)的标准治疗方案,但只能短暂改善症状,无法延长总生存期,化疗对部分复发或术后残余毛细胞性星形细胞瘤有效,但各种化疗方案均未显著改善DIPG的预后,手术能显著改善外生型及局灶型低级别肿瘤的预后[13]。鉴于BSG患者总体预后差,治疗风险大,本组患者接受规范化及个体化诊疗,部分患者取得较满意疗效。
本组研究的BSG手术方式分为大部分及以上肿瘤切除、活检及少部分肿瘤切除、未手术者,通过手术记录及术前术后MRI影像学对比综合评价手术切除程度,研究提示肿瘤大部分及以上切除具有明显OS优势。手术原则是在保护神经功能的前提下最大程度地切除肿瘤,以延长患者的总生存期。阴鲁鑫等[14]分析29例成人BSG手术治疗疗效,肿瘤切除程度:全切(3例)、近全切(>90%,23例)、大部分切除(50%~90%,2例)、部分切除加活检(< 50%,l例),29例中12例接受了术后放疗,随访结果1年、3年和5年OS分别为58%、35%和23%,单因素分析显示肿瘤边界是否干净、肿瘤大小以及是否接受正规放疗等是BSG患者术后生存的重要影响因素,与本组研究结果手术方式肿瘤大部分及以上切除、术后放疗对BSG的预后影响相一致,其中本研究1年OS率略高。胶质瘤无论级别高低,其切除程度与生存时间成正比,且随着技术的进步,脑干胶质瘤的手术安全性逐渐提高,病死率和致残率明显下降[15-16]。
本研究中,影像学分型局灶内生或外生型对比弥散内生型有明显的OS优势,分析可能为局灶内生型或外生型为手术适应证,便于手术大部分及以上切除,且肿瘤局限便于放疗提高局部控制率,保护剩余部分正常脑干,进而延长患者总生存期,生活质量得到改善。李德志等[5]报道的134例BSG患者中,中脑30例、中脑桥脑10例、桥脑71例(占脑干胶质瘤53%)、桥脑延髓交界10例、延髓15例,观察或中药治疗34例,余100例行手术、放疗、伽玛刀、化疗一种或几种治疗,结果BSG mOS为10.79个月;弥散型及局限型mOS分别为8和16.9个月;未手术及手术mOS分别为5.91和15个月;未放疗及放疗mOS分别为8.57和14.09个月。这与本组局灶内生型或外生型、手术后、放疗的患者预后较好结论一致。国内报道21例BSG射波刀治疗研究,选择病例为弥散内生型肿瘤与脑干边界较清楚的患者,处方总剂量中位数为26(14~33)Gy/(2~6)次,结果18例完成随访,BSG总体mOS 19个月,1年和2年的总生存率分别为87.5%和52.4%,出现Ⅱ度脑水肿3例,Ⅲ度1例[6],其放疗mOS结果与本研究相似,其1年及2年OS率与本中心局灶内生型或外生型1年及2年OS率相一致。
本研究显示,发生于桥脑与中脑部位mOS差异具有统计学意义,可以看出发生于中脑的1年、2年OS率均明显好于发生于桥脑者,分析与发病桥脑多为弥散内生型桥脑胶质瘤且预后差相关。Rosenthal等[10]随访10例成人和14例儿童脑干胶质瘤,结果成人脑干胶质瘤的mOS为57个月,儿童桥脑与非桥脑胶质瘤mOS分别为10个月和60多个月。可见非桥脑胶质瘤好于桥脑胶质瘤预后与本院研究结论一致。Rizzo等[17]在15例儿童DIPG放疗同步及辅助替莫唑胺化疗研究中,中位年龄9(3~14)岁,随访结果mOS为15.6(3.4~25.9)个月,DIPG总体预后差,且替莫唑胺化疗与单纯放疗相比未明显延长OS,这与本研究中发生于桥脑的脑干胶质瘤预后较差相一致。
在本研究中,术后放疗1年、2年的OS对比单纯放疗,有明显的生存优势,可见手术后放疗对BSG患者的预后具有重要意义。术后规范的放疗,能抑制残留肿瘤细胞的生长,降低肿瘤复发或进展的发生率,是BSG术后有力的辅助治疗手段。Rizzo等[17]还提出儿童弥散性脑干胶质瘤外生型与内生型相比,术后放疗有更长的生存期,能使患者受益,其中3个外生型部分切除术后放疗患者生存期分别为19、22和25.9个月,与本研究结论一致。Lachi等[18]在BSG单纯放疗研究中,10例放疗剂量>60 Gy,38例(54~60)Gy,总mOS为7个月,与目前报道术后放疗BSG患者相比,单纯放疗总体生存时间短,预后较差,与本研究结论一致。
本组病例均采用CT/MRI图像融合技术,黄蓉等[19]研究CT/MRI图像融合可减少靶区勾画的不确定性,特别是对水肿区及术后病灶残存的价值更大。将二者成像优劣互补,进一步提高靶区勾画的精准度。本组病例均采用调强放疗,使危及器官得到更好的保护,对放疗靶区进行精准放疗,有利于延长患者的生存期及无病进展生存期。
BSG放疗剂量与总生存相关性研究是不一致的。常规分割剂量放疗是目前标准的治疗手段,能够有效控制弥散内生型脑干胶质瘤(diffuse intrinsic brainstem gliomas,DIBG),大部分患者能得到有效控制(包括影像学上及体征上的缓解),常规放疗的总剂量在50~55 Gy,每次剂量1.8~2.0 Gy,有研究运用高剂量放疗(总剂量>60 Gy)治疗DIBG,但与常规剂量相比,疗效未见明显提高[20]。本组研究中,1年和2年OS率PTV放疗剂量≥54 Gy好于 < 54 Gy组,但差异无统计学意义。蒋静等[7]在对54例影响BSG放射治疗预后的相关因素分析中,放疗剂量≤50.4 Gy与>50.4 Gy单因素分析差异有统计学意义,全组患者中位生存时间17.5个月。Zaghloul等[21]将71例DIBG患者分成大分割放疗(HF)组39 Gy/13次和常规放疗(CF)组54 Gy/30次,结果HF组及CF组mOS分别为7.8、9.5个月,HF组及CF组中位无疾病进展期(mPFS)分别为6.6、7.3个月,两组疗效相近,大分割放疗能快速缓解患者症状,减轻患者负担及缩短放疗时间,无3、4级不良反应。
儿童BSG预后差,多为DIPG患者,与成人预后有明显差别,本研究可见成人2年生存率高于儿童,差异无统计学意义,考虑与本院研究样本量少相关。Yoshida等[11]放射治疗成人及儿童BSG 30例回顾性研究中,14例儿童中位年龄8(2~16)岁,16例成人中位年龄49(19~75)岁,总放疗剂量中位56 (50~70)Gy,单次(1.8~2.0)Gy。结果儿童mOS为8.5个月、成人mOS为39个月。儿童BSG总体预后差,生存期短,中位生存期未超过1年。
本组研究BSG WHO分级中,Ⅰ~Ⅱ级胶质瘤1、2年的生存率均好于Ⅲ~Ⅳ级,且差异有统计学意义。Reithmeier等[8]在对104例BSG患者进行回顾性分析,包括放疗45例(44.6%)、化疗4例(4.0%)、粒子植入7例(6.9%)、放化疗联合22例(21.8%)、支持治疗23例(22.8%)。结果总mOS 18.8个月;Ⅱ级肿瘤mOS 26.4个月,Ⅲ级肿瘤mOS 12.9个月,Ⅳ级mOS 9.8个月;支持治疗mOS 4.3个月;放疗mOS 26.4个月;放化疗联合治疗mOS 13.4个月。可见低级别胶质瘤生存时间长,与本研究结论一致,高级别胶质瘤生存时间短,多因素分析显示放疗可以降低60%的死亡风险,术后放疗仍是治疗的基础。
本组研究BSG化疗研究中,因仅有3例患者未口服替莫唑胺,单因素分析结果意义不大,不再做进一步分析。本组研究对分子病理IDH1/2、Ki67、H3K27 M、MGMT、P53等进行了总结,因为数据不均衡且检测样本例数少,不适合进行统计学分析。因BSG发病率低,总体样本例数少不适合行多因素分析,待扩大样本例数,进行进一步临床研究,更好地指导临床,使患者受益。
本研究结果对指导临床具有一定参考价值。随着分子病理学研究的深入,针对脑干胶质瘤靶向和免疫治疗上获得进展,是今后的一个重要发展方向。期待脑干胶质瘤多中心大样本的前瞻性临床研究,联合和优化手术、放疗、化疗、靶向、免疫等多种治疗方式,为BSG患者带来更好的获益。
利益冲突 无
作者贡献声明 刘少卿负责收集资料、数据分析和论文撰写;郑宝敏、肖绍文负责提供和分析病例资料;徐晓龙、赵丹、刘伟欣协助统计数据;王维虎、孙艳指导论文选题和论文修改
| [1] |
Jallo GI, Biser-Rohrbaugh A, Freed D. Brainstem gliomas[J]. Childs Nerv Syst, 2004, 20(3): 143-153. DOI:10.1007/s00381-003-0870-6 |
| [2] |
张力伟, 王忠诚. 脑干胶质瘤的手术治疗[J]. 中华神经外科杂志, 2009, 25(10): 865-866. Zhang LW, Wang ZC. Surgical treatment of brainstem glioma[J]. Chin J Neurosurg, 2009, 25(10): 865-866. DOI:10.3760/cma.j.issn.1001-2346.2009.010.001 |
| [3] |
Mehta V, Chapman A, McNeely PD, et al. Latency between symptom onset and diagnosis of pediatric brain tumors:an eastern Canadian geographic study[J]. Neurosurgey, 2002, 51(2): 365-373. DOI:10.1227/00006123-200208000-00012 |
| [4] |
Doyle J, Khalafallah AM, Yang W, et al. Association between extent of resection on survival in adult brainstem high-grade glioma patients[J]. J Neurooncol, 2019, 145(3): 479-486. DOI:10.1007/s11060-019-03313-w |
| [5] |
李德志, 阴鲁鑫, 郝淑煜, 等. 134例脑干胶质瘤的临床特征及预后分析[J]. 中华神经外科杂志, 2009, 25(10): 867-870. Li DZ, Yin LX, Hao SY, et al. Clinical characteristics of 134 cases of braistem glioma and analysising the prognosis factors[J]. Chin J Neurosurg, 2009, 25(10): 867-870. DOI:10.3760/cma.j.issn.1001-2346.2009.010.002 |
| [6] |
Zhang J, Liu Q, Yuan Z, et al. Clinical efficacy of cyberknife radiosurgery for adult brainstem glioma:10 years experience at Tianjin CyberKnife Center and review of the literature[J]. Front Oncol, 2019, 9: 257. DOI:10.3389/fonc.2019.00257 |
| [7] |
蒋静, 房彤, 陈怡东, 等. 影响脑干胶质瘤放射治疗预后的相关因素分析[J]. 中华神经外科杂志, 2013, 29(11): 1093-1096. Jiang J, Fang T, Chen YD, et al. Prognostic factors analysis of brainstem gliomas[J]. Chin J Neurosurg, 2013, 29(11): 1093-1096. DOI:10.3760/cma.j.issn.1001-2346.2013.11.006 |
| [8] |
Reithmeier T, Kuzeawu A, Hentschel B, et al. Retrospective analysis of 104 histologically proven adult brainstem gliomas:clinical symptoms, therapeutic approaches and prognostic factors[J]. BMC Cancer, 2014, 14: 115. DOI:10.1186/1471-2407-14-115 |
| [9] |
Maxwell R, Luksik AS, Garzon-Muvdi T, et al. Population-based study determining predictors of cancer-specific mortality and survival in pediatric high-grade brainstem glioma[J]. World Neurosurg, 2018, 119: e1006-e1015. DOI:10.1016/j.wneu.2018.08.044 |
| [10] |
Rosenthal MA, Ashley DM, Drummond KJ, et al. Brain stem gliomas:patterns of care in Victoria from 1998-2000[J]. J Clin Neurosci, 2008, 15(3): 237-240. DOI:10.1016/j.jocn.2007.04.008 |
| [11] |
Yoshida K, Sulaiman NS, Miyawaki D, et al. Radiotherapy for brainstem gliomas in children and adults:A single-institution experience and literature review[J]. Asia Pac J Clin Oncol, 2017, 13(2): e153-e160. DOI:10.1111/ajco.12451 |
| [12] |
Hoffman LM, van Zanten SEM V, Colditz N, et al. Clinical, radiologic, pathologic, and molecular characteristics of long-term survivors of diffuse intrinsic pontine glioma (DIPG):A collaborative report from the International and European Society for Pediatric Oncology DIPG Registries[J]. J Clin Oncol, 2018, 36(19): 1963-1972. DOI:10.1200/JCO.2017.75.9308 |
| [13] |
中华医学会神经外科学分会肿瘤学组, 脑干胶质瘤综合诊疗中国专家共识编写委员会. 脑干胶质瘤综合诊疗中国专家共识[J]. 中华神经外科杂志, 2017, 33(3): 217-229. Oncology Group of Neurosurgery Branch of Chinese Medical Association, Chinese Expert Consensus Writing Committee for Comprehensive Diagnosis and Treatment of Brainstem Glioma. Consensus of Chinese experts on the comprehensive diagnosis and treatment of brain stem glioma[J]. Chin J Neurosurg, 2017, 33(3): 217-229. DOI:10.3760/cma.j.issn.1001-2346.2017.03.001 |
| [14] |
阴鲁鑫, 王宇, 李德志, 等. 成人脑干胶质瘤手术治疗的预后分析[J]. 中华神经外科杂志, 2010, 26(5): 445-447. Yin LY, Wang Y, Li DZ, et al. Analysis of the main factors affecting prognosis of brain stem glioma at adults after surgery[J]. Chin J Neurosurg, 2010, 26(5): 445-447. DOI:10.3760/cma.j.issn.1001-2346.2010.05.022 |
| [15] |
Jakola AS, Myrmel KS, Kloster R, et al. Comparison of a strategy favoring early surgical resection vs. a strategy favoring watchful waiting in low-grade gliomas[J]. JAMA, 2012, 308(18): 1881-1888. DOI:10.1001/jama.2012.12807 |
| [16] |
张力伟. 关注脑干胶质瘤治疗的动向[J]. 中华神经外科杂志, 2015, 31(2): 109-111. Zhang LW. Follow the trend of brainstem glioma treatment[J]. Chin J Neurosurg, 2015, 31(2): 109-111. DOI:10.3760/cma.j.issn.1001-2346.2015.02.001 |
| [17] |
Rizzo D, Scalzone M, Ruggiero A, et al. Temozolomide in the treatment of newly diagnosed diffuse brainstem glioma in children:a broken promise?[J]. J Chemother, 2015, 27(2): 106-110. DOI:10.1179/1973947814Y.0000000228 |
| [18] |
Lachi PK, Irrakula M, Ahmed SF, et al. Clinical profile and outcomes in brainstem glioma:An institutional experience[J]. Asian J Neurosurg, 2015, 10(4): 298-302. DOI:10.4103/1793-5482.162709 |
| [19] |
黄蓉, 吴慧, 卢晓旭, 等. CT-MRI图像融合在脑胶质瘤术后精确放疗中的应用分析[J]. 中华放射肿瘤学杂志, 2017, 26(2): 192-196. Huang R, Wu H, Lu XX, et al. Observation of CT-MRI image fusion in postoperative precise radiotherapy for gliomas[J]. Chin J Radiat Oncol, 2017, 26(2): 192-196. DOI:10.3760/cma.j.issn.1004-4221.2017.02.015 |
| [20] |
毛颖, 蔡加君, 姚瑜. 脑干胶质瘤的现状及展望[J]. 中华神经外科疾病研究杂志, 2015, 14(2): 97-100. Mao Y, Cai JJ, Yao Y. Status and prospect of brainstem glioma[J]. Chin J Neurosurg Dis Res, 2015, 14(2): 97-100. |
| [21] |
Zaghloul MS, Eldebawy E, Ahmed S, et al. Hypofractionated conformal radiotherapy for pediatric diffuse intrinsic pontine glioma (DIPG):a randomized controlled trial[J]. Radiother Oncol, 2014, 111(1): 35-40. DOI:10.1016/j.radonc.2014.01.013 |
 2020, Vol. 40
2020, Vol. 40


