放疗是局部进展期宫颈癌的主要治疗手段,虽然随着精准放疗时代的开启,ⅡB~Ⅲ期宫颈癌的5年生存率有了大幅度提高,但是肿瘤细胞的放疗抗拒仍然是导致治疗失败的主要因素[1]。因此,寻找新的放疗增敏靶点显得尤为迫切。DKC1(dyskeratosis congenita 1)基因最早被发现与先天性角化不良症有关,其突变会导致一种先天性遗传性皮肤病,主要表现为甲板营养不良、口腔或阴道白斑以及皮肤色素沉着。随后研究表明,其编码蛋白dyskerin参与端粒酶的组成,在维持端粒酶RNA复合物稳定性、影响端粒酶活性以及维持端粒长度过程中起到重要作用[2-3],但其放射增敏作用少见报道。本研究以慢病毒为载体,利用shRNA技术,构建DKC1基因表达抑制的HeLa细胞模型,研究DKC1基因表达对端粒酶活性、端粒长度及放射敏感性的影响。
材料与方法1.试剂:TRIzol试剂购于美国Invitrogen公司,反转录试剂盒购于日本Toyobo公司,Real-time PCR试剂盒购于美国Bio-rad公司,TRAP-ELISA试剂盒购于瑞士Roche公司,鼠抗人DKC1单抗、鼠抗人β-肌动蛋白单抗、山羊抗小鼠IgG购于美国Santa Cruz公司。
2.细胞及细胞培养:人宫颈癌细胞HeLa冻存。HeLa细胞用含有10%胎牛血清的RPMI 1640培养液,在37℃、5%CO2培养箱中培养、消化传代,并取对数生长期细胞进行实验。将细胞分为干扰组(Lv-shDKC1)、空白对照组(Mock)和阴性对照组(Lv-shNC)。
3.细胞照射:在室温下,采用美国瓦里安单光子直线加速器6 MV X射线垂直照射,吸收剂量率为2 Gy/min,源靶距(SSD)100 cm。
4.慢病毒载体的构建:本研究采用慢病毒载体携带绿色荧光蛋白(GFP)基因,含DKC1-shRNA序列的转移质粒和包装质粒(pGap/Pol、pRev、pVSV-G)由杭州赛澜生物技术有限公司构建,为防止脱靶,设计的两组DKC1-shRNA序列如下:正向引物5′ GGAUACUUCGGGUGGAGAATT 3′,反向引物5′ UUCUCCACCCGAAGUAUCCTT 3′;正向引物5′ GCGGAUGCGGAAGUAAUUATT 3′,反向引物5′ UAAUUACUUCCGCAUCCGCTT 3′;阴性对照组序列,5′ CCACAUGGUGACAAUGCAUTT 3′,5′ AUGCAUUGUCACCAUGUGGTT 3′。消化、接种对数期的293T细胞于10 cm培养皿中培养48 h,待细胞密度达80%左右后加入转移质粒和包装质粒进行共转染,8 h后吸出原培养基,加入完全培养基后继续培养。转染72 h后收集细胞上清液(病毒液),4℃、4 000×g离心10 min以去除细胞碎片,置于-80℃保存。
5.稳定转染细胞克隆筛选:将HeLa细胞接种到6孔板中培养24 h,分别加入200和500 μl慢病毒原液及Polybrene试剂(Polybrene终浓度为8 μg/ml),混匀后置于37℃、含5% CO2培养箱中培养24 h。24 h后吸出含病毒的培养基,加入1 ml完全培养基继续培养。感染72 h后利用荧光显微镜观察绿色荧光蛋白(GFP)。换上终浓度为1 μg/ml的Puromycin的培养基,筛选稳定转染的细胞株。
6.RT-PCR检测DKC1基因表达:利用TRIzol Reagent法分别提取各组细胞的总RNA,利用反转录试剂盒将总RNA反转录成cDNA后进行RT-PCR扩增,并以GAPDH为内参,反应体系为:cDNA(10倍稀释)2 μl、mix 12.5 μl、正、反向引物各1.0 μl、ddH2O 8.5 μl,循环条件为:95℃ 3 min;95℃ 10 s,60℃ 30 s,72℃ 30 s,30个循环;72℃ 5 min。GAPDH的正向引物为5′ TGGAAGGACTCATGACCACA 3′,反向引物为5′ TTCAGCTCAGGGATGACCTT 3′,DKC1的正向引物为5′ CTGACAGGTGCCTTATTCCA 3′,反向引物为5′ ATGACTCCAGAACGAACCCT 3′。PCR产物进行琼脂糖凝胶电泳,并用凝胶成像系统分析并记录结果。
7.Western blot检测DKC1蛋白表达:各组细胞总蛋白提取后使用二喹啉甲酸(BCA)法测定蛋白浓度,经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,蛋白质转移至NC膜,使用一抗(鼠抗人DKCl单克隆抗体或鼠抗人β-肌动蛋白单克隆抗体)、兔抗鼠二抗进行杂交,显影定影后利用Image J分析软件分析并记录结果。
8.端粒重复序列扩增酶联免疫吸附试验(TRAP-ELISA)检测端粒酶活性:利用胰酶消化并收集待测细胞,然后加入裂解液,混匀后400×g离心5 s,收集上清,取1 μl上清加入49 μl扩增混合液进行PCR扩增。然后分别取各组PCR产物各2 μl,加入变性剂20 μl,室温放置10 min后加入杂交液225 μl,混匀后400×g离心5 s,取100 μl混合物加入试剂盒中已包被的微孔板中,将微孔板置于37℃中孵育1 h,之后弃孔内液体。用250 μl缓冲液反复洗涤4次后加入抗地高辛-辣根过氧化物酶100 μl,室温置于摇床上30 min,之后弃孔内液体,再用洗涤液洗5次,加入四甲基联苯胺(TMB)底物100 μl,孵育10 min,最后加入100 μl终止液,30 min内在酶标仪上测定吸光度(A),并计算端粒酶活性,活性=A450 nm-A690 nm。
9.实时荧光定量PCR(QPCR)检测端粒长度变化:提取各组细胞基因组DNA,并按如下条件进行扩增:端粒(Tel)和端粒内参(36B4)PCR反应体系包括:SYBRⓇ Premix Ex TaqTM (2×) 12.5 μl,正、反向引物各0.5 μl,ROX参考染料Ⅱ(50×)0.5 μl,基因DNA 2 μl,ddH2O 9 μl:端粒和内参基因36B4基因PCR反应条件为:95℃ 5 s,95℃ 15 s,54℃ 2 min,共30个循环。各引物序列如下:Tel1为5′ GGTTTTTGAGGGTGAGGGTGAGGGTGAGGGTGAGGGT 3′,Tel2为5′ TCCCGACTATCCCTATCCCTATCCCTATCCCTATCCCTA 3′,36B4u为5′ CAGCAAGTGGGAAGGTGTAATCC 3′,36B4d为5′ CCCATTCTATCATCAACGGGTACAA 3′。应用Mx3000P系统软件分析并采集数据。每份样本均做3个复孔。相对端粒长度运用T/S比率来计算:[2Ct(telomere)/2Ct(36B4)]-1=2-△△Ct。
10.集落形成实验检测细胞放射敏感性:利用胰酶消化将各组细胞制成单细胞悬液,然后接种于6孔板中。利用6 MV X射线分别给予0、2、4、6、8 Gy照射,照射结束后的细胞置于饱和湿度下继续培养14 d。然后弃培养液,每孔中加入1%甲紫无水乙醇溶液固定并染色20 min,低倍镜下计数≥50个细胞的有效克隆数,以克隆数与接种细胞数的百分比表示克隆形成率(PE),以克隆数/(PE×接种细胞数)表示存活分数(SF)。放射生物学参数和细胞生存曲线通过单击多靶模型利用GraphPad Prism8软件进行拟合。
11.统计学处理:使用SPSS 22.0统计软件对数据进行分析,计量资料用x±s进行表示,样本符合正态分布,两组间比较采用独立样本t检验,多组间比较经方差齐性检验采用单因素方差分析。P < 0.05为差异有统计学意义。
结果1. Lv-shDKC1对宫颈癌HeLa细胞中DKC1 mRNA表达水平的影响:结果示于图 1。RT-PCR检测结果经QuantiScan软件分析发现:与空白对照组相比,干扰组的DKC1 mRNA表达显著下降(t=25.53,P < 0.05),其表达抑制率为(71.33±4.11)%,而空白对照组及阴性对照组间DKC1 mRNA表达差异无统计学意义(P>0.05)。

|
注:1.空白对照组;2.阴性对照组;3.干扰组 图 1 宫颈癌HeLa细胞中DKC1基因表达水平 A. RT-PCR检测DKC1mRNA表达水平;B. Western blot检测DKC1蛋白表达水平 Figure 1 Expression of DKC1 gene in HeLa cells A. DKC1 mRNA expression detected by RT-PCR; B. DKC1 protein expression detected by Western blot |
2. Lv-shDKC1对宫颈癌HeLa细胞中DKC1蛋白表达的影响:结果示于图 1。Western blot条带经Image J软件检测灰度值显示,干扰组DKC1蛋白表达水平明显低于空白对照组(t=4.833,P < 0.05),其表达抑制率为(35.52±3.80)%,而空白对照组及阴性对照组间DKC1蛋白表达差异无统计学意义(P>0.05)。
3. Lv-shDKC1对端粒酶活性及相对端粒长度的影响:结果示于表 1。TRAR-ELISA法检测端粒酶活性结果显示,干扰组端粒酶活性明显低于空白对照组及阴性对照组(F=31.44,P < 0.05),且空白对照组及阴性对照组间端粒酶活性差异无统计学意义(P>0.05)。而qPCR检测结果显示,与空白对照组及阴性对照组相比,干扰组相对端粒长度明显缩短,差异有统计学意义(F=39.15,P < 0.05),且空白对照组及阴性对照组相对端粒长度差异无统计学意义(P>0.05)。
|
|
表 1 3组细胞中端粒酶活性和相对端粒长度比较(x±s) Table 1 Comparison of telomerase activity and telomere length in three groups of cells (x±s) |
4. Lv-shDKC1对HeLa细胞放射敏感性的影响:慢病毒介导的DKC1干扰质粒转染HeLa细胞后,在各剂量点细胞存活分数(SF2)明显下降(图 2),并计算出各组HeLa细胞株的放射生物学参数D0、Dq、N、SF2(表 2)。与空白对照组及阴性对照组相比,干扰组SF2显著降低(F=1 812,P < 0.001),放射增益SER为1.508,表明干扰DKC1在一定程度上提高了HeLa细胞的放射敏感性。而空白对照组与阴性对照组相比,SF2差异无统计学意义(P>0.05)。
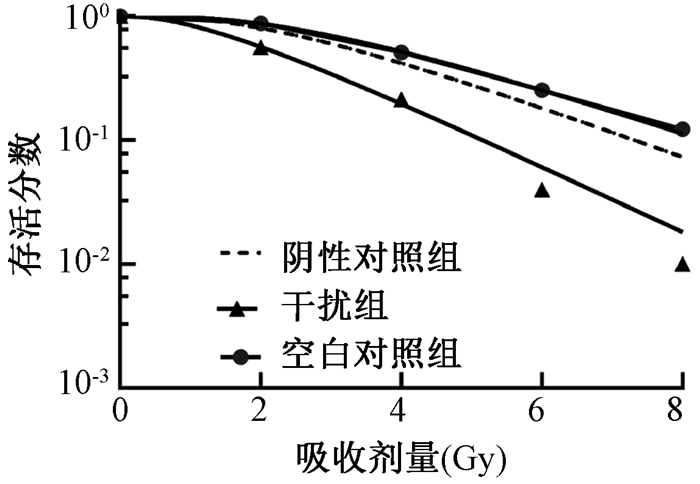
|
图 2 宫颈癌HeLa细胞的细胞存活曲线 Figure 2 Cell survival curves of HeLa cells after radiation |
|
|
表 2 单击多靶模型参数值(x±s) Table 2 The parameter values of cell survival curves stimulated by the single-hit multi-target model(x±s) |
讨论
DKC1基因位于Xq28的末端,长度为16 kb,包含15个外显子,能转录成大约表达2.6 kb的信息[4]。其编码蛋白dyskerin是一种高度保守的核蛋白,与Cbf5q、AtNAP57及mfl等同源,是重要的端粒酶结合蛋白,参与调节端粒酶活性及维持端粒长度[3-4],其有望成为放疗增敏的新靶点。因此,为了验证DKC1与放射敏感性的关系,急需构建一种DKC1基因表达受抑制的宫颈癌细胞模型。由于慢病毒载体对分裂细胞和非分裂细胞均具有感染能力,且宿主免疫反应小、转移基因片段容量大,其已广泛用于转移外源性目的片段的理想载体[5]。本实验将慢病毒载体与shRNA技术相结合,构建DKC1基因表达受抑制的HeLa细胞株,是较为理想的研究宫颈癌放射敏感性的细胞模型,也为后续的宫颈癌动物移植瘤模型的构建奠定了基础。
端粒是真核细胞线性染色体末端的重复序列,其基本功能是稳定染色体、防止染色体端端融合和控制细胞分裂潜能等。其长度主要受端粒酶活性的影响,活化状态的端粒酶能不断合成端粒重复序列并添加到端粒末端,维持端粒长度及功能,实现肿瘤细胞的“永生化”。研究表明,dyskerin蛋白通过与端粒酶RNA复合物上的H/ACA RNA相结合形成H/ACA snoRNP[2],而snoRNP突变则可导致端粒酶hTERC降解、端粒酶活性下降,端粒长度缩短,基因组不稳定性增高[6]。干扰dyskerin蛋白的表达,不但影响端粒酶活性及端粒长度[7],而且阻碍肿瘤细胞的有丝分裂及蛋白质合成,增加染色体的不稳定性,抑制肿瘤生长[8]。反之,当端粒长度缩短时,dyskerin蛋白表达水平则代偿性增加以维持端粒长度[9]。本实验同样证实DKC1基因通过表达dyskerin蛋白在维持端粒酶活性及端粒长度过程中扮演重要角色。干扰DKC1基因表达后,HeLa细胞的端粒酶活性降低、端粒长度缩短。
集落形成实验通过计数不同组细胞在不同剂量照射下所形成的克隆数,然后进行存活曲线的拟合,发现照射后干扰组细胞克隆形成能力明显降低,HeLa细胞的平均致死剂量D0和存活分数SF2均下降,说明DKC1表达抑制后HeLa细胞的放射敏感性有所提高。然而干扰DKC1基因增加放射敏感性的机制尚不明确。越来越多的研究证实,无论是不同组织来源的肿瘤细胞,还是同一组织来源的不同细胞,其端粒长度与放射敏感性存在负相关[10-12],即端粒长度越长,端粒就越稳定,对放射线越抗拒;反之,端粒越短,肿瘤细胞越容易受到放射线的损伤,即放射敏感。而恶性肿瘤通过激活端粒酶活性维持端粒长度而导致放疗抗拒[13]。因此,DKC1基因可能通过参与调节端粒酶活性及端粒长度而影响放射敏感性。
综上所述,以慢病毒为载体构建DKC1基因表达受抑制的宫颈癌HeLa细胞株,在细胞水平证实干扰DKC1表达可以起到放射增敏作用,为后续以DKC1基因为靶点的放射增敏研究提供了新思路。
志谢 感谢桂林市科技攻关项目(20170109-23)和广西壮族自治区卫生厅自筹项目(Z20170816)对本研究的资助
利益冲突 无
作者贡献声明 柳正春设计实验、实施研究、采集和分析数据、撰写论文;蔡锐参与实施;张凯丽参与数据分析;阮国柱指导实验设计;刘美莲指导论文撰写
| [1] |
Lin Y, Chen K, Lu Z, et al. Intensity-modulated radiation therapy for definitive treatment of cervical cancer:a meta-analysis[J]. Radiat Oncol, 2018, 13(1): 177. DOI:10.1186/s13014-018-1126-7 |
| [2] |
MacNeil DE, Lambert-Lanteigne P, Autexier C. N-terminal residues of human dyskerin are required for interactions with telomerase RNA that prevent RNA degradation[J]. Nucleic Acids Res, 2019, 47(10): 5368-5380. DOI:10.1093/nar/gkz233 |
| [3] |
Armando RG, Mengual Gómez DL, Juritz EI, et al. Homology model and docking-based virtual screening for ligands of human dyskerin as new inhibitors of telomerase for cancer treatment[J]. Int J Mol Sci, 2018, 19(10): 3216. DOI:10.3390/ijms19103216 |
| [4] |
Zhang M, Pan Y, Jiang R, et al. DKC1 serves as a potential prognostic biomarker for human clear cell renal cell carcinoma and promotes its proliferation, migration and invasion via the NF-κB pathway[J]. Oncol Rep, 2018, 40(2): 968-978. DOI:10.3892/or.2018.6484 |
| [5] |
Borsotti C, Borroni E, Follenzi A. Lentiviral vector interactions with the host cell[J]. Curr Opin Virol, 2016, 21: 102-108. DOI:10.1016/j.coviro.2016.08.016 |
| [6] |
von Stedingk K, Koster J, Piqueras M, et al. snoRNPs regulate telomerase activity in neuroblastoma and are associated with poor prognosis[J]. Transl Oncol, 2013, 6(4): 447-457. DOI:10.1593/tlo.13112 |
| [7] |
Parry EM, Alder JK, Lee SS, et al. Decreased dyskerin levels as a mechanism of telomere shortening in X-linked dyskeratosis congenita[J]. J Med Genet, 2011, 48(5): 327-333. DOI:10.1136/jmg.2010.085100 |
| [8] |
Alawi F, Lin P. Dyskerin localizes to the mitotic apparatus and is required for orderly mitosis in human cells[J]. PLoS One, 2013, 8(11): e80805. DOI:10.1371/journal.pone.0080805 |
| [9] |
Fernandez-Garcia I, Marcos T, Muñoz-Barrutia A, et al. Multiscale in situ analysis of the role of dyskerin in lung cancer cells[J]. Integr Biol (Camb), 2013, 5(2): 402-413. DOI:10.1039/c2ib20219k |
| [10] |
Benderli Cihan Y. Importance of telomere length and telomerase activity in radiosensitivity[J]. J BUON, 2018, 23(3): 838-839. |
| [11] |
Lei H, Feng D, Zhou F, et al. Expression of human protection of telomere 1 correlates with telomere length and radiosensitivity in the human laryngeal cancer Hep-2 cell line[J]. Oncol Lett, 2015, 10(2): 1149-1154. DOI:10.3892/ol.2015.3332 |
| [12] |
Lei H, Zhou FX, Xu H, et al. Expression of various protection of telomeres 1 variants is associated with telomere length and radiosensitivity in colon and gastric adenocarcinoma cells in vitro[J]. Biomed Rep, 2015, 3(3): 420-424. DOI:10.3892/br.2015.444 |
| [13] |
Yu C, Yu Y, Xu Z, et al. Antisense oligonucleotides targeting human telomerase mRNA increases the radiosensitivity of nasopharyngeal carcinoma cells[J]. Mol Med Rep, 2015, 11(4): 2825-2830. DOI:10.3892/mmr.2014.3105 |
 2020, Vol. 40
2020, Vol. 40


