核与辐射技术已经广泛应用于国防、医疗等领域,在造福人类的同时也给当今世界带来潜在的核与辐射危险,因此,研究电离辐射损伤机制,探寻电离辐射损伤防治新靶点具有十分重要的意义[1-2]。在辐射损伤防治领域,继Burdelya等[3]报道TLR5激动剂CBLB502具有极强的辐射防护效果之后,TLRs家族其他成员的辐射防护作用也相继被发现[4-5]。但由于TLRs功能十分广泛,使得其激动剂辐射防护作用与副作用同时存在,这限制了TLRs激动剂在辐射损伤防治中的应用转化。
课题组前期通过基因敲除小鼠证明TLR2是辐射损伤防护的关键靶点[6],microRNA(miRNA)是一类长度约22个核苷酸的单链非编码RNA分子,近几年国内外已经报道多条miRNA与辐射损伤防护、放射敏感性等相关。本研究从TLR2辐射防护作用入手,以TLR2 KO小鼠为研究对象,希望通过转录组测序找出TLR2下游与辐射防护调控相关的关键miRNA,为解决电离辐射损伤难题提供潜在靶点。
材料与方法1.主要试剂及仪器:胎牛血清购自美国GIBCO公司,培养基、EDTA-胰酶、磷酸盐缓冲液(PBS)购自美国Hyclone公司,红细胞裂解液购自上海博光生物公司,电转试剂(Amaxa cell line nucleofector kit)购自德国Amaxa公司,CCK-8(cell counting kit-8)试剂购自日本同仁化学研究所,Annexin V-FITC/PI-PE凋亡试剂盒购自北京Transgen公司,TRIzol试剂购自美国InvitroGen公司,Pam3CSK4(PAM3)购自法国InvivoGen公司,miR-NC、miR-21、miR-NC ASO、miR-21 ASO为上海吉玛公司产品。小动物血液三分类计数仪为深圳Mindary公司产品,荧光定量PCR仪为美国Thermofisher公司产品,流式细胞仪为美国Backman公司产品。
2.动物与细胞培养:7周龄TLR2 KO、MyD88 KO雄性小鼠购自南京大学模式动物研究所;7周龄C57BL/6雄性野生型(WT)小鼠购自海军军医大学实验动物中心,动物合格证号:20180006014971。生存期实验每组小鼠7~10只,其他实验每组3只,体重(18±2) g,养于日夜交替采光、24℃恒温动物房中。小鼠胚胎成纤维细胞NIH/3T3和小鼠淋巴瘤细胞EL4购自美国模式培养物集存库(American Type Culture Collection, ATCC),培养条件为DMEM+10%胎牛血清+1%双抗,5%CO2,37℃恒温恒湿培养箱。
3.小鼠生存期实验:照射源采用60Co γ射线,7周龄WT与TLR2 KO雄性小鼠分别标记为WT组、TLR2 KO组,采用不同剂量单次全身照射,照射剂量分别为6.0、7.0、9.0 Gy,剂量率为1.0 Gy/min。照后每隔24 h记录小鼠生存情况并绘制生存曲线。在TLR2配体PAM3防治小鼠急性辐射损伤的实验中,实验分组为PAM3组(腹腔注射给药50 mg/kg)和PBS组(腹腔注射100 μl)。
4.骨髓细胞(BMCs)及外周血白细胞(WBCs)计数:在7.0 Gy照射后第1、5、14、20、28天取WT组和TLR2 KO组小鼠单侧股骨,用PBS将BMCs冲出,使用红细胞裂解液处理后,采用流式细胞仪进行BMCs相对计数。在7 Gy照射后第1、5、14、20、28天取小鼠外周血约20 μl,充分抗凝后使用小动物血液三分类计数仪进行WBCs计数。
5.细胞活力与凋亡检测:细胞采用8.0 Gy γ射线照射,剂量率为1.0 Gy/min。照射后细胞活力采用CCK-8试剂进行检测,相对细胞活力(%)=(A处理-A空白)/(A对照-A空白)×100%。细胞凋亡采用流式细胞术进行检测,WT和TLR2 KO小鼠分别予7 Gy照射(3只)和不照射(3只),照后24 h取小鼠BMCs后进行Annexin V-FITC/PI-PE双染色,室温孵育20 min后进行流式细胞术分析,凋亡率(%)=100%-左下象限%(FITC-/PE-)。
6.骨髓移植(bone marrow transplantation, BMT)实验:无菌条件下取WT和TLR2 KO小鼠骨髓细胞,使用红细胞裂解液处理后制备细胞悬液,调整细胞浓度至1×107/ml后,通过尾静脉将细胞悬液注入7.0 Gy“清髓”后的C57BL/6受体小鼠(照射后24 h内),0.2 ml/只。分别标记为:WT BMC组、TLR2 KO BMC组,以及空白组NO BMC组。
7.转录组测序:7 Gy照射后24 h取小鼠BMCs,红细胞裂解液处理后,采用TRIzol法提取BMCs内总RNA。转录组测序委托广州锐博生物有限公司进行。
8.定量PCR(QT-PCR):采用上海吉玛公司的Hairpin-itTM miRNA反转录及定量PCR试剂盒。以GAPDH为内参,计算miRNA的相对表达水平。
9. miRNA过表达/敲低细胞模构建:选取BMCs、NIH/3T3、EL4为研究对象,使用miR-21 mimics及ASO对miR-21分别进行过表达和敲低,分别标记为对照组(miR-21NC)、过表达组(miR-21mimics)和敲低组(miR-21ASO)。使用QT-PCR检测miR-21过表达及敲低情况。
10.统计学处理:采用SPSS 19.0统计软件进行分析,符合正态分布的数据以x±s表示。两组之间差异的比较采用两独立样本t检验。单因素方差分析(ANOVA)用于符合正态分布且方差齐的3组及3组以上之间差异的比较。转录组数据采用DEGseq R语言包,基于泊松分布分析Q值,Q < 0.05时,表示基因表达差异非常显著。使用GraphPad Prism软件,采用Kaplan-Meier方法分析两组间生存率的差异。P < 0.05为差异有统计学意义。
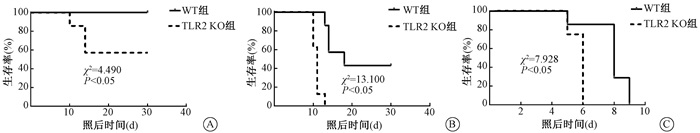
结果1.生存期实验评价TLR2 KO小鼠的辐射敏感性:结果如图 1所示,在不同照射剂量条件下,TLR2 KO小鼠的生存率明显低于WT小鼠(χ2=4.490、13.100、7.928,P < 0.05)。
|
图 1 不同剂量γ射线照射后WT小鼠与TLR2 KO小鼠的存活曲线 A.6.0 Gy;B.7.0 Gy;C.9.0 Gy Figure 1 Survival curves of WT mice and TLR2 KO mice exposed to different doses of γ-rays A. 6.0 Gy; B. 7.0 Gy; C. 9.0 Gy |
2. TLR2 KO小鼠辐射敏感性增加与BMCs损伤相关:在7.0 Gy照射后不同时间点,TLR2 KO小鼠的WBCs和BMCs数目均小于WT小鼠(表 1,2)。
|
|
表 1 7.0 Gy γ射线照射后不同时间两组小鼠白细胞数目变化(x±s) Table 1 Number of WBCs after TBI of 7.0 Gy γ-rays(x±s) |
|
|
表 2 7.0 Gy γ射线照射后不同时间两组小鼠骨髓细胞数目变化(x±s) Table 2 Number of BMCs after TBI of 7.0 Gy γ-rays(x±s) |
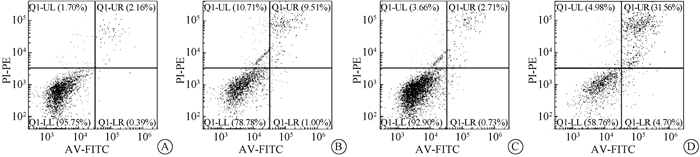
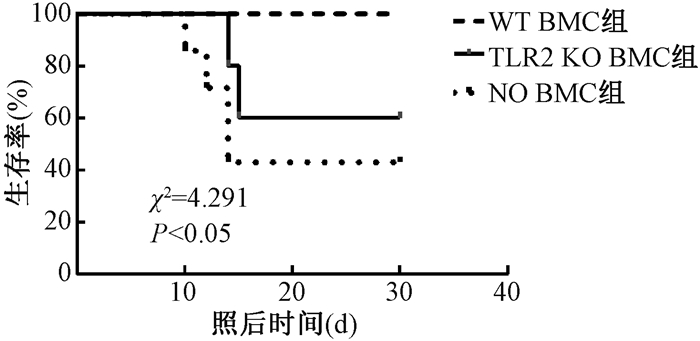
在7.0 Gy照后24 h检测凋亡发现TLR2 KO小鼠BMCs凋亡率大于WT小鼠(37.77±1.951,21.19±0.462,t=8.274,P < 0.05),未照射小鼠BMCs凋亡率未见差异(5.207±0.613,6.663±0.254,P>0.05)(图 2)。BMT实验发现TLR2 KO小鼠来源的BMCs不能挽救清髓小鼠的存活(χ2=4.291,P < 0.05),证明TLR2 KO小鼠辐射敏感性增加与BMCs损伤相关(图 3)。
|
图 2 7.0 Gy γ射线照射后24 h WT组和TLR2 KO组小鼠与未照射小鼠BMCs凋亡情况 A. WT小鼠BMCs未照射组;B. WT小鼠BMCs照射组;C. TLR2 KO小鼠BMCs未照射组;D. TLR2 KO小鼠BMCs照射组 Figure 2 The apoptosis rates of BMCs were analyzed by flow cytometry at 24 h after 7.0 Gy γ-rays irradiation A. BMCs in TLR2 WT mice without irradiation; B. BMCs in TLR2 KO mice without irradiation; C. BMCs in TLR2 WT mice with irradiation; D. BMCs in TLR2 KO mice with irradiation |
|
图 3 WT与TLR2 KO小鼠BMCs移植后清髓小鼠的存活曲线 Figure 3 Survival curves of irradiated mice after BMCs transplantation |
3.转录组测序筛选到TLR2通路下游关键调控分子miR-21:结果见图 3。通过转录组测序对7.0 Gy照后WT组和TLR2 KO组小鼠BMCs进行差异基因筛选,发现差异基因55个([log2 Fold Change]>0.95,Q < 0.05),其中上调基因28个,下调基因27个,对下调差异最大的前10个差异分子进行文献调研与论证,发现miR-21在生长发育、免疫反应等多个生物学进程中均发挥关键作用,在放射生物医学领域也已有研究报道miR-21可以参与辐射致癌进程,但miR-21参与TLR2辐射防护中的作用仍未见报道,因此锁定miR-21进行后续研究(表 3)。同时对差异基因进行KEGG通路富集分析,发现NF-kappaB(mmu04064)、TNF(mmu04668)和Toll样受体(mmu04620)3个信号通路显著富集(P < 0.05)。
|
|
表 3 下调差异最大的前10个差异基因列表 Table 3 The top 10 down-regulated differential genes |
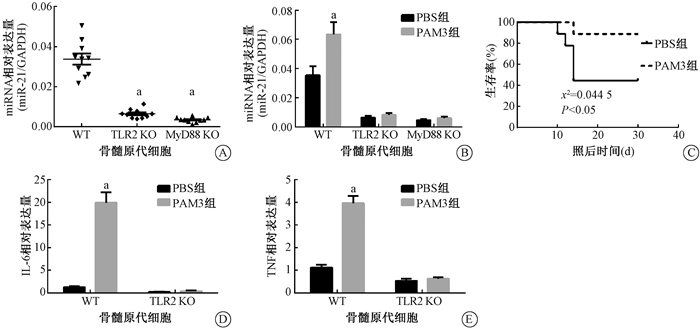
4. miR-21表达量变化依赖于TLR2、MyD88:结果见图 4。定量PCR结果证实与WT组相比,TLR2 KO组(t=9.420,P < 0.05)与MyD88 KO组(t=10.700,P < 0.05)小鼠BMCs内miR-21表达量下调(图 4A )。使用TLR2配体PAM3刺激BMCs后可以上调WT组小鼠BMCs内miR-21表达(t=4.636,P < 0.05),而TLR2 KO组与MyD88 KO组小鼠BMCs内miR-21表达量无显著变化(P>0.05),表明miR-21的上调依赖TLR2与MyD88(图 4B)。与PBS组相比,PAM3可以促进7.0 Gy照后小鼠存活(χ2=4.038,P < 0.05)(图 4C)。定量PCR结果表明,PAM3刺激后WT小鼠BMCs内辐射防护因子IL-6(t=13.79,P < 0.05)和TNF-α(t=14.28,P < 0.05)表达量上调,而TLR2小鼠BMCs内IL-6和TNF-α的表达量差异无统计学意义(P>0.05),表明IL-6和TNF-α的表达量上调同样依赖于TLR2(图 4D,4E)。
|
注:a与WT小鼠比较,t=9.420、10.700、4.636、13.790、14.280,P < 0.05 图 4 miR-21表达量的验证 A.不同小鼠BMCs内miR-21表达量检测;B. PAM3组与PBS组BMCs内miR-21的表达量变化;C. PAM3对WT小鼠生存率的影响;D. PAM3刺激后WT组、TLR2 KO组小鼠BMCs内IL-6表达量变化;E. PAM3刺激后WT组、TLR2 KO组小鼠BMCs内TNF-α表达量变化 Figure 4 The expression of miR-21 A. The expression of miR-21 in BMCs of TLR2 WT mice, TLR2 KO mice and MyD88 KO mice; B. The changes of miR-21 expression in BMCs after PAM3 stimulation; C. Effects of PAM3 on the survival rate of mice; D. The changes of IL-6 expression in BMCs after PAM3 stimulation; E. The changes of TNF-α expression in BMCs after PAM3 stimulation |
5.构建miR-21过表达与敲低细胞模型:以BMCs、NIH/3T3、EL4为实验对象,验证miR-21本底表达量(0.041 7±0.004 0,0.012 0±0.001 7,0.140 7±0.009 0,F=133.7,P < 0.05)。转入miR-21mimics和miR-21 ASO构建miR-21过表达与敲低细胞模型,miR-21 NC作为对照,并采用QT-PCR验证,结果见表 4,5。miR-21 mimics电转可上调WT小鼠BMCs、TLR2 KO小鼠BMCs、NIH/3T3、EL4内miR-21水平数倍到数百倍。miR-21 ASO电转可下调NIH/3T3和EL4内miR-21表达水平约40%~50%,WT小鼠和TLR2 KO小鼠BMCs下调无显著差异。
|
|
表 4 miR-21过表达细胞模型的建立(x±s) Table 4 The establishment of the miR-21 overexpression cell model(x±s) |
|
|
表 5 miR-21敲低细胞模型的建立(x±s) Table 5 The establishment of the miR-21 knockdown cell model(x±s) |
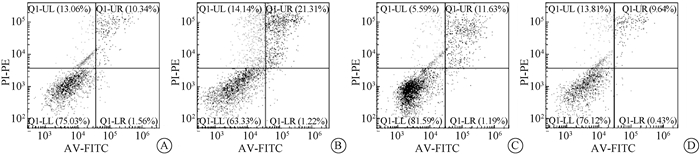
6.过表达与敲低miR-21对细胞活力和凋亡的影响:通过CCK-8以及Annexin V/PI双染法分别检测8.0 Gy照射后细胞活力以及凋亡情况,发现miR-21过表达可以促进EL4和NIH/3T3辐射后细胞活力,敲低后降低EL4和NIH/3T3辐射后细胞活力(表 6,7)。miR-21过表达抑制WT(24.45±1.350,17.65±0.3920,t=4.842,P < 0.05)和TLR2 KO(39.90±1.194,23.14±1.056,t=10.520,P < 0.05)小鼠BMCs辐射后细胞凋亡(图 5)。
|
|
表 6 过表达miR-21对辐射后相对细胞活力的影响(x±s) Table 6 The effect of miR-21 over-expression on cell viability(x±s) |
|
|
表 7 敲低miR-21对辐射后相对细胞活力的影响(x±s) Table 7 The effect of miR-21 knockdown on cell viability(x±s) |
|
图 5 过表达miR-21对照射后BMCs凋亡的影响 A. WT小鼠BMCs miR-21 NC组;B. TLR2 KO小鼠BMCs miR-21 NC组;C. WT小鼠BMCs miR-21过表达组;D. TLR2 KO小鼠BMCs miR-21过表达组 Figure 5 The effect of miR-21 over-expression on BMCs apoptosis A. TLR2 WT BMCs transfected with miR-21 NC; B. TLR2 KO BMCs transfected with miR-21 NC; C. TLR2 WT BMCs transfected with miR-21 mimics; D. TLR2 KO BMCs transfected with miR-21 mimics |
讨论
电离辐射损伤防治是核能安全利用急需解决的关键问题,深入研究和探索辐射损伤防护机制,寻找潜在辐射防治新靶点具有重要意义[7]。自2008年Science杂志报道激活TLR5具有明显的辐射防护作用后,TLRs及其TLRs相关配体在电离辐射研究领域得到了越来越多的关注[3]。本课题组也通过基因敲除小鼠证实TLR2/4在辐射损伤防治中发挥关键作用[5-6, 8]。
miRNA是一类由内源基因编码的长度约22核苷酸的非编码单链RNA分子,主要以碱基互补方式与靶基因mRNA的3′-非翻译区(3′-UTR)特异性结合发挥生物学作用[9-10]。近几年国内外已经报道多条miRNA与辐射损伤防护、放射敏感性等相关[11-13]。Abdelfattah等[14]通过转录组测序筛选到miR-584-5p,发现其可增强成神经管细胞瘤对辐射和长春新碱的耐受。Chen等[15]发现miR-450a-5p通过靶向双特异性磷酸酶10(DUSP10)抑制细胞自噬进程,提高食管鳞癌放射敏感性。课题组前期也发现,miR-143在辐射诱导的BALB/c小鼠胸腺淋巴瘤模型中表达下调,并通过靶向B7H1促进辐射诱导的胸腺淋巴瘤[16]。这些研究充分说明miRNA在放射生物学中的关键作用,强烈提示在TLR2通路下游也可能存在某些与放射敏感性相关的重要调控miRNA。
本课题从研究TLR2辐射防护作用入手,希望通过转录组测序找出TLR2信号通路下游与辐射损伤防护作用调控相关的关键miRNA,为解决难治性电离辐射损伤难题提供潜在靶点。在本研究中通过生存期实验证明TLR2 KO小鼠放射敏感性显著增加,在照后不同时间点通过BMCs计数和WBCs计数发现,TLR2 KO小鼠的骨髓造血系统损伤较WT小鼠更加严重,进一步发现辐射后TLR2 KO小鼠的BMCs凋亡增加,BMT实验证明TLR2 KO小鼠放射敏感性的增加与BMCs有关。随后对7.0 Gy照后24 h的WT和TLR2 KO小鼠BMCs进行转录组测序,筛选到差异基因55个,其中上调基因28个,下调基因27个,并对差异基因进行KEGG通路富集分析,KEGG通路中Toll-like receptor signaling pathway、TNF signaling pathway和NF-kappaB signaling pathway显著富集。TNF和NF- kappaB信号通路在前期研究中已被证实与辐射防护有关,这也与KEGG结果相一致[17-18]。通过对下调差异最大的前10个差异分子进行文献调研与论证,最终锁定miR-21进行后续研究。
miR-21在生长发育、免疫反应、癌症发生等生物学进程中均发挥关键作用[19-20]。在放射生物学领域,Liu等[21]证明miRNA-21通过下调PTEN参与电离辐射诱导的上皮细胞向间质转化。本课题组前期也报道miR-21以3′-UTR依赖的方式直接靶向肿瘤抑制基因Big-h3参与辐射致癌进程[22]。但miR-21参与TLR2辐射防护中的作用仍未见报道。
通过定量PCR验证发现,miR-21在TLR2 KO与MyD88 KO小鼠BMCs内显著下调,而使用TLR2靶向配体PAM3CSK4刺激BMCs发现miR-21的上调依赖于TLR2与MyD88,通过生存期实验和定量PCR实验也再次明确PAM3CSK4靶向激活TLR2可以上调IL-6、TNF-α等细胞因子发挥辐射防护作用。随后选取BMCs,NIH/3T3和EL4作为实验对象过表达与敲低miR-21水平,在体外细胞层次探讨其对辐射敏感性中的调控作用。通过细胞活力和凋亡分析发现,miR-21过表达可以促进辐射后细胞活力,抑制辐射后细胞凋亡;miR-21敲低后降低照后细胞活力。
综上所述,本研究通过基因敲除小鼠、转录组测序等研究手段,筛选到TLR2信号通路下游与辐射损伤防护作用调控相关的关键miR-21,并对其功能进行探讨,证明miR-21在TLR2辐射防护进程中具有关键调控作用,其作用机制可能与上调IL-6与TNF-α有关。本研究丰富和加深了TLR2辐射防护的相关分子机制,为辐射损伤防治和肿瘤放疗增敏研究寻找到新靶点。下一步将继续研究miR-21调控IL-6、TNF-α等辐射防护细胞因子的具体机制,为阐明miR-21在TLR2介导辐射防护中的具体机制提供理论依据。
利益冲突 本研究全体作者无利益冲突
作者贡献声明 杜继聪负责实验和论文撰写;刘入菱、程赢负责细胞培养和动物实验;蔡建明、刘聪负责实验设计与指导;高福负责数据统计
| [1] |
王明宇, 王雯雯, 查旭东, 等. 靶向Toll样受体通路辐射防护剂研究进展[J]. 中华放射医学与防护杂志, 2019, 39(7): 549-553. Wang MY, Wang WW, Zha XD, et al. Progresses in radiation protective agents targeting Toll-like receptor pathway[J]. Chin J Radiol Med Prot, 2019, 39(7): 549-553. DOI:10.3760/cma.j.issn.0254-5098.2019.07.013 |
| [2] |
蔡建明. 日本福岛核电站事故对人体健康影响及医学防护[J]. 第二军医大学学报, 2011, 32(4): 349-353. Cai JM. Effect of Fukushima nuclear plant accident on human health and the medical protection[J]. Acad J Sec Mil Med Univ, 2011, 32(4): 349-353. DOI:10.3724/SP.J.1008.2011.00349 |
| [3] |
Burdelya LG, Krivokrysenko VI, Tallant TC, et al. An agonist of toll-like receptor 5 has radioprotective activity in mouse and primate models[J]. Science, 2008, 320(5873): 226-230. DOI:10.1126/science.1154986 |
| [4] |
Guo J, Liu Z, Zhang D, et al. TLR4 agonist monophosphoryl lipid A alleviated radiation-induced intestinal injury[J]. J Immunol Res, 2019, 2019: 2121095. DOI:10.1155/2019/2121095 |
| [5] |
Liu C, Zhang C, Mitchel RE, et al. A critical role of toll-like receptor 4(TLR4) and its' in vivo ligands in basal radio-resistance[J]. Cell Death Dis, 2013, 4: e649. DOI:10.1038/cddis.2013.161 |
| [6] |
Gao F, Zhang C, Zhou C, et al. A critical role of toll-like receptor 2(TLR2) and its' in vivo ligands in radio-resistance[J]. Sci Rep, 2015, 5: 13004. DOI:10.1038/srep13004 |
| [7] |
Taniguchi CM, Miao YR, Diep AN, et al. PHD inhibition mitigates and protects against radiation-induced gastrointestinal toxicity via HIF2[J]. Sci Transl Med, 2014, 6(236): 236ra64. DOI:10.1126/scitranslmed.3008523 |
| [8] |
Liu C, Gao F, Li B, et al. TLR4 knockout protects mice from radiation-induced thymic lymphoma by downregulation of IL6 and miR-21[J]. Leukemia, 2011, 25(9): 1516-1519. DOI:10.1038/leu.2011.113 |
| [9] |
Treiber T, Treiber N, Meister G. Regulation of microRNA biogenesis and its crosstalk with other cellular pathways[J]. Nat Rev Mol Cell Biol, 2019, 20(1): 5-20. DOI:10.1038/s41580-018-0059-1 |
| [10] |
LFR G, MacRae IJ. Regulation of microRNA function in animals[J]. Nat Rev Mol Cell Biol, 2019, 20(1): 21-37. DOI:10.1038/s41580-018-0045-7 |
| [11] |
Bryant J, White L, Coen N, et al. MicroRNA analysis of ATM-deficient cells indicate PTEN and CCDN1 as potential biomarkers of radiation response[J]. Radiat Res, 2020, in press. DOI: 10.1667/RR15462.1.
|
| [12] |
Liang G, Meng W, Huang X, et al. miR-196b-5p-mediated downregulation of TSPAN12 and GATA6 promotes tumor progression in non-small cell lung cancer[J]. Proc Natl Acad Sci USA, 2020, 117(8): 4347-4357. DOI:10.1073/pnas.1917531117 |
| [13] |
Wang F, Mao A, Tang J, et al. microRNA-16-5p enhances radiosensitivity through modulating Cyclin D1/E1-pRb-E2F1 pathway in prostate cancer cells[J]. J Cell Physiol, 2019, 234(8): 13182-13190. DOI:10.1002/jcp.27989 |
| [14] |
Abdelfattah N, Rajamanickam S, Panneerdoss S, et al. MiR-584-5p potentiates vincristine and radiation response by inducing spindle defects and DNA damage in medulloblastoma[J]. Nat Commun, 2018, 9(1): 4541. DOI:10.1038/s41467-018-06808-8 |
| [15] |
Chen H, Yao X, Di X, et al. MiR-450a-5p inhibits autophagy and enhances radiosensitivity by targeting dual-specificity phosphatase 10 in esophageal squamous cell carcinoma[J]. Cancer Lett, 2020, 483: 114-126. DOI:10.1016/j.canlet.2020.01.037 |
| [16] |
Zhao H, Cheng Y, Dong S, et al. Down regulation of miR-143 promotes radiation-induced thymic lymphoma by targeting B7H1[J]. Toxicol Lett, 2017, 280: 116-124. DOI:10.1016/j.toxlet.2017.07.891 |
| [17] |
Du J, Zhang P, Zhao H, et al. The mechanism for the radioprotective effects of zymosan-A in mice[J]. J Cell Mol Med, 2018, 22(4): 2413-2421. DOI:10.1111/jcmm.13538 |
| [18] |
Du J, Cheng Y, Dong S, et al. Zymosan-a protects the hematopoietic system from radiation-induced damage by targeting TLR2 signaling pathway[J]. Cell Physiol Biochem, 2017, 43(2): 457-464. DOI:10.1159/000480472 |
| [19] |
Ma X, Conklin DJ, Li F, et al. The oncogenic microRNA miR-21 promotes regulated necrosis in mice[J]. Nat Commun, 2015, 6: 7151. DOI:10.1038/ncomms8151 |
| [20] |
Banjo T, Grajcarek J, Yoshino D, et al. Haemodynamically dependent valvulogenesis of zebrafish heart is mediated by flow-dependent expression of miR-21[J]. Nat Commun, 2013, 4: 1978. DOI:10.1038/ncomms2978 |
| [21] |
Liu Z, Liang X, Li X, et al. MiRNA-21 functions in ionizing radiation-induced epithelium-to-mesenchymal transition (EMT) by downregulating PTEN[J]. Toxicol Res (Camb), 2019, 8(3): 328-340. DOI:10.1039/c9tx00019d |
| [22] |
Liu C, Li B, Cheng Y, et al. MiR-21 plays an important role in radiation induced carcinogenesis in BALB/c mice by directly targeting the tumor suppressor gene Big-h3[J]. Int J Biol Sci, 2011, 7(3): 347-363. DOI:10.7150/ijbs.7.347 |
 2020, Vol. 40
2020, Vol. 40


