2. 江苏大学医学院, 镇江 212013
2. School of Medicine, Jiangsu University, Zhenjiang 212013, China
前列腺癌是继肺癌和直肠癌之后的男性第三大致命性恶性肿瘤[1]。由于前列腺癌的早期诊断和治疗滞后,许多患者在发现的时候已是中期或晚期,根治的机会很少[2-3]。肿瘤特异性增殖溶瘤腺病毒(replication-selective oncolytic adenovirus,RSOAds)通过利用肿瘤细胞特有的分子改变,优先感染和裂解肿瘤,但对正常组织无影响[4-5]。放射治疗是临床上前列腺癌的主要治疗手段之一,可用于各期前列腺癌的治疗[6-7]。因此,本研究试图在构建可进一步增强前列腺肿瘤组织靶向性的人端粒酶反转录酶(human telomerase re-verse transcriptase,hTERT)和前列腺特异性抗原(prostate specific antigen,PSA)双靶向调控的肿瘤特异性溶瘤腺病毒载体的同时,让其携带上放射性元素125Ⅰ,旨在增强其对肿瘤细胞的杀伤作用,为前列腺癌患者的临床用药提供新的策略。
材料与方法1.细胞培养:人雄激素非依赖性前列腺癌细胞株PC3(中国科学院细胞库),小鼠雄激素非依赖性前列腺腺癌细胞株RM-1(中国科学院细胞库)。RM-1细胞和PC3细胞培养于含青、链霉素(各1 U/ml,0.1 mg/ml)10%牛血清蛋白(上海吉至生化科技有限公司)的RPMI 1640培养基(南京生航生物技术公司)中,放置在37℃、5%CO2、相对湿度为100%的细胞培养箱中培养,细胞贴壁生长,传代扩大培养用于后续实验。
2.实验分组:实验分为4组,空白对照组(生理盐水);125Ⅰ组(NBS作为氧化剂标记125Ⅰ得到125Ⅰ-hTERT/PSA质粒);病毒复合物组(NBS作为氧化剂标记RSOAds得到RSOAds-hTERT/PSA质粒);125Ⅰ-病毒复合物组(NBS作为氧化剂标记125Ⅰ、RSOAds得到125Ⅰ-RSOAds-hTERT/PSA质粒)。
3. 125Ⅰ-RSOAds-hTERT/PSA质粒的构建:根据美国国立生物技术信息中心(NCBI)核苷酸序列数据库(Nucleotide)获得的序列(U37672.1),设计扩增,所用引物如表 1所示,对前列腺特异性启动子的基因进行PCR克隆。接着运用定点突变重叠聚合酶链反应技术构建hTERT/PSA双调控增殖腺病毒载体RSOAds-hTERT/PSA。最后,125Ⅰ标记采用N-溴代琥珀酰亚胺(NBS)作为氧化剂进行标记,标记完成后采用凝胶柱层析法分离纯化核素-溶瘤腺病毒标记物。
|
|
表 1 相关引物序列 Table 1 The applied primer sequences |
4.荧光素酶检测:使用双荧光素酶检测设备进行。所用引物如表 1所示。以PGL3-质粒作为对照组,检测方法按试剂盒说明书进行。
5.酶联免疫吸附试验(ELISA):细胞分组培养后,用吸管将细胞上清液收集到无菌离心管,参照白介素2(IL-2)、IL-10、肿瘤坏死因子α(TNF-α)、γ干扰素(IFN-γ)试剂盒说明书进行测定。450 nm波长依序测量各孔的吸光度(A)值。
6. Caspase-3活性测定:小鼠处死后取出肿瘤组织,参照Caspase-3测试盒说明书,使用试剂盒内的裂解液于玻璃匀浆器内匀浆,匀浆液4℃,14 000 r/min,离心半径6 cm,离心15 min,Bradford法测定蛋白浓度。测定小鼠左室匀浆Caspase-3活力,方法参照试剂盒说明书。
7.免疫荧光染色:瘤组织取出后置于4%多聚甲醛固定,石蜡包埋,切片,蒸馏水清洗后磷酸盐缓冲液(PBS)浸泡5 min。正常山羊血清(加入0.5%TritonX-100)封闭,室温孵育60 min。去血清,滴加适当比例稀释的一抗(稀释比例1 :20),4℃过夜。PBS清洗,5 min×3次。滴加适当比例稀释的荧光素标记二抗(稀释比1:800),室温孵育60 min。PBS清洗,5 min×3次。DAPI染核15 min。PBS清洗,5 min×3次。抗荧光淬灭剂,封片。检测各组小鼠癌组织中CD4、CD8、CD68的表达。
8.免疫组织化学染色:瘤组织取出后置于4%多聚甲醛固定,石蜡包埋,切成4 μm的切片。切片用PBS水合,置于3%过氧化氢溶液中封闭过氧化物酶。切片取出后置于37℃封闭液封闭1 h,4℃下孵育相应抗体(1:100)过夜。PBS洗涤后,切片,37℃下孵育1 h的HRP-Conjugated Secondary抗体(1:200)。在二氨基联苯胺法(DAB)染色,苏木精复染和分段脱水后封片,于400倍显微镜下观察。检测各组前列腺癌细胞CD24、CD44、PSCA的表达。
9. Western blot蛋白测定:小鼠瘤组织取出后,用含1 mmol/L苯甲基磺酰氟化物(PMSF)的匀浆液匀浆,BCA试剂盒定量。每组样品分别上样于10%聚丙烯酰胺凝胶电泳,转膜后的条带用对应一抗于4℃孵育过夜。洗涤后,聚偏二氟乙烯膜(PVDF)上的蛋白条带孵育对应二抗,增强型化学发光(ECL)试剂盒显色,经凝胶成像仪曝光后分析条带,蛋白含量表示为对应内参条带的相对值,以检测各组Caspase-3的表达。
10.MTT法检测细胞抑制率:取对数生长的PC3和RM-1细胞,使用胰酶消化后,以每孔6×103细胞接种于96孔细胞培养板中,与37℃、5% CO2的湿润环境下培养24 h。各实验组细胞经处理后,加入已配制好的0.5 mg/ml的MTT溶液孵育3~4 h。用酶联免疫检测仪测定每孔的吸光度(A)值(测定波长570 nm),通过与空白对照组对比计算各组细胞抑制率。抑制率(%)=[1-(125Ⅰ-病毒复合物组A值-空白对照组A值)/(125Ⅰ组或病毒复合物组A值-空白对照组A值)]×100%
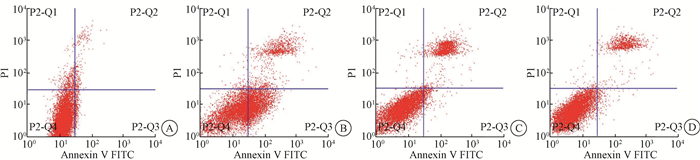
11.流式细胞术:用眼科剪将肿瘤组织剪成小块,放入70 ml组织研磨器内,加入2 ml PBS,研磨至匀浆,收集细胞悬液,1 000×g离心5 min。取106个重悬的不同分组的细胞,1 000×g离心5 min,弃上清,加入195 μl Annexin V-FITC结合液轻轻重悬细胞。加入5 μl Annexin V-FITC,轻轻混匀。室温避光孵育10 min,1 000×g离心5 min,弃上清,加入190 μl Annexin V-FITC结合液轻轻重悬细胞。加入10 μl碘化丙啶染色液,轻轻混匀,冰浴避光放置。随即进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光,以检测各组小鼠瘤组织细胞凋亡水平。
12. TUNEL染色:切片用H2O2处理10 min,经PBS洗涤3次,用0.1%TritonX-100(0.1%柠檬酸钠配制)冰上处理2 min,经PBS洗涤3次后,加入50 μl TUNEL反应混合液于样本上,放入湿盒,恒温培养箱(37℃)中孵育60 min,PBS洗涤3次,加入50 μl转化溶液于样本上,放入湿盒,恒温培养箱(37℃)中孵育30 min,PBS洗涤3次,加入50~100 μl DAB显色液,于室温孵育10 min,PBS洗涤3次,用苏木精染色液进行细胞核染色,用中性树脂封固,光镜下观察各组小鼠瘤组织细胞凋亡水平。
13.统计学处理:采用Graphpad 8.0进行数据分析。两组数据符合正态分布,计量资料用x±s表示,采用独立样本t检验进行比较,多组差异比较经方差齐性检验采用单因素方差分析,组间比较用Dunnett′s法检验。P < 0.05为差异有统计学意义。
结果1. 125Ⅰ-RSOAds-hTERT/PSA质粒的构建:通过PCR扩增并分别与PGL3-Basic载体进行HindⅢ和SmaⅠ双酶切连接获得phTERT-Basic和pPSA-Basic载体,通过双荧光素酶报告基因检测实验显示其表达均正常。根据TERT启动子序列及E1A基因序列(GenBank: KM591901.1)将合成片段插入穿梭载体pshuttle中,构建出质粒pshuttle-TERT-E1A,再同样的方法以此插入E1B基因序列(GenBank: KM591901.1)及E3基因序列(GenBank: X03002.1)得到质粒pshuttle-TERT-E1A-PSA-E1B-E3。采用N-溴代琥珀酰亚胺(NBS)作为氧化剂进行标记得到125Ⅰ-RSOAds-hTERT/PSA(125Ⅰ-病毒复合物)质粒,并测定125Ⅰ标记率达到80%以上。
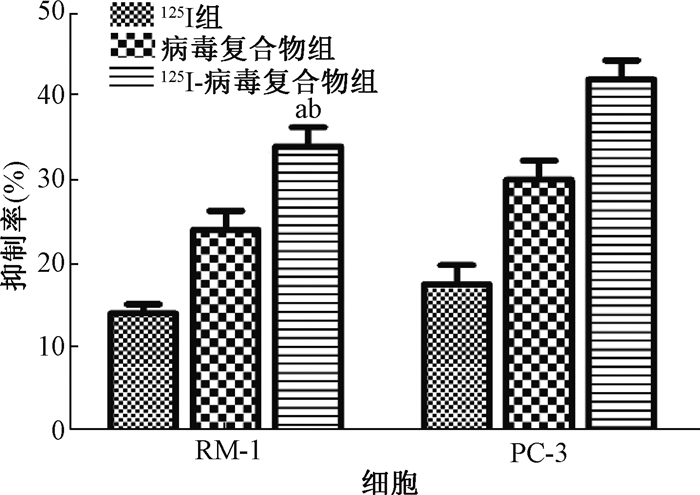
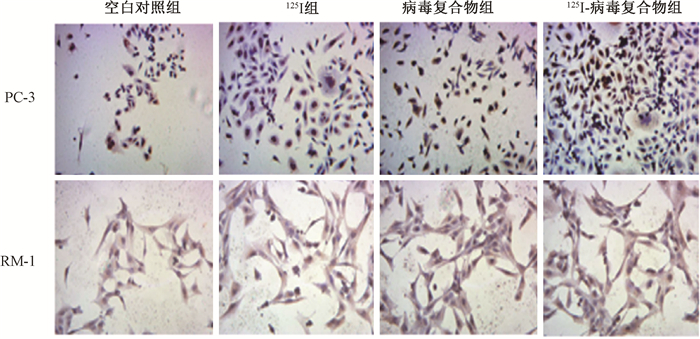
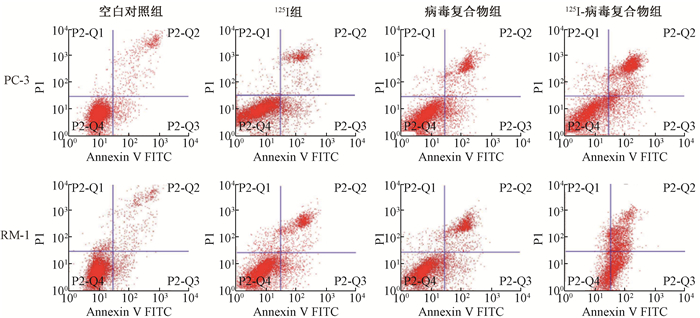
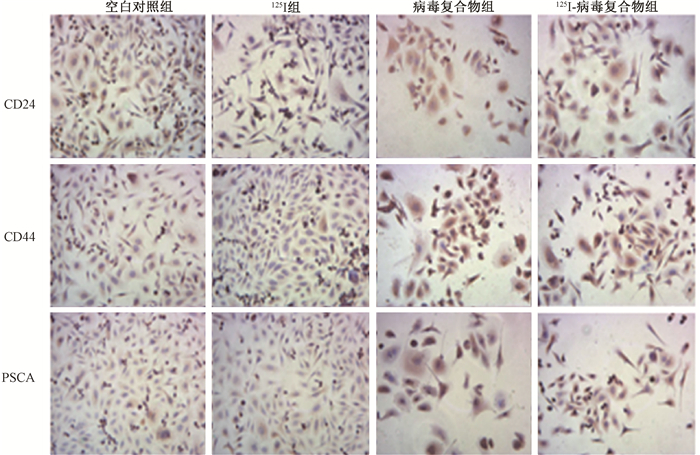
2. 125Ⅰ-病毒复合物抑制前列腺癌细胞的生长:MMT实验结果表明,125Ⅰ-病毒复合物组显著抑制癌细胞RM-1和PC-3的活力,抑制率显著高于125Ⅰ组和病毒复合物组(t=-5.252、-4.962、-2.991、-2.847,P < 0.05,图 1)。凋亡水平检测显示,125Ⅰ-病毒复合物可诱导RM-1和PC3细胞凋亡,同时高于125Ⅰ组和病毒复合物组(图 2,图 3)。免疫组织化学染色结果显示,125Ⅰ-病毒复合物可以显著地降低CD24、CD44及PSCA表达,改善癌微环境(图 4)。
|
注:a与125Ⅰ组相比,t=-5.252、-4.962,P < 0.05;b与病毒复合物组相比,t=-2.991、-2.847,P < 0.05 图 1 各组前列腺癌细胞RM-1和PC3的抑制率 Figure 1 Proliferation inhibition of prostate cancer cells RM-1 and PC3 in each group |
|
图 2 各组前列腺癌细胞RM-1和PC3的凋亡水平 TUNEL染色×200 Figure 2 Apoptosis levels of prostate cancer cells RM-1 and PC3 in each group TUNEL staining ×200 |
|
图 3 各组前列腺癌细胞RM-1和PC3的凋亡水平 Figure 3 Apoptosis levels of prostate cancer cells RM-1 and PC3 in each group |
|
图 4 各组前列腺癌细胞RM-1和PC3中CD24、CD44及PSCA表达 免疫组织化学染色 ×200 Figure 4 CD24, CD44 and PSCA expression in prostate cancer cells RM-1 and PC3 in each group Immunohistochemistry ×200 |
3. 125Ⅰ-病毒复合物调节前列腺癌细胞中细胞因子的表达:125Ⅰ-病毒复合物处理后可显著降低IL-10分泌水平(t=92.71,P < 0.05),并显著升高TNF-α(t=-73.91,P < 0.05)、IFN-γ(t=-139.70,P < 0.05)、IL-2(t=-38.20,P < 0.05)分泌水平(表 2),并且125Ⅰ-病毒复合物组IL-2、IL-10、TNF-α、IFN-γ表达与125Ⅰ组和病毒复合物组差异均有统计学意义(t=-107.40~92.71,P < 0.05,表 2)。
|
|
表 2 各组前列腺癌PC-3细胞中细胞因子的表达(x±s) Table 2 Expression of cytokines in prostate cancer cells of each group (x±s) |
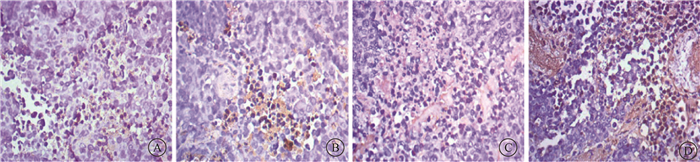
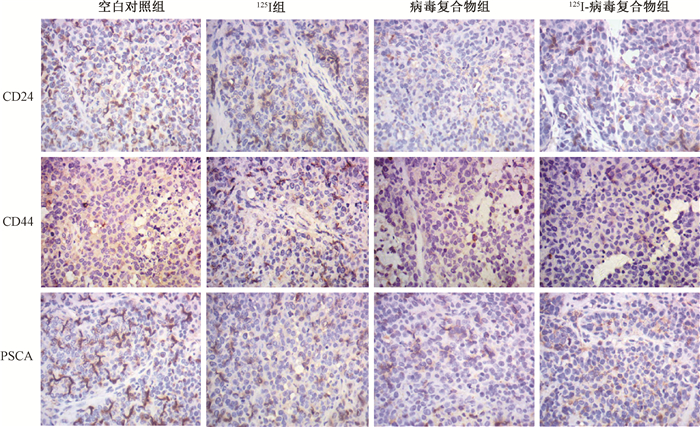
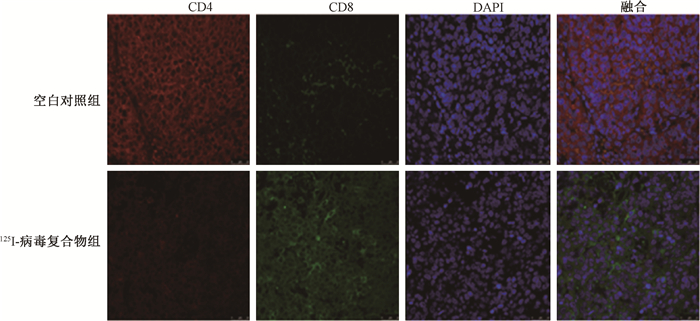
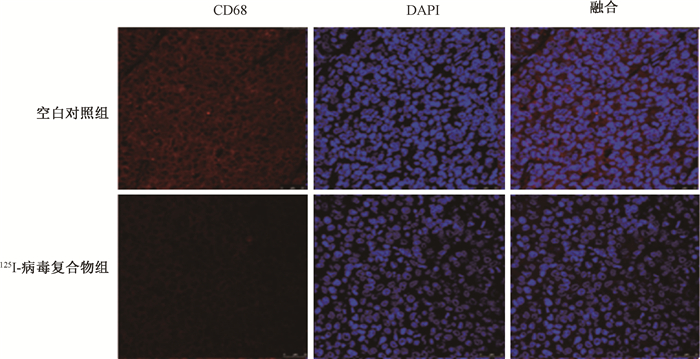
4. 125Ⅰ-病毒复合物对体内癌微环境的调节:125Ⅰ-病毒复合物可显著诱导小鼠体内肿瘤细胞凋亡,对瘤细胞起到杀伤作用(图 5,图 6),同时,125Ⅰ-病毒复合物可显著增加肿瘤组织中凋亡蛋白Caspase-3的表达(t=-23.67,P < 0.05),并显著高于125Ⅰ组(t=-11.44,P < 0.05,图 7)。同时免疫组织化学染色实验结果显示125Ⅰ-病毒复合物可以显著地降低CD24、CD44以及PSCA表达,改善癌微环境(图 8)。组织免疫荧光实验结果显示,125Ⅰ-病毒复合物组小鼠瘤组织中CD8+细胞浸润增加,CD4+细胞和巨噬细胞CD68浸润减少,调节癌组织免疫反应(图 9和10)。
|
图 5 各组小鼠瘤组织细胞的凋亡水平 TUNEL染色×400 A.空白对照组;B. 125Ⅰ组;C.病毒复合物组;D. 125Ⅰ-病毒复合物组 Figure 5 Apoptosis level of tumor cells in each group of mice TUNEL staining ×400 A. Blank control group; B. 125Ⅰ group; C. Virus complex group; D. 125Ⅰ-virus complex group |
|
图 6 各组小鼠瘤组织细胞的凋亡水平 A.空白对照组;B. 125Ⅰ组;C.病毒复合物组;D. 125Ⅰ-病毒复合物组 Figure 6 Apoptosis levels of prostate cancer cells RM-1 and PC3 in each group A. Blank control group; B. 125Ⅰ group; C. Virus complex group; D. 125Ⅰ-virus complex group |

|
注:a与空白对照组相比,t=-23.67,P < 0.05;b与125Ⅰ组相比,t=-11.44,P < 0.05 图 7 各组小鼠瘤组织中Caspase-3的表达水平及荷瘤重量 A.Caspase-3的表达水平;B.荷瘤重量 Figure 7 Expression levels of caspase-3 in mouse tumor tissues and the tumor weight of each group A. Expression levels of Caspase-3; B. Tumor weight |
|
图 8 各组小鼠瘤组织中CD24、CD44及PSCA的表达水平 免疫组织化学染色×400 Figure 8 Expression of CD24, CD44 and PSCA in mouse tumor tissue of each group Immunohistochemical staining ×400 |
|
图 9 各组小鼠瘤组织中CD4和CD8的表达水平 免疫荧光染色×800 Figure 9 Expression levels of CD4 and CD8 in mouse tumor tissues of each group Immunofluorescence staining ×800 |
|
图 10 各组小鼠瘤组织中CD68的表达水平 免疫荧光染色×800 Figure 10 Expression levels of CD68 in mouse tumor tissues of each group Immunofluorescence staining ×800 |
5. 125Ⅰ-病毒复合物调节肿瘤组织细胞因子的表达:125Ⅰ-病毒复合物处理后可显著升高前列腺癌小鼠体内TNF-α(t=-73.20,P < 0.05)、IFN-γ(t=-65.37,P < 0.05)、IL-2(t=-183.30,P < 0.05)、IL-10(t=113.80,P < 0.05)分泌水平(表 3),同时,对于IL-2、IL-10、TNF-α、IFN-γ,125Ⅰ-病毒复合物组效应均大于125Ⅰ组和病毒复合物组(t=-69.77~117.50,P < 0.05,表 3)。
|
|
表 3 各组前列腺癌小鼠血清中细胞因子的表达(x±s) Table 3 Expression of cytokines in serum of prostate cancer mice in each group (x±s) |
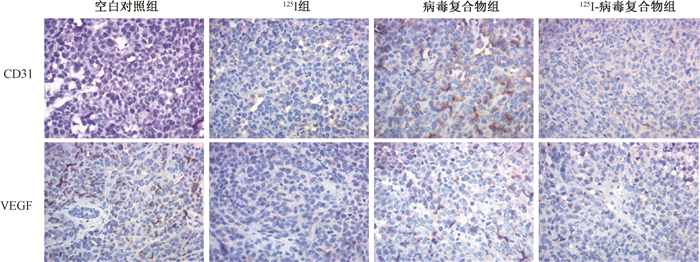
6. 125Ⅰ-病毒复合物对肿瘤组织中血管生成和荷瘤组织体积的影响:结果显示,与空白对照组小鼠(1.22±0.08)g相比,125Ⅰ-病毒复合物组小鼠(0.9±0.05)g体内肿瘤重量显著减小(t=8.55,P < 0.05)。免疫组织化学染色显示,125Ⅰ-病毒复合物可显著减少瘤组织中血管生成,并降低VEGF的表达水平,同时其效果显著高于另外两组(图 11)。
|
图 11 各组小鼠瘤组织中CD31和VEGF的表达水平 免疫组织化学染色×400 Figure 11 Expression levels of CD31 and VEGF in mouse tumor tissue of each group Immunohistochemical staining ×400 |
讨论
通过长期的临床治疗效果验证,近距离放射疗法对早期前列腺癌的治疗价值与根治性前列腺切除术相当[8]。目前来说,有3种放射性同位素可用于低剂量率(LDR)前列腺近距离放射治疗,分别为放射性同位素125Ⅰ、103Pd和131Cs。125Ⅰ通常用于LDR近距离放射治疗,辐射剂量为145 Gy或更高。125Ⅰ、103Pd和131Cs的半衰期分别为59.4、17.0和9.7 d,它们发出的平均光子能级分别为21、27和29 keV。由于103Pd的放射生物学特性,它更适合于迅速增殖的肿瘤,但考虑到半衰期、组织水肿以及临床上复发率等原因,在这几种放射性同位素中,125Ⅰ的特性最为有利,因此在前列腺癌的临床治疗中,125Ⅰ作为主要的放射性治疗元素[9]。但是对于晚期前列腺癌患者,近距离放射疗法的治疗效果一般,且该疗法的手术难度较高,人为操作因素导致的治疗效果相差较大,从而限制了该疗法的广泛应用[10]。
与目前的许多癌症治疗方案一样,单一疗法不是最佳的解决方案。为了更完整地根除肿瘤,可能需要采用基于病毒的基因疗法与化疗或放疗相结合的多模式方法[11]。从最早的关于E1A/E1B基因运输的简单腺病毒载体进入肿瘤细胞以介导体内125Ⅰ治疗[12],到晚期利用肿瘤靶向溶瘤病毒作为载体[13-14],该方法的肿瘤抑制作用已经通过许多临床研究证实。此外,一些研究人员已经进行了阶段性的临床试验,证实了这种载有放射性核素的病毒用于治疗的可行性[15]。E1A/E1B基因的优点是不仅可用于报告基因成像监测目标基因表达的可靠性和肿瘤的诊断定位,而且有利于核素治疗的125Ⅰ摄取。这一现象提示,通过诱导E1A/E1B蛋白在前列腺癌组织中吸收125Ⅰ的表达,125Ⅰ内照射治疗对前列腺癌患者,尤其是前列腺癌全身转移的患者是有益的。鉴于这种治疗方法不依赖于肿瘤对雄激素的依赖,因此对去势抵抗性前列腺癌(CRPC)患者可能是一种有效的治疗方法[16]。本研究表明,单一放射治疗或单一溶瘤腺病毒治疗对于前列腺癌治疗是不够的,其治疗效果远不如125Ⅰ-病毒复合物。通过体外和体内肿瘤增殖研究和细胞凋亡检测结果显示,结合RSOAds-hTERT/PSA基因治疗与125Ⅰ放射治疗具有最佳的肿瘤抑制作用。
肿瘤通过免疫检查站分子如程序性细胞死亡(PD)-1、PD-配体1和细胞毒性T淋巴细胞相关蛋白4的表达增加而逃脱免疫系统,从而降低CD8+T细胞活性[17]。García-Hernández等[18]的研究表明,在逐渐消失的前列腺癌的微环境中,CD8+T细胞十分丰富,而CD4+T细胞的积累减少。同样地,本研究证明125Ⅰ-病毒复合物治疗后,在肿瘤部位CD8+(而不是CD4+)淋巴细胞有明显浸润。研究表明,CD44、CD24和PSCA高表达前列腺癌细胞显示出强烈的致瘤性、克隆形成性和转移性潜能的干细胞样特性[19]。本研究发现,125Ⅰ-病毒复合物治疗后,小鼠瘤组织中CD44和CD24的表达显著减少。
总而言之,本研究证明125Ⅰ-病毒复合物可通过诱导癌细胞凋亡,抑制癌组织生长,减少癌组织中血管生成,调节癌细胞细胞因子的分泌以及CD4+、CD8+细胞和巨噬细胞浸润,降低癌细胞CD24、CD44和PSCA表达对前列腺癌发挥靶向治疗作用,改善肿瘤微环境,可为前列腺癌患者的治疗带来一定的参考以及治疗希望。
志谢 感谢徐州市科技计划项目(KC18036)对本研究的资助
利益冲突 无全体作者无学术纷争,不存在任何利益冲突
作者贡献声明 史振铎负责实验设计、实验总体实施及论文撰写;魏振宁负责实验数据整理;郝林、庞昆、周家合、董秉政、张治国、赵岩、孙玉峰负责实验操作;韩从辉负责实验指导和论文审核
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [2] |
Chen R, Sjoberg DD, Huang Y, et al. Prostate specific antigen and prostate cancer in Chinese men undergoing initial prostate biopsies compared with western cohorts[J]. J Urol, 2017, 197(1): 90-96. DOI:10.1016/j.juro.2016.08.103 |
| [3] |
Mohler JL, Kantoff PW, Armstrong AJ, et al. Prostate cancer, version 2.2014[J]. J Natl Compr Canc Netw, 2014, 12(5): 686-718. DOI:10.6004/jnccn.2014.0072 |
| [4] |
Russell SJ, Peng KW, Bell JC. Oncolytic virotherapy[J]. Nat Biotechnol, 2012, 30(7): 658-670. DOI:10.1038/nbt.2287 |
| [5] |
Benencia F, Courrèges MC, Fraser NW, et al. Herpes virus oncolytic therapy reverses tumor immune dysfunction and facilitates tumor antigen presentation[J]. Cancer Biol Ther, 2008, 7(8): 1194-1205. DOI:10.4161/cbt.7.8.6216 |
| [6] |
Satoh M, Wang H, Ishidoya S, et al. Oncolytic virotherapy for prostate cancer by E1A, E1B mutant adenovirus[J]. Urology, 2007, 70(6): 1243-1248. DOI:10.1016/j.urology.2007.09.031 |
| [7] |
Ottolino-Perry K, Diallo JS, Lichty BD, et al. Intelligent design:combination therapy with oncolytic viruses[J]. Mol Ther, 2010, 18(2): 251-263. DOI:10.1038/mt.2009.283 |
| [8] |
Fisher CM, Troncoso P, Swanson DA, et al. Knife or needles? A cohort analysis of outcomes after radical prostatectomy or brachytherapy for men with low- or intermediate-risk adenocarcinoma of the prostate[J]. Brachytherapy, 2012, 11(6): 429-434. DOI:10.1016/j.brachy.2012.04.009 |
| [9] |
Park DS. Current status of brachytherapy for prostate cancer[J]. Korean J Urol, 2012, 53(11): 743-749. DOI:10.4111/kju.2012.53.11.743 |
| [10] |
Langley S, Ahmed HU, Al-Qaisieh B, et al. Report of a consensus meeting on focal low dose rate brachytherapy for prostate cancer[J]. BJU Int, 2012, 109(Suppl 1): 7-16. DOI:10.1111/j.1464-410X.2011.10825.x |
| [11] |
Ahmed KA, Davis BJ, Wilson TM, et al. Progress in gene therapy for prostate cancer[J]. Front Oncol, 2012, 2: 172. DOI:10.3389/fonc.2012.00172 |
| [12] |
Spitzweg C, Dietz AB, O'Connor MK, et al. In vivo sodium iodide symporter gene therapy of prostate cancer[J]. Gene Ther, 2001, 8(20): 1524-1531. DOI:10.1038/sj.gt.3301558 |
| [13] |
Rajecki M, Sarparanta M, Hakkarainen T, et al. SPECT/CT imaging of hNIS-expression after intravenous delivery of an oncolytic adenovirus and 131I[J]. PLoS One, 2012, 7(3): e32871. DOI:10.1371/journal.pone.0032871 |
| [14] |
Trujillo MA, Oneal MJ, McDonough S, et al. A steep radioiodine dose response scalable to humans in sodium-iodide symporter (NIS)-mediated radiovirotherapy for prostate cancer[J]. Cancer Gene Ther, 2012, 19(12): 839-844. DOI:10.1038/cgt.2012.68 |
| [15] |
Barton KN, Stricker H, Elshaikh MA, et al. Feasibility of adenovirus-mediated hNIS gene transfer and 131I radioiodine therapy as a definitive treatment for localized prostate cancer[J]. Mol Ther, 2011, 19(7): 1353-1359. DOI:10.1038/mt.2011.89 |
| [16] |
Zhao LM, Pang AX. Iodine-131 treatment of thyroid cancer cells leads to suppression of cell proliferation followed by induction of cell apoptosis and cell cycle arrest by regulation of B-cell translocation gene 2-mediated JNK/NF-κB pathways[J]. Braz J Med Biol Res, 2017, 50(1): e5933. DOI:10.1590/1414-431X20165933 |
| [17] |
Li Z, Song W, Rubinstein M, et al. Recent updates in cancer immunotherapy:a comprehensive review and perspective of the 2018 China Cancer Immunotherapy Workshop in Beijing[J]. J Hematol Oncol, 2018, 11(1): 142. DOI:10.1186/s13045-018-0684-3 |
| [18] |
García-Hernnández M, Uribe-Uribe NO, Espinosa-González R, et al. A unique cellular and molecular microenvironment is present in tertiary lymphoid organs of patients with spontaneous prostate cancer regression[J]. Front Immunol, 2017, 8: 563-583. DOI:10.3389/fimmu.2017.00563 |
| [19] |
Patrawala L, Calhoun T, Schneider-Broussard R, et al. Highly purified CD44 prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells[J]. Oncogene, 2006, 25(12): 1696-1708. DOI:10.1038/sj.onc.1209327 |
 2020, Vol. 40
2020, Vol. 40


