2. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)放疗科, 杭州 310022;
3. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)实验研究中心, 杭州 310022
2. Department of Radiation Oncology, Cancer Hospital of University of Chinese Academy of Sciences(Zhejiang Cancer Hospital), Hangzhou 310022, China;
3. Laboratory Research Centre, Cancer Hospital of the University of Chinese Academy of Sciences(Zhejiang Cancer Hospital), Hangzhou 310022, China
放射治疗(radiotherapy, RT)可以重塑患者免疫和肿瘤微环境,以多种潜在方式激活患者的抗肿瘤免疫反应。研究表明,RT与免疫治疗相结合可以产生协同作用[1],从而增强抗肿瘤免疫反应。吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)是色氨酸(tryptophan, Trp)转化为犬尿氨酸(kynurenine, Kyn)的关键酶。由于Kyn是Trp代谢的主要代谢产物,所以血浆Kyn及Kyn ∶Trp用于监测IDO活性[2]。据报道,IDO高表达有助于肿瘤细胞逃避免疫监视[3-4],与化疗耐药性以及非小细胞肺癌(non-small cell lung cancer, NSCLC) 生存期降低有关[5\|6]。然而,目前尚不清楚早期NSCLC体部立体定向放射治疗(stereotactic body radiotherapy, SBRT)是否改变IDO介导的免疫活性,以及这些变化是否对患者的生存产生影响。本研究为回顾性研究,假设SBRT可以改变IDO活性,并最终影响NSCLC患者的生存。通过定量SBRT前后与IDO检查点相关的分子,来评估IDO介导的免疫活性。
资料与方法1. 临床资料:收集2014年12月至2017年7月间在中国科学院大学附属肿瘤医院接受SBRT治疗的早期NSCLC患者。入组标准:病理或细胞学诊断为NSCLC;所有患者均PET/CT扫描分期为T1N0M0(国际抗癌联盟UICC第7版);既往未接受过抗肿瘤治疗;美国东部肿瘤协作组(ECOG)PS评分0~2分;年龄18岁以上;确诊后同意行SBRT治疗;拒绝手术治疗或者有手术禁忌证无法行手术治疗。共30例患者入组,其中男性26例,女性4例。中位年龄为68岁(52~86岁)。患者的临床资料见表1。
|
|
表 1 30例早期非小细胞肺癌患者的临床特征 Table 1 The clinical characteristics of 30 patients with early stage non-small cell lung cancer |
2. 血清样本收集:经本院伦理委员会审批,所有NSCLC患者分别于SBRT治疗前和治疗后1周抽取空腹外周静脉血5 ml,置于促凝管中,常温下分离血清,离心半径15 cm,3 000 r/min离心15 min,将血清置于-80℃低温保存备用。
3. IDO活性检测及分析:IDO是Trp转化为Kyn的关键酶,所以利用血浆Kyn及Kyn ∶Trp比值评估IDO活性。用高效液相色谱法测定血清样本中Trp和Kyn的浓度,采用DIONEX UltiMate 3000高效液相色谱仪(美国DIONEX公司)。色谱条件:①色谱柱Thermo Hypersil GOLD 100×2.1 mm, 1.9 μm(美国赛默飞公司)。②流动相为15 mmol/L醋酸钠缓冲液(pH 4.0)和乙腈(体积比为95∶5)。③流速为0.2 ml/min。④进样量为20 μl。⑤柱温保持在25 ℃ 。⑥紫外线检测波长:Trp(278 nm),Kyn(360 nm)。样本处理及检测:从-80℃冰箱取出备用血清,置于室温待其融化后,取其中0.5 ml血清样本至EP管中,加入5%高氯酸溶液0.5 ml,盖好后在振荡器上振荡混匀2 min,室温下放置15 min,以充分沉淀血清蛋白质,然后以离心半径10 cm,10 000 r/min离心10 min,取上清液20 μl进样分析。实验重复3次,并记录这些样品的平均浓度。根据放疗后Kyn与放疗前Kyn浓度比值的中位数为截断值(1.10),将高于中位数的患者分为Kyn高水平组,而低于中位数的患者为Kyn低水平组。同理,根据放疗后Kyn ∶Trp比值的中位数为截断值,将患者分为Kyn ∶Trp高水平组和Kyn ∶Trp低水平组。
4. SBRT治疗:患者仰卧位,双手交叉置于头顶,真空垫固定,利用4DCT采集不同时相CT图像。大体肿瘤体积(GTV)为图像上可见的大体肿瘤范围。内靶区(ITV)由不同呼吸时相下勾画的GTV合并而来。计划靶区(PTV)在ITV前、后和左、右方向外放0.5 cm且上、下方向外放1.0 cm的基础上形成。根据美国国家综合癌症网络(NCCN)指南以及肿瘤部位决定处方剂量,肿瘤临近中央的患者每次分割剂量减小。给予处方剂量48~60 Gy(中位处方剂量50 Gy),每次5~12.5 Gy,4~10次照射,中位生物有效剂量(BED)为100 Gy。剂量分布要求至少95%的PTV、99%的ITV和100%的GTV达到处方剂量,至少99%的PTV达到90%的处方剂量。患者中位数GTV和PTV分别为10.0和31.5 cm3;中位平均肺剂量为3.6 Gy;中位V5、V10和V20分别为16.4%、10.4%和4.7%。
5. 随访及疗效评价:SBRT治疗期间每周对患者进行评估,并于放疗后3、6、12、18和24个月进行随访,随后每年随访1次,内容包括病史、体格检查、锁骨上淋巴结超声、胸部及上腹部CT扫描、肺肿瘤生物标志物检查。根据实体瘤的疗效评价标准(RECIST)1.1版本评价和记录肿瘤反应及复发情况。总生存(overall survival,OS)定义为从RT的第1天至死亡或末次随访日期。无进展生存(progression-free survival, PFS)定义为从RT的第1天到疾病进展、死亡或末次随访日期。
6. 统计学处理:使用SPSS 22.0统计软件进行数据分析。计量资料符合正态分布用x±s表示。使用配对t检验比较不同时间点IDO相关分子的水平。采用Kaplan\|Meier进行生存分析。Cox回归模型法评估预后因素。根据单因素分析的统计学意义将变量纳入最终的多因素分析(临界值,P<0.10)。P<0.05为差异有统计学意义。
结果1. NSCLC患者生存情况:30例患者中位随访期为37.4个月。中位PFS为37.5个月(95%CI=31.0~44.0),中位OS未达到。1、2、3、4年的PFS分别为83.3%、72.9%、57.2%和44.6%,OS分别为93.3%、83.1%、70.8%和58.1%。
2.NSCLC患者放疗前后IDO相关分子活性的动态变化:放疗前Kyn浓度(77.15±15.81)ng/ml,放疗后Kyn浓度(91.14±29.51)ng/ml,两者比较差异有统计学意义(t=-3.42, P<0.05);放疗前Kyn ∶Trp比值为(0.033 3±0.008 9),放疗后Kyn ∶Trp比值为(0.037 8±0.013 9),两者比较差异无统计学意义(P>0.05),见表2。
|
|
表 2 30例NSCLC患者放疗前后IDO相关分子活性的变化( |
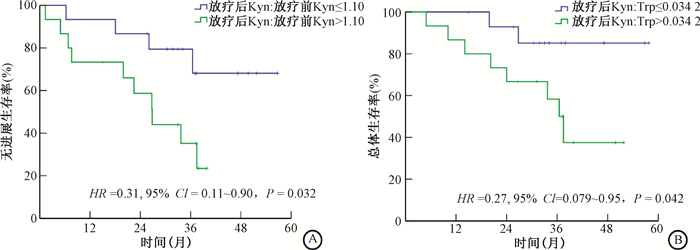
3.IDO生物标志物和患者生存的相关性:放疗后Kyn与放疗前Kyn比值较高组与比值较低组比较,比值较低组可获得更长的PFS(中位PFS: 未达到 vs. 26.8个月,HR=0.31,95%CI=0.11~0.90, P=0.032;图1A)。与放疗后Kyn ∶Trp高水平组相比,低水平组获得更长的OS(中位OS:未达到 vs. 36.5个月,HR=0.27,95%CI=0.08~0.95, P=0.042;图1B)。此外,放疗前基线Kyn或Kyn ∶Trp比值均未能预测OS或PFS的变化(P>0.05)。
|
注:Kyn.犬尿氨酸;Kyn ∶Tyn.犬尿氨酸与色氨酸比值;HR. 风险比;CI. 置信区间 图 1 IDO生物标志物与患者生存的关系 A.放疗后Kyn与放疗前Kyn不同比值组无进展生存曲线;B.放疗后Kyn∶Trp不同比值组总生存曲线 Figure 1 The relationship between IDO biomarkers and patient survival A.The progression-free survival curves of different ratio groups of Kyn after radiotherapy to Kyn before radiotherapy; B. The over all survivalcurves of different Kyn ∶Trp ratio groups after radiotherapy |
单因素分析显示,多种临床病理特征与PFS和OS显著相关(表3)。吸烟<30包/年(HR=0.23, 95% CI=0.06~0.81, P=0.023)、高生物等效剂量(BED)(HR=0.28, 95% CI=0.10~0.80, P=0.017)、放疗后Kyn与放疗前Kyn比值较低(HR=0.30, 95% CI=0.09~0.96, P=0.043)与较长的PFS相关。高BED(HR=0.11, 95% CI=0.03~0.45, P=0.002)、放疗后Kyn ∶Trp较低(HR=0.23, 95% CI=0.05~1.08,P=0.062)与较长OS相关。在多因素分析中,吸烟<30包/年(HR=0.16, 95% CI=0.03~0.84, P=0.030)、高BED(HR=0.08, 95% CI=0.02~0.33, P<0.001)、放疗后Kyn与放疗前Kyn比值较低(HR=0.23, 95% CI=0.06~0.96, P=0.043)与较长的PFS显著相关, 放疗后Kyn ∶Trp较低(HR=0.19, 95% CI=0.04~0.93, P=0.040)、高BED(HR=0.09, 95%CI=0.02~0.40, P<0.001)与较长OS显著相关(表4)。
|
|
表 3 30例非小细胞肺癌患者无进展生存率和总生存率Cox法单因素预后分析 Table 3 Univariate analysis of PFS and OS in 30 NSCLC patients using Cox estimates |
|
|
表 4 30例非小细胞肺癌患者无进展生存率和总生存率 Cox法多因素预后分析 Table 4 Multivariate analysis of PFS and OS in 30 NSCLC patients using Cox estimates |
讨论
本研究结果显示,放疗后Kyn显著增加,Kyn ∶Trp有增加趋势,但无统计学意义;放疗后Kyn ∶Trp的水平与OS显著相关;放疗后Kyn与放疗前Kyn的比值与PFS显著相关;基线IDO活性与PFS、OS无显著相关。这些结果支持目前的初步假设,即IDO介导的免疫活性可被SBRT改变。
本研究的结果表明,SBRT治疗后IDO的活性升高,其潜在机制仍不清楚。研究提示高放疗剂量可以提高肿瘤局部控制率及患者生存[7-8]。但RT剂量过高可能会损害正常组织和免疫系统[9],引起放射损伤的急性免疫反应。因此,探讨不引起过度免疫耗竭的最佳RT剂量及剂量分割方式非常重要。本研究结果提示,放疗可以改变IDO介导的免疫活性水平,但放疗剂量分割对免疫的作用在临床上尚未进行充分研究。一些研究报道了RT和免疫疗法的协同作用,为了获得最佳协同作用,已经构建了数学模型,试图确定RT 和免疫疗法组合的最佳时机[10]。例如,Chakwizira等[11]基于拟合的动物模型,开发了一个数学模型来预测最大化RT和IDO抑制剂组合的协同效应所需的RT分割次数。监测IDO介导的免疫状态可能是一种可行且实用的方法,可用于识别不同患者抗肿瘤免疫状态,并使用最佳剂量分割方法获得个性化的RT治疗,以最大程度地控制肿瘤。
本研究发现,IDO是早期NSCLC行SBRT治疗潜在的有价值的生物标志物,与先前报道IDO的免疫活性可作为化疗或免疫治疗反应的潜在预测因素的研究一致[6, 12]。Wang等[13]发现,较高的放疗后Kyn与放疗前Kyn的比值是PFS的危险因素,基线IDO活性与早期NSCLC患者的预后无显著相关,均与本研究结果一致,此外,还发现随着临床分期的增加,Kyn浓度或Kyn与Trp比值降低。这表明IDO介导的免疫状态可能随NSCLC患者的疾病阶段而异。对于早期NSCLC接受RT替代手术治疗的患者,基线IDO免疫状态可能不是决定性的预后指标,需要进一步研究以探索IDO状态与NSCLC阶段之间关系的潜在机制。
越来越多的证据表明,SBRT联合免疫抑制剂治疗具有协调作用,且患者可以耐受。Theelen等[14]研究发现接受过至少一线化疗进展的晚期NSCLC患者SBRT后免疫治疗相比单纯免疫治疗的客观缓解率(ORR)提高近2倍(18% vs. 36%, P=0.07),但治疗相关的不良反应无增加。Chicas-Sett等[15]对SBRT联合免疫检查点抑制剂治疗NSCLC的疗效和安全性进行了系统回顾,结果发现SBRT联合免疫检查点抑制剂安全性良好,与单独使用SBRT相比,局部控制率更高且更有可能出现远隔效应。由美国MD Anderson癌症中心张玉蛟教授主持的立体定向放射治疗联合Durvalumab治疗早期肺癌患者的Ⅱ期随机临床试验(NCT03148327)正在招募中,旨在观察患者生存以及疾病复发、转移情况,期待其研究结果。IDO作为免疫检查点,可能成为抗癌药物的重要靶点。Friberg等[16]研究发现在小鼠Lewis 肺癌模型中 IDO抑制药能够延缓小鼠体内肿瘤的生长。一项针对Ⅲ~Ⅳ期NSCLC患者标准化疗后疾病稳定行IDO肽疫苗治疗的试验研究(NCT01219348)获得了较好的结果,无严重不良反应[17]。多种IDO抑制剂正在进行多项临床试验[18]。SBRT联合IDO抑制剂可能成为新的肿瘤治疗方向。
改善NSCLC患者预后的可能解决方案是多学科综合治疗。但是,RT和IDO抑制剂或其他免疫治疗药物联合使用的关键问题是RT方案的优化和确定使用IDO抑制剂的最佳时间。鉴于血液生物标记物的非侵入性,其有可以在治疗过程中提供实时评估的优势[19]。血液生物标记物可用于预测癌症治疗的效果,提供可能复发的早期预警以及放疗关键危及器官的放疗耐受性[20]。本研究涉及IDO活性的血液生物标志物,可能有助于临床上指导放疗的个体化实施。
本研究仍然存在一些局限性。首先,为小样本回顾性研究,结果仍待大样本的前瞻性随机对照研究论证。其次,本研究只检测了SBRT治疗前后IDO活性。可进一步检测患者SBRT治疗期间IDO活性,动态观察IDO的变化。此外,本研究为早期NSCLC患者,单个局限性病灶,无法排除单个病灶和多个病灶、不同分期患者接受SBRT治疗后血清IDO变化的差异性,仍需扩大样本量多方面、多层地选取临床病例进行研究。
综上所述,SBRT可改变IDO介导的抗肿瘤免疫活性。本研究表明,IDO是一种潜在的重要生物标志物,可用于监测早期NSCLC患者SRRT治疗后免疫状态,对预测患者生存有一定价值。
利益冲突 无
作者贡献声明 朱瑶瑶做实验、统计分析及撰写论文;胡敏、徐清华整理数据;孙晓江收集资料、协助部分实验的完成;叶影协助统计分析;刘宇负责论文修改;冯建国指导实验;许亚萍负责研究设计
| [1] |
Weichselbaum RR, Liang H, Deng L, et al. Radiotherapy and immunotherapy:a beneficial liaison?[J]. Nat Rev Clin Oncol, 2017, 14(6): 365-379. DOI:10.1038/nrclinonc.2016.211 |
| [2] |
de Jong RA, Nijman HW, Boezen HM, et al. Serum tryptophan and kynurenine concentrations as parameters for indoleamine 2, 3-dioxygenase activity in patients with endometrial, ovarian, and vulvar cancer[J]. Int J Gynecol Cancer, 2011, 21(7): 1320-1327. DOI:10.1097/IGC.0b013e31822017fb |
| [3] |
Pallotta MT, Orabona C, Volpi C, et al. Indoleamine 2, 3-dioxygenase is a signaling protein in long-term tolerance by dendritic cells[J]. Nat Immunol, 2011, 12(9): 870-878. DOI:10.1038/ni.2077 |
| [4] |
Prendergast GC, Malachowski WJ, Mondal A, et al. Indoleamine 2, 3-dioxygenase and its therapeutic inhibition in cancer[J]. Int Rev Cell Mol Biol, 2018, 336: 175-203. DOI:10.1016/bs.ircmb.2017.07.004 |
| [5] |
Suzuki Y, Suda T, Furuhashi K, et al. Increased serum kynurenine/tryptophan ratio correlates with disease progression in lung cancer[J]. Lung Cancer, 2010, 67(3): 361-365. DOI:10.1016/j.lungcan.2009.05.001 |
| [6] |
Wang Y, Hu GF, Wang ZH. The status of immunosuppression in patients with stage Ⅲb or Ⅳ non-small-cell lung cancer correlates with the clinical characteristics and response to chemotherapy[J]. Oncol Targets Ther, 2017, 10: 3557-3566. DOI:10.2147/ott.s136259 |
| [7] |
Machtay M, Bae K, Movsas B, et al. Higher biologically effective dose of radiotherapy is associated with improved outcomes for locally advanced non-small cell lung carcinoma treated with chemoradiation:an analysis of the Radiation Therapy Oncology Group[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 425-434. DOI:10.1016/j.ijrobp.2010.09.004 |
| [8] |
Kong FM, Ten Haken RK, Schipper MJ, et al. High-dose radiation improved local tumor control and overall survival in patients with inoperable/unresectable non-small-cell lung cancer:long-term results of a radiation dose escalation study[J]. Int J Radiat Oncol Biol Phys, 2005, 63(2): 324-333. DOI:10.1016/j.ijrobp.2005.02.010 |
| [9] |
Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stageⅢa or Ⅲb non-small-cell lung cancer (RTOG 0617):a randomised, two-by-two factorial phase 3 study[J]. Lancet Oncol, 2015, 16(2): 187-199. DOI:10.1016/s1470-2045(14)71207-0 |
| [10] |
Serre R, Benzekry S, Padovani L, et al. Mathematical modeling of cancer immunotherapy and its synergy with radiotherapy[J]. Cancer Res, 2016, 76(17): 4931-4940. DOI:10.1158/0008-5472.can-15-3567 |
| [11] |
Chakwizira A, Ahlstedt J, Nittby Redebrandt H, et al. Mathematical modelling of the synergistic combination of radiotherapy and indoleamine-2, 3-dioxygenase (IDO) inhibitory immunotherapy against glioblastoma[J]. Br J Radiol, 2018, 91(1087): 20170857. DOI:10.1259/bjr.20170857 |
| [12] |
Botticelli A, Cerbelli B, Lionetto L, et al. Can IDO activity predict primary resistance to anti-pd-1 treatment in nsclc?[J]. J Transl Med, 2018, 16(1): 219. DOI:10.1186/s12967-018-1595-3 |
| [13] |
Wang W, Huang L, Jin JY, et al. A validation study on IDO immune biomarkers for survival prediction in non-small cell lung cancer:radiation dose fractionation effect in early-stage disease[J]. Clin Cancer Res, 2020, 26(1): 282-289. DOI:10.1158/1078-0432.ccr-19-1202 |
| [14] |
Theelen W, Peulen HMU, Lalezari F, et al. Effect of pembrolizumab after stereotactic body radiotherapy vs pembrolizumab alone on tumor response in patients with advanced non-small cell lung cancer:results of the pembro-rt phase 2 randomized clinical trial[J]. JAMA Oncol, 2019, 5(9): 1276-1282. DOI:10.1001/jamaoncol.2019.1478 |
| [15] |
Chicas-Sett R, Morales-Orue I, Castilla-Martinez J, et al. Stereotactic ablative radiotherapy combined with immune checkpoint inhibitors reboots the immune response assisted by immunotherapy in metastatic lung cancer:a systematic review[J]. Int J Mol Sci, 2019, 20(9): 2173. DOI:10.3390/ijms20092173 |
| [16] |
Friberg M, Jennings R, Alsarraj M, et al. Indoleamine 2, 3-dioxygenase contributes to tumor cell evasion of T cell-mediated rejection[J]. Int J Cancer, 2002, 101(2): 151-155. DOI:10.1002/ijc.10645 |
| [17] |
Kjeldsen JW, Iversen TZ, Engell-Noerregaard L, et al. Durable clinical responses and long-term follow-up of stage Ⅲ-Ⅳ non-small-cell lung cancer (NSCLC) patients treated with IDO peptide vaccine in a phase Ⅰ study-a brief research report[J]. Front Immunol, 2018, 9: 2145. DOI:10.3389/fimmu.2018.02145 |
| [18] |
Vacchelli E, Aranda F, Eggermont A, et al. Trial watch:IDO inhibitors in cancer therapy[J]. Oncoimmunology, 2014, 3(10): e957994. DOI:10.4161/21624011.2014.957994 |
| [19] |
Chen KZ, Lou F, Yang F, et al. Circulating tumor DNA detection in early-stage non-small cell lung cancer patients by targeted sequencing[J]. Sci Rep, 2016, 6: 31985. DOI:10.1038/srep31985 |
| [20] |
Wang S, Campbell J, Stenmark MH, et al. Plasma levels of IL-8 and TGF-β1 predict radiation-induced lung toxicity in non-small cell lung cancer:a validation study[J]. Int J Radiat Oncol Biol Phys, 2017, 98(3): 615-621. DOI:10.1016/j.ijrobp.2017.03.011 |
 2020, Vol. 40
2020, Vol. 40


