小肠组织自我更新迅速,对电离辐射十分敏感。全身放射性损伤以及腹盆腔局部肿瘤放疗等均可引起肠道结构和功能的损伤。目前对于放射性肠损伤的机制知之甚少,这也是未找到有效治疗手段的主要原因[1]。
Krüppel样因子5(Krüppel-like factor 5, KLF5)是KLFs家族成员之一,是进化保守的锌指蛋白转录因子,受其调控的基因可参与细胞增殖、周期、凋亡、分化、迁移和组织发育等各种生物学过程[2]。研究表明,KLF5可促进外部压力如细菌性病原体或化学诱变剂诱导的组织损伤修复[3-4],但其在放射性肠损伤中的作用尚未见报道。本课题组前期利用Cre-LoxP条件性基因编辑系统构建了肠道特异性敲低KLF5的小鼠,发现该小鼠在受到大剂量射线照射后肠组织损伤程度加重,再生隐窝数量明显下降,难以恢复[5],说明KLF5在放射性肠损伤中具有重要作用。为探讨KLF5参与放射性肠损伤修复的机制,本研究在体外培养的小肠上皮细胞株IEC-6中进一步观察了下调KLF5表达对电离辐射后细胞增殖、周期、凋亡及DNA双链断裂的影响。
材料与方法1.实验材料:大鼠小肠隐窝上皮IEC-6细胞购自中国科学院上海细胞库,DMEM培养基、胰酶消化液、双抗(青、链霉素)购自美国Hyclone公司,胎牛血清购自以色列BI公司,胰岛素购自合肥Biosharp公司,放射免疫沉淀法(RIPA)细胞裂解液、苯甲基磺酰氟(PMSF)、二喹啉甲酸(BCA)蛋白定量试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒、抗体稀释液、甘油醛-3-磷酸脱氢酶(GAPDH)小鼠单克隆抗体均购自上海碧云天生物技术有限公司,KLF5兔多克隆抗体购自美国Santa Cruz公司,Bax、Bcl-2抗体购自美国CST公司,TRIzol购自美国Invitrogen公司,PrimeScriptTM RT reagent Kit 反转录试剂盒购自日本TaKaRa公司,SYBR Green荧光实时定量PCR试剂盒购自北京天根生物科技有限公司,CCK-8试剂盒购自日本Dojindo公司,细胞凋亡检测试剂盒购自美国BD公司。
2.实验仪器:X射线生物辐照仪(RS2000,美国Rad Source公司)、多色荧光化学发光成像分析系统(Fluor Chem M,美国阿尔法科技公司)、NanoDrop(2000c,美国Thermo Fisher公司)、流式细胞仪(FACSVerse,美国BD公司)、酶标仪(Synergy 2,美国BioTek公司)、扫描型激光共聚焦显微镜(FV1200,日本Olympus公司)、荧光定量PCR仪 (ViiA7,美国Life Technologies公司)。
3.细胞培养:IEC-6细胞常规培养使用高糖DMEM完全培养基(含5%胎牛血清、0.01 mg/ml胰岛素、100 U/ml青霉素和100 μg/ml链霉素),置于37℃、含5% CO2饱和湿度的培养箱中培养,当细胞密度为80%~90%时进行细胞传代。
4.照射条件:按照X射线生物辐照仪说明书进行操作,观察电离辐射对IEC-6细胞表达KLF5的影响,给予IEC-6细胞0、2、4、8、12、16 Gy X射线照射;观察KLF5低表达对电离辐射后细胞增殖、周期、凋亡的影响,给予IEC-6细胞0和8 Gy X射线照射;观察KLF5低表达对电离辐射后DNA双链断裂的影响,给予IEC-6细胞0和2 Gy X射线照射,剂量率均为1.2 Gy/min。
5.siRNA靶点设计与合成、RNAi重组慢病毒载体的构建及鉴定、重组慢病毒的包装及滴度测定:siRNA靶点的设计与合成、RNAi重组慢病毒载体的构建及鉴定、重组慢病毒的包装及滴度测定均由上海吉凯基因化学技术有限公司完成。具体步骤如下:根据大鼠KLF5基因的mRNA序列(GeneBank number: NM_053394)设计并合成4条RNA干扰序列,同时设置RNA干扰阴性对照(negative control, NC)序列。经筛选,选择位于671~690的序列5′GCATCAACATGAACGTCTT 3′为最终干扰靶序列。合成含干扰靶序列的DNA oligo,退火配对产生双链,经AgeI和EcoRI双酶切,在T4 DNA连接酶的作用下插入GV115表达载体。然后将连接产物转入制备好的DH5ɑ感受态细胞,PCR鉴定阳性重组子后,送测序验证,测序结果经比对确认正确的克隆即为构建成功的KLF5 shRNA慢病毒载体。制备pGC-LV重组载体、pHelper 1.0和pHelper 2.0质粒,分别进行高纯度无内毒素抽提,使用Lipofectamine 2000将3种质粒共转染293T细胞,转染后8 h更换为完全培养基,继续培养40 h后,收集细胞上清液,对其浓缩后得到高滴度的慢病毒浓缩液,在293T细胞中测定并标定病毒滴度。
6.KLF5 RNAi重组慢病毒感染IEC-6细胞:取对数生长期IEC-6细胞接种于6孔板,5×104/孔,细胞30%~50%融合时加入慢病毒进行感染,16 h更换培养基,72 h后荧光显微镜下观察绿色荧光蛋白(GFP)表达情况,荧光率>80%者,待细胞长满培养板收集细胞,分别检测KLF5敲减情况。后续实验分为4组:阴性对照组、shKLF5组、单纯照射组、照射+ shKLF5组。
7.Western blot检测IEC-6细胞KLF5、Bax、Bcl-2蛋白表达:取待测细胞,用冰冷磷酸盐缓冲液(PBS)洗3次后,刮取收集细胞,加入适量放射免疫沉淀试验(RIPA)细胞裂解液(含1% PMSF)重悬细胞,超声裂解数秒;12 000 r/min,离心半径8.3 cm,4℃离心10 min,取上清,用二喹啉甲酸(BCA)蛋白定量试剂盒测定蛋白浓度;取30 μg蛋白进行SDS-PAGE,将蛋白转移到聚偏二氟乙烯(PVDF)膜上;5%脱脂奶粉室温封闭1 h;一抗(KLF5、Bax、Bcl-2)1∶1 000稀释,室温孵育4 h,以GAPDH为内参照,三羟甲基氨基甲烷-盐酸-吐温缓冲液(TBST)洗膜3次,每次10 min;二抗室温孵育1 h,TBST洗膜3次,每次10 min;电化学发光(ECL)显影,多色荧光化学发光成像分析系统进行曝光成像。
8. IEC-6细胞总RNA提取及Real-time PCR检测mRNA表达:取待测细胞加入1 ml TRIzol进行裂解后提取mRNA,用NanoDrop测定mRNA浓度。然后用PrimeScriptTM RT reagent Kit 反转录试剂盒合成cDNA第一条链,反应体系:5×缓冲液 4 μl,RT Enzyme Mix I 1 μl,Oligo dT Primer 1 μl,Random 6 mers 1 μl,总RNA 1μg,RNase Free d H2O补足20 μl,37℃ 15 min,85℃ 5 s终止反应。使用SYBR Green 荧光实时定量 PCR 试剂盒进行PCR扩增,引物序列如下:KLF5正向引物序列为5′ GAGCCTGGAAGTCCTGATAGA 3′,反向引物序列为5′ TGGCAGAGTGGCAGGTAAA 3′,扩增片段大小为123 bp;以GAPDH为内参对照,正向引物序列为5′ TTCAACGGCACAGTCAAGG 5′,反向引物序列为5′ CTCAGCACCAGCATCACC 3′,扩增片段大小为114 bp;引物由上海吉凯基因化学技术有限公司设计并合成。Real time-PCR 反应条件为95℃ 2 min,94℃ 20 s,55℃ 30 s,68℃ 30 s 40个循环。反应结束后对产物的溶解曲线进行分析,并用2-△△Ct法分析数据。
9. IEC-6细胞增殖实验:将对数生长期的IEC-6细胞用胰酶消化分散成单个细胞悬液,将细胞稀释成3×104/ml的悬液,接种于96孔板中,每孔100 μl细胞悬液。待细胞贴壁后,给予细胞8 Gy X射线照射,分别在照后1、2、3、4、5 d,向每孔加入10 μl CCK-8溶液,37℃孵育2 h后,用酶标仪测定450 nm波长处的吸光度值,每组实验设5个复孔并重复3次。
10. IEC-6细胞周期检测:取对数生长期IEC-6细胞,以每孔3×105细胞接种于6孔板内,待细胞贴壁后,给予细胞8 Gy X射线照射,继续培养24 h。预冷的PBS洗涤细胞2次,用不含乙二胺四乙酸(EDTA)的胰酶消化细胞后,分别收集4组细胞。70%冰乙醇重悬细胞,置于-20℃冰箱固定过夜。取出固定细胞,用PBS洗涤及离心后,加入1 mg/ml RNase A 和50 μg/ml 碘化丙啶(PI),室温避光染色30 min,然后上流式细胞仪检测细胞周期分布。
11. IEC-6细胞凋亡检测:取对数生长期IEC-6细胞,以每孔3×105细胞接种于6孔板内,待细胞贴壁后,给予细胞8 Gy X射线照射,继续培养48 h。预冷的PBS洗涤细胞2次,用不含EDTA的胰酶消化细胞后,分别收集4组细胞到离心管内。每个管中加100 μl 缓冲液将细胞吹打开,之后向每个离心管内加5 μl Annexin V-PE 和5 μl 7-AAD,室温避光孵育15 min,加入400 μl 缓冲液终止反应。上流式细胞仪检测上述处理样本,每个样本设置3个平行样,1 h内检测完成。
12.免疫荧光检测IEC-6细胞核内γ-H2AX 焦点(foci)形成:取对数生长期IEC-6细胞接种于事先放有细胞爬片的6孔板中,细胞密度为3×105/孔,待细胞贴壁后,采用2 Gy X射线照射细胞,照后分别在0、0.5、1、4、8、24 h,用4%多聚甲醛固定细胞。预冷的PBS洗涤细胞2次,每次5 min,每孔加入2 ml 0.5% Triton X-100溶液(PBS配制),室温处理30 min。弃破膜液,每孔加2 ml 5% BSA封闭液,室温封闭30 min。吸弃封闭液,向每个细胞爬片上滴加100 μl 兔抗γ-H2AX一抗(1∶1 000稀释),室温孵育3 h。每孔加入2 ml PBS,摇床洗涤3次,每次5 min,然后每孔加100 μl FITC 标记山羊抗兔IgG二抗(1∶1 000稀释),室温避光孵育1 h。每张玻片上滴加30 μl含DAPI抗衰减封片剂,倒置于载玻片上,使用指甲油封片。置于4℃冰箱中过夜,第2天使用扫描型激光共聚焦显微镜观察并拍照分析。
13.统计学处理:实验数据以 ±s表示,采用SPSS 16.0软件包进行统计学分析,数据符合正态分布,两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
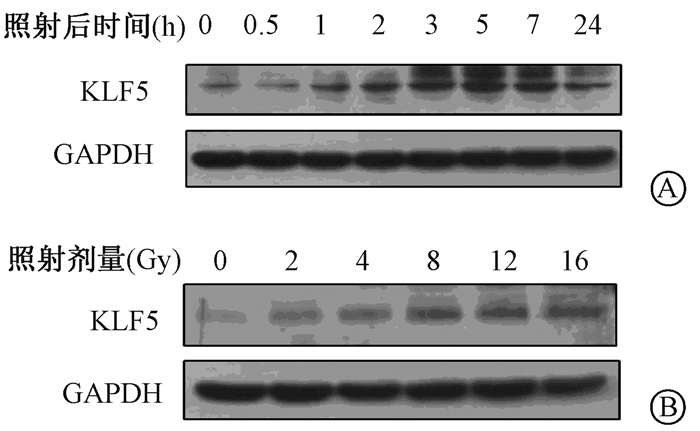
结果1. IEC-6细胞表达KLF5的改变:给予体外培养的IEC-6细胞12 Gy 照射,随着照射后时间的延长KLF5蛋白表达逐渐增加,照射后5 h达到高峰,此后逐渐下降。如图 1A所示,12 Gy照射后0.5、1、2、3、5、7、24 h KLF5蛋白的表达量分别为照后0 h的1.01、1.60、2.01、2.53、2.83、2.34、1.59倍。同时KLF5的表达与照射剂量亦呈现明显的剂量-效应关系,即随着照射剂量的增加,KLF5的表达逐渐增加。如图 1B所示,2、4、8、12、16 Gy照射后3 h KLF5蛋白的表达量分别为0 Gy照射的1.53、1.65、2.31、2.99、3.65倍。
|
注:GAPDH:甘油醛-3-磷酸脱氢酶 图 1 电离辐射对大鼠空肠隐窝上皮细胞IEC-6表达KLF5的影响 A. 12 Gy照射后不同时间IEC-6细胞KLF5蛋白表达;B.不同剂量射线照射后3 h IEC-6细胞KLF5表达 Figure 1 Expression of KLF5 protein in cultured IEC-6 cells A. IEC-6 cells were treated with 12 Gy of radiation and harvested at indicated time points; B. IEC-6 cells were treated with different doses of radiation and harvested after 3 h |
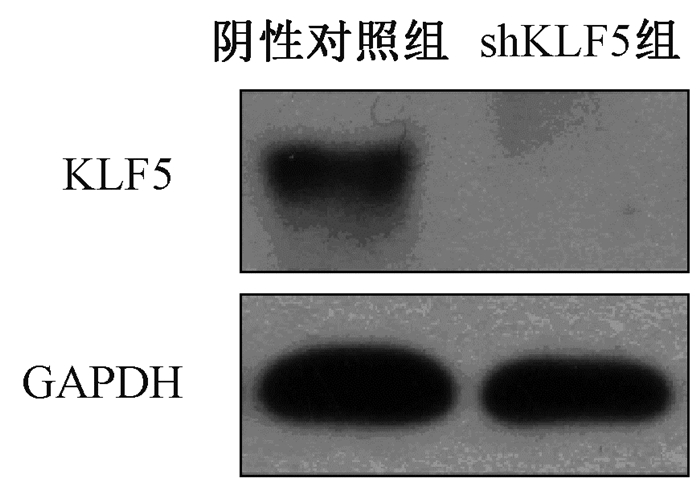
2.KLF5低表达IEC-6细胞株的建立及其表达鉴定结果:将干扰效果最好的序列构建到相应的慢病毒表达载体上。然后用含有KLF5 RNA干扰序列的慢病毒感染IEC-6细胞,达到抑制KLF5表达的目的。病毒感染效率见图2。Real-time PCR和Western blot方法检测结果显示KLF5 shRNA慢病毒感染的IEC-6细胞中KLF5mRNA(阴性对照组:1.002±0.072,shKLF5组:0.328±0.041,t=14.04,P<0.05)和蛋白(图3)表达均明显减少。

|
图 2 荧光显微镜观察KLF5 shRNA慢病毒感染效率 ×200 Figure 2 Infection efficiency of KLF5 shRNA-expressing lentivirus (shKLF5) or non-silencing control lentivirus in IEC-6 cells was monitored under fluorescence microscopy ×200 |
|
注:GAPDH:甘油醛-3-磷酸脱氢酶 图 3 Western blot方法检测shRNA慢病毒感染IEC-6细胞中KLF5的蛋白表达 Figure 3 The protein expression of KLF5in IEC-6 cells infected by shRNA lentivirus, as determined by Western blot analysis |
3.小肠上皮细胞增殖和周期的改变:与阴性对照组比较下调IEC-6细胞中KLF5的表达能明显抑制细胞的增殖能力,联合8 Gy电离辐射后细胞的存活率进一步下降(图4)。采用流式细胞术的方法进一步检测了KLF5低表达对细胞周期的影响,发现下调IEC-6细胞中KLF5的表达能将细胞阻滞在G2/M期(t=8.388,P<0.05),联合8 Gy X射线后细胞阻滞在G2/M期的现象更为明显(t=11.56,P<0.05),见表1。

|
图 4 各组细胞照射后不同时间吸光度(A450)值变化 Figure 4 Changes of absorbance(A450) of each group different time after irradiation |
|
|
表 1 KLF5低表达对电离辐射引起的小肠上皮细胞周期的影响(%, |
4.KLF5低表达对电离辐射引起的小肠上皮细胞凋亡的影响:单纯下调IEC-6细胞中KLF5的表达并不影响细胞的凋亡。阴性对照组(1.15±0.37)%与shKLF5组(0.84±0.28)%比较差异无统计学意义(P>0.05),但在给予8 Gy X射线后KLF5低表达IEC-6细胞中凋亡细胞比例明显增加。单纯照射组(7.42±0.49)%与照射 + shKLF5组(12.49±0.63)%比较差异有统计学意义(t=10.98,P<0.05)。采用Western blot方法检测凋亡相关蛋白,结果显示在给予8 Gy X射线后KLF5低表达IEC-6细胞中促凋亡蛋白Bax表达上升,抗凋亡蛋白Bcl-2表达下降(图5)。

|
注:1.阴性对照组;2.shKLF5组;3.单纯照射组;4.照射+shKLF5组 图 5 Western blot方法检测不同处理条件下IEC-6细胞中凋亡相关蛋白Bax和Bcl-2的变化 Figure 5 The expression of apoptosis associated proteins Bax and Bcl-2 in IEC-6 cells under different conditions, as determined by Western blot analysis |
5. 小肠上皮细胞DNA双链断裂的改变:结果显示,KLF5低表达能明显增加2 Gy照射后IEC-6细胞γ-H2AX焦点的数量,照后0.5 h细胞中γ-H2AX焦点的数量最多,此后逐渐下降。阴性对照组至照后24 h已恢复至照前水平,而KLF5低表达细胞即使到照后24 h仍未恢复正常(t=22.07、23.89、11.24、59.97、20.85,P<0.05;图6,表2)。

|
图 6 KLF5低表达对照射后不同时间引起的小肠上皮细胞DNA双链断裂的影响 免疫荧光 ×600 Figure 6 Effect of downregulation of KLF5 on DNA double strand breaks in IEC-6 cells post-irradiation at different time Immunofluorescence ×600 |
|
|
表 2 KLF5低表达对电离辐射后不同时间引起的小肠上皮细胞DNA双链断裂的影响( |
讨论
小肠上皮是哺乳动物体内更新最为迅速的组织之一,大约每3~5天更新1次。因此,上皮细胞尤其是隐窝内的干细胞对电离辐射高度敏感,进而导致小肠上皮细胞供应不足,绒毛脱落,隐窝萎缩或消失,黏膜结构破坏。以往研究多关注电离辐射后肠道的形态学改变,对于其发病机制的研究尚不深入。深入研究放射性肠损伤的发病机制,将有助于为电离辐射应用和辐射防护提供理论依据。
KLF5主要表达在肠隐窝底部增殖的细胞中。KLF5纯合敲除 的小鼠胚胎在8.5 d即死亡[6];KLF5杂合敲除小鼠存在先天肠道缺陷如绒毛畸形和肠纤维化,并且对葡聚糖硫酸钠(DSS)诱导的结肠炎易感[4];肠上皮特异性敲除KLF5的成年小鼠在形态学上表现出一系列形态改变,包括肠道细胞增生、屏障功能受损、炎症细胞浸润以及上皮分化和迁移缺陷等[7]。上述研究表明,KLF5在肠道组织稳定状态的维护中起十分重要的作用。
现已知多种组织损伤因素均可诱导KLF5表达,如DNA损伤因素5-氟尿嘧啶和紫外线可诱导结肠癌细胞株HCT116表达KLF5,抑制KLF5表达可使上述DNA损伤因素诱导的细胞凋亡增加[8]。此外,细菌成分脂多糖可通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路诱导大鼠空肠上皮细胞株IEC-6表达KLF5,KLF5的表达可进一步激活NF-κB信号通路,引发炎症反应[9]。体内研究表明,葡聚糖硫酸钠处理和柠檬酸细菌感染的小鼠结肠KLF5表达明显增加[3-4]。因此,KLF5被认为是应激响应基因。本研究同样观察到电离辐射可诱导KLF5的表达,且呈现明显的时间和剂量依赖关系。
研究表明,KLF5的应激表达可能参与组织的损伤修复。如给予KLF5过表达转基因小鼠DSS处理,其结肠的损伤程度明显轻于对照小鼠,同时该小鼠的恢复程度也优于对照小鼠[10]。相关机制研究提示,KLF5参与损伤修复可能通过以下途径:首先,KLF5具有促进细胞增殖的功能。在小肠隐窝中,KLF5的表达与Ki67(增殖标志物)的表达位置吻合[3]。体外实验显示,全反式维甲酸(ATRA)通过抑制KLF5表达来抑制IEC-6细胞的增殖[11];KLF5通过激活PI3K/AKT/Snail信号通路促进干细胞癌的增殖和迁移[12]。本研究结果亦表明,沉默KLF5明显抑制了IEC-6细胞的增殖,联合8 Gy X射线照射后细胞的增殖进一步受到抑制。KLF5促进细胞增殖的机制主要是加速G1/S和G2/M细胞周期进程以及上调表皮生长因子受体(EGFR)和MEK/ERK信号通路[13-15]。本研究结果显示,沉默KLF5的细胞发生了G2/M期阻滞,联合8 Gy X射线照射后G2/M期阻滞现象更明显。Wu等[16]的研究发现KLF5与细胞周期检查点蛋白CDK2互作蛋白(CINP)存在相互作用,提示其可能通过与CINP的互作影响细胞周期进程。
其次,已有研究提示KLF5具有抑制细胞凋亡的作用。在白血病细胞EU-8中,KLF5通过诱导凋亡抑制蛋白survivin 的表达抑制细胞凋亡[17]。KLF5还可以p53不依赖的方式调节凋亡。研究表明,采取RNA干扰的方法下调KLF5可使5-FU诱导的细胞凋亡增加,与BAD磷酸化减少和PIM1下调有关[18]。本研究结果显示,单纯下调细胞中KLF5的表达并不影响细胞的凋亡,但联合8 Gy X射线后凋亡细胞比例明显增加,可能与上调促凋亡蛋白Bax表达,下调抗凋亡蛋白Bcl-2表达有关。
DNA是电离辐射最为重要的靶分子。电离辐射可引起DNA多种类型的损伤,其中DNA双链断裂是最严重的DNA损害类型。γ-H2AX是非常灵敏的DNA双链断裂检测指标。本研究结果表明,shKLF5组与阴性对照组照后同一时间点细胞核内γ-H2AX 焦点数量相比均明显增多,提示下调KLF5导致辐射引起的DNA双链断裂水平增加,修复延迟。本课题组在前期工作中利用基因芯片方法发现,单纯肠道特异性敲低KLF5可使多个DNA损伤修复信号通路如核酸剪切修复、范可尼(Fanconi)贫血通路和错配修复相关基因下调,而在15 Gy照射后6 h,肠道特异性敲低KLF5小鼠小肠中DNA双链断裂修复途径非同源末端连接修复相关基因亦明显下调[5],提示下调KLF5可能通过抑制DNA损伤修复蛋白表达来抑制DNA损伤修复。Zhang等[19]的研究表明沉默KLF5表达可通过抑制检查点激酶Chk1和Chk2激活允许存在DNA损伤的细胞进入有丝分裂期,从而造成细胞发生有丝分裂灾变死亡。然而,在放射性肠损伤中KLF5参与DNA损伤修复的具体机制,仍有待进一步探讨。
综上,本研究观察了下调KLF5对电离辐射后肠道上皮细胞增殖、周期、凋亡、DNA损伤修复的影响,揭示了KLF5在放射性肠损伤中的重要作用。以上研究结果可能为放射性肠损伤的治疗提供新靶点。
志谢 感谢苏州大学 “大学生创新创业训练计划项目”(201810285046Z) 对本研究的资助
利益冲突 无
作者贡献声明 赵文玉、杨斯茗、杨志敏负责实验操作和撰写论文;肖晓棠负责数据收集和统计;尚增甫和李明负责实验设计与指导修改论文
| [1] |
李明, 曹建平, 张学光. 放射性肠损伤发病机制研究进展[J]. 中华放射医学与防护杂志, 2012, 32(4): 439-443. Li M, Cao JP, Zhang XG. Advances in pathogenesis of radiation-induced intestinal injury[J]. Chin J Radiol Med Prot, 2012, 32(4): 439-443. DOI:10.3760/cma.j.issn.0254-5098.2012.04.030 |
| [2] |
Dong JT, Chen C. Essential role of KLF5 transcription factor in cell proliferation and differentiation and its implications for human diseases[J]. Cell Mol Life Sci, 2009, 66(16): 2691-2706. DOI:10.1007/s00018-009-0045-z |
| [3] |
McConnell BB, Klapproth JM, Sasaki M, et al. Krüppel-like factor 5 mediates transmissible murine colonic hyperplasia caused by citrobacter rodentium infection[J]. Gastroenterology, 2008, 134(4): 1007-1016. DOI:10.1053/j.gastro.2008.01.013 |
| [4] |
McConnell BB, Kim SS, Bialkowska AB, et al. Krüppel-like factor 5 protects against dextran sulfate sodium-induced colonic injury in mice by promoting epithelial repair[J]. Gastroenterology, 2011, 140(2): 540-549. DOI:10.1053/j.gastro.2010.10.061 |
| [5] |
Li M, Gu Y, Ma YC, et al. Krüppel-like factor 5 promotes epithelial proliferation and DNA damage repair in the intestine of irradiated mice[J]. Int J Biol Sci, 2015, 11(12): 1458-1468. DOI:10.7150/ijbs.13444 |
| [6] |
Ghaleb AM, Nandan MO, Chanchevalap S, et al. Krüppel-like factors 4 and 5:the yin and yang regulators of cellular proliferation[J]. Cell Res, 2005, 15(2): 92-96. DOI:10.1038/sj.cr.7290271 |
| [7] |
McConnell BB, Kim SS, Yu K, et al. Krüppel-like factor 5 is important for maintenance of crypt architecture and barrier function in mouse intestine[J]. Gastroenterology, 2011, 141(4): 1302-1313, 1313.e1-6. DOI:10.1053/j.gastro.2011.06.086 |
| [8] |
Zhao Y, Hamza MS, Leong HS, et al. Krüppel-like factor 5 modulates p53-independent apoptosis through Pim1 survival kinase in cancer cells[J]. Oncogene, 2008, 27(1): 1-8. DOI:10.1038/sj.onc.1210625 |
| [9] |
Chanchevalap S, Nandan MO, McConnell BB, et al. Krüppel-like factor 5 is an important mediator for lipopolysaccharide-induced proinflammatory response in intestinal epithelial cells[J]. Nucleic Acids Res, 2006, 34(4): 1216-1223. DOI:10.1093/nar/gkl014 |
| [10] |
Tetreault MP, Alrabaa R, McGeehan M, et al. Krüppel-like factor 5 protects against murine colitis and activates JAK-STAT signaling in vivo[J]. PLoS One, 2012, 7(5): e38338. DOI:10.1371/journal.pone.0038338 |
| [11] |
Chanchevalap S, Nandan MO, Merlin D, et al. All-trans retinoic acid inhibits proliferation of intestinal epithelial cells by inhibiting expression of the gene encoding Krüppel-like factor 5[J]. FEBS Lett, 2004, 578(1-2): 99-105. DOI:10.1016/j.febslet.2004.10.079 |
| [12] |
An T, Dong T, Zhou H, et al. The transcription factor Krüppel-like factor 5 promotes cell growth and metastasis via activating PI3K/AKT/Snail signaling in hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2019, 508(1): 159-168. DOI:10.1016/j.bbrc.2018.11.084 |
| [13] |
Chen C, Benjamin MS, Sun X, et al. KLF5 promotes cell proliferation and tumorigenesis through gene regulation and the TSUP-r1 human bladder cancer cell line[J]. Int J Cancer, 2006, 118(6): 1346-1355. DOI:10.1002/ijc.21533 |
| [14] |
Nandan MO, McConnell BB, Ghaleb AM, et al. Krüppel-like factor 5 mediates cellular transformation during oncogenic KRAS-induced intestinal tumorigenesis[J]. Gastroenterology, 2008, 134(1): 120-130. DOI:10.1053/j.gastro.2007.10.023 |
| [15] |
Yang Y, Goldstein BG, Nakagawa H, et al. Krüppel-like factor 5 activates MEK/ERK signaling via EGFR in primary squamous epithelial cells[J]. FASEB J, 2007, 21(2): 543-550. DOI:10.1096/fj.06-6694com |
| [16] |
Wu Q, Fu C, Li M, et al. CINP is a novel cofactor of KLF5 required for its role in the promotion of cell proliferation, survival and tumor growth[J]. Int J Cancer, 2019, 144(3): 582-594. DOI:10.1002/ijc.31908 |
| [17] |
Zhu N, Gu L, Findley HW, et al. KLF5 interacts with p53 in regulating survivin expression in acute lymphoblastic leukemia[J]. J Biol Chem, 2006, 281(21): 14711-14718. DOI:10.1074/jbc.M513810200 |
| [18] |
Zhao Y, Hamza MS, Leong HS, et al. Krüppel-like factor 5 modulates p53-independent apoptosis through Pim1 survival kinase in cancer cells[J]. Oncogene, 2008, 27(1): 1-8. DOI:10.1038/sj.onc.1210625 |
| [19] |
Zhang H, Shao F, Guo W, et al. Knockdown of KLF5 promotes cisplatin-induced cell apoptosis via regulating DNA damage checkpoint proteins in non-small cell lung cancer[J]. Thorac Cancer, 2019, 10(5): 1069-1077. DOI:10.1111/1759-7714.13046 |
 2020, Vol. 40
2020, Vol. 40


