2. 中国科学院上海硅酸盐研究所 200050
2. Shanghai Institute of Ceremics Chinese Academy of Sciences, Shanghai 200050, China
三阴性乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌中一种侵袭性很强的亚型,占所有乳腺癌病理类型的15%~20%[1]。术后放疗是目前临床综合治疗TNBC的主要手段之一,然而部分TNBC患者放疗疗效不佳,放射抵抗是影响其疗效的重要原因[2]。因此,探寻有效的放射增敏剂以提高肿瘤放疗效果及降低放疗不良反应,是临床治疗TNBC亟待解决的重要问题。
近年来,纳米材料类放射增敏剂的研究已受到广泛关注,尤其是高原子序数(Z)的纳米材料如金纳米材料的放射增敏作用已被多项研究所证实[3-5]。MXene纳米材料是一类由过渡金属碳/氮化物组成的新型二维层状晶体材料,其超薄的结构和独特的理化性能使其在生物医学领域包括肿瘤光热/光动力治疗、MR/CT/光声成像、生物感应器和抗菌活性等方面显示出广泛的应用前景[6-10],但它在肿瘤放射增敏中的作用鲜有报道。本研究合成超薄的碳化钽(Tantalum carbide,Ta4C3)MXene纳米片,利用聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)进行表面修饰以提高其生物相容性,探究Ta4C3-PVP纳米片对人三阴性乳腺癌 MDA-MB-231细胞的放射增敏作用,为三阴性乳腺癌放射增敏剂的研究提供新途径。
材料与方法1. 主要试剂和仪器:钽粉(325目,2 μm)、铝粉(325目,7~15 μm)和碳粉(300目,<48 μm)购自美国Alfa Aesar公司,聚乙烯吡咯烷酮(PVP 40 000)购自美国Sigma公司,氢氟酸(HF)和二甲基亚砜(DMSO)购自上海国药集团化学试剂有限公司,达尔伯克改良伊格尔(DMEM)培养基购自美国Hyclone公司,胎牛血清、青-链霉素溶液以及含乙二胺四乙酸(EDTA)的0.25%胰酶均购自美国GIBCO公司,异硫氰酸荧光素酯(FITC)购自北京索莱宝科技有限公司,鼠源γH2AX抗体和兔源α-SMA抗体购自美国Abcam公司,Alexa fluor 488驴抗小鼠IgG和Alexa fluor 488驴抗兔IgG购自美国Invitrogen公司,4′,6-二脒基-2-苯基吲哚(DAPI)购自美国Santa Cruz Biotechnology公司,Cell Counting Kit(CCK-8)试剂盒购自上海翊圣生物科技有限公司,活性氧(ROS)检测试剂盒和脂质氧化(MDA)试剂盒均购自上海碧云天生物技术公司。137Cs γ辐照装置购自加拿大Nordion公司,Gamma-cell-40型,吸收剂量率为0.7 Gy/min。Synergy H1型多功能酶标仪购自美国Biotek公司,BX51型荧光显微镜购自日本Olympus公司。
2. 细胞培养及分组:人三阴性乳腺癌MDA-MB-231细胞购自中科院细胞库,用含10%胎牛血清和1%青-链霉素的DMEM培养液,置于37℃、饱和湿度、5%CO2的培养箱中培养。以下细胞内活性氧(ROS)水平检测、DNA 双链断裂(DSBs)检测、细胞内丙二醛(MDA)含量检测和有丝分裂灾难检测试验的分组均分为空白对照组、Ta4C3-PVP组、单纯照射组和Ta4C3-PVP+照射组。
3. Ta4C3-PVP的合成及表征:钽粉、铝粉和碳粉按照摩尔比4∶1.75∶3混合后球磨12 h,在智能高温烧结炉中1 500℃保温煅烧2 h,然后用40%HF蚀刻4 d,用超声粉碎机超声12 h,与PVP在65℃水浴锅中搅拌6 h,13 000 r/min、离心半径10 cm条件下离心15 min,分散于超纯水中,4℃保存。利用透射电镜检测纳米片的形貌,利用X射线晶体衍射(X-ray diffraction, XRD)检测纳米片的晶体结构,利用原子力显微镜检测纳米片的厚度,利用zeta电位分析仪检测纳米片的电势电位,利用动态光散射仪检测纳米片的水动力直径,利用ICP-OES进行Ta元素定量,用培养液稀释至一定浓度后用于以下细胞试验。
4.FITC荧光标记的Ta4C3-PVP纳米片的制备及在MDA-MB-231细胞内的摄取:取5 ml 浓度为2 mg/ml的Ta4C3-PVP乙醇溶液,加入10 μl含10 mg/ml FITC的DMSO溶液,于4℃避光孵育24 h,然后离心15 min(13 000 r/min,离心半径10 cm),用乙醇洗1次后分散于DMEM培养液中,调整浓度为100 μg/ml后与细胞共同孵育4 h,然后用DAPI染核,在荧光显微镜下观察拍照。
5. CCK-8法检测Ta4C3-PVP对细胞的毒性:取对数生长期的MDA-MB-231细胞,接种于96孔板中,过夜贴壁后更换含不同浓度Ta4C3-PVP的培养液,共同孵育4 h后更换新鲜培养液,继续培养24或48 h。弃培养液,加入含10% CCK-8的培养液,100 μl/孔,37℃培养2.5 h后每孔取出80 μl,用酶标仪于450 nm处测定吸光度(A450)值。相对细胞活力=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
6. 克隆形成实验检测放射敏感性:取对数生长期的MDA-MB-231细胞,接种于6孔板中,过夜贴壁后更换含50和100 μg/ml的Ta4C3-PVP的培养液,孵育4 h后给予0、2、4和6 Gy γ射线照射,用0.25%胰酶消化后制成单细胞悬液,稀释成不同细胞浓度接种于6孔板中,继续培养12 d,弃培养液,用甲醇固定20 min,弃液后用0.25%结晶紫染色液染色20 min。镜下计数≥50个细胞的克隆数目。以0 Gy处理组数据计算集落形成率(plating efficiency,PE,%)=克隆数/接种细胞数×100%,每组的存活分数(surviving fraction,SF,%)=克隆数/接种细胞数×PE。以单击多靶模型拟合细胞存活曲线,计算放射生物学参数D0、Dq、SF2和放射增敏比(sensitization enhancement ratio,SERD0)。
7. ROS检测试剂盒检测细胞内ROS水平:取对数生长期的MDA-MB-231细胞,接种于96孔板中,过夜贴壁后更换含100 μg/ml Ta4C3-PVP的培养液,共同孵育4 h后给予8 Gy γ射线照射,照后2和12 h弃培养液,加入含10 μmol/L DCFH-DA荧光探针的无血清培养液,37℃培养箱内孵育20 min后,用磷酸盐缓冲液(PBS)洗3次,用荧光酶标仪检测荧光强度(激发波长为488 nm,发射波长为525 nm)。相对荧光强度=(实验孔荧光强度-空白孔荧光强度)/(对照孔荧光强度-空白孔荧光强度)×100%。
8. DNA DSBs检测:取对数生长期的MDA-MB-231细胞接种于3孔浓缩器中,过夜贴壁后,更换含100 μg/ml Ta4C3-PVP的培养液,共同孵育4 h后给予2 Gyγ射线照射,照射后1、4和8 h加入4%多聚甲醛溶液室温固定15 min,弃上清PBS洗2次,加入0.1% Triton X-100室温通透15 min,弃上清用PBS洗2次,加入10%小牛血清在37℃封闭2 h,弃上清加入γH2AX(p S139)一抗4℃孵育过夜,弃上清PBS洗2次,加入荧光二抗室温孵育2 h,弃上清PBS洗2次,DAPI染核,封片后在荧光显微镜下观察拍照。随机计数100个细胞,计算细胞核内含≥5个荧光焦点的阳性细胞比例。
9. 脂质氧化(MDA)检测试剂盒检测细胞内MDA含量:取对数生长期的MDA-MB-231细胞接种于6孔板中,过夜贴壁后更换含100 μg/ml Ta4C3-PVP的培养液,共同孵育4 h后给予8 Gy γ射线照射,照射后24和48 h收集细胞并裂解提蛋白,用BCA试剂盒测定蛋白浓度。取100 μl裂解液,加入200 μl MDA检测工作液,混匀后沸水浴加热15 min,冷却至室温后,3 000 r/min,离心半径10 cm,离心10 min,取200 μl上清液加入到96孔板中,用酶标仪检测525 nm处吸光度(A525)值。根据标准曲线计算细胞样品中MDA的摩尔浓度,通过每mg蛋白含量来表示细胞样品中的MDA含量。
10.免疫荧光法检测有丝分裂灾难形成:取对数生长期的MDA-MB-231细胞,接种于3孔浓缩器中,过夜贴壁后更换含100 μg/ml Ta4C3-PVP的培养液,共同孵育4 h后给予8 Gy γ射线照射,72 h后用4%多聚甲醛固定细胞15 min,PBS洗2次后,用0.5% Triton X-100通透15 min,PBS洗2次后,用10%小牛血清于37℃封闭2 h,弃液后加入α-SMA一抗4℃孵育过夜,PBS洗2次后,加入荧光二抗室温孵育2 h,弃液后用PBS洗2次,DAPI染核,封片后在荧光显微镜下观察,随机计数100个细胞,计算含≥3个核的细胞比例。
11. 统计学处理:采用Graphpad Prism 5软件进行统计分析,并通过单击多靶模型拟合细胞存活曲线。数据以
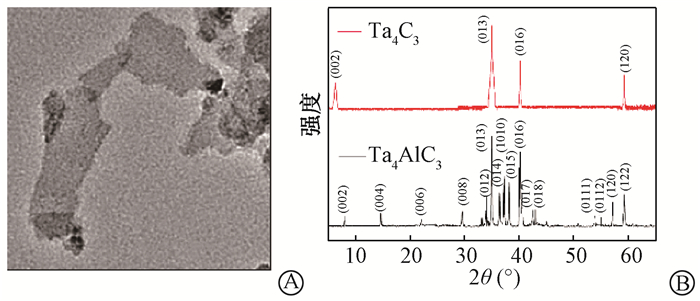
1. Ta4C3-PVP的表征:合成的Ta4C3纳米片(MXene)采用透射电镜观察呈薄片形貌,见图1 A。XRD检测显示见图1B。Ta4AlC3经40%氢氟酸刻蚀后,(002)峰增宽,并向低角度2θ移动,是典型MXene的特征;(013)峰、(016)峰以及(120)峰均是Ta4C3的特征衍射峰;此外,30°至60°之间多个峰消失,表明已成功刻蚀去掉Al元素。原子力显微镜检测其厚度约为1.35 nm。Ta4C3通过PVP修饰后,zeta电位的绝对值比单独Ta4C3增高,从(-39.33±2.08)增加至(-26.00± 4.00)mV,表明Ta4C3-PVP水溶液比Ta4C3更加稳定。动态光散射仪检测Ta4C3-PVP纳米片的平均水动力直径为(143.93±2.82)nm,均一性良好。
|
图 1 Ta4C3-PVP纳米片的表征 A. Ta4C3纳米片的透射电镜照片 ×720 000;B.Ta4AlC3和Ta4C3的X射线晶体衍射图 Figure 1 Characterization of Ta4C3-PVP nanosheets A. Transmission electron micrograph images of Ta4C3 nanosheets ×720 000; B. XRD patterns of Ta4AlC3 ceramics and Ta4C3 nanosheets |
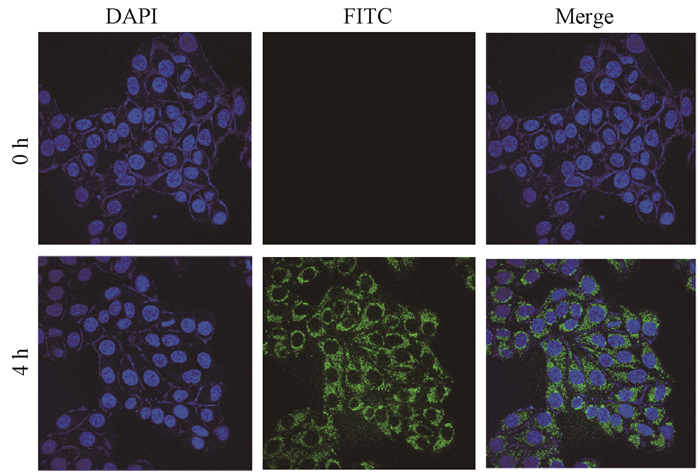
2.Ta4C3-PVP被细胞摄取的情况:FITC荧光标记的Ta4C3-PVP纳米片与MDA-MB-231细胞共同孵育4 h后,可见荧光分布于胞质中,表明Ta4C3-PVP纳米片被MDA-MB-231细胞所摄取,且主要分布于胞质中(图2)。
|
注:DAPI.4′,6-二脒基-2-苯基吲哚染色的荧光图;FITC.异硫氰酸荧光素酯的荧光图;Merge.DAPI和FITC的融合图 图 2 Ta4C3-PVP纳米片在MDA-MB-231细胞中的摄取情况×600 Figure 2 The uptake of Ta4C3-PVP nanosheets in MDA-MB-231 cells ×600 |
3. Ta4C3-PVP的细胞毒作用:不同浓度(0 ~ 400 μg/ml)的Ta4C3-PVP分别处理MDA-MB-231细胞24和48 h后,CCK-8法检测显示各浓度的Ta4C3-PVP组与空白对照组细胞的活力比较差异均无统计学意义(P>0.05),表明浓度400 μg/ml的 Ta4C3-PVP对MDA-MB-231细胞无明显的细胞毒作用。
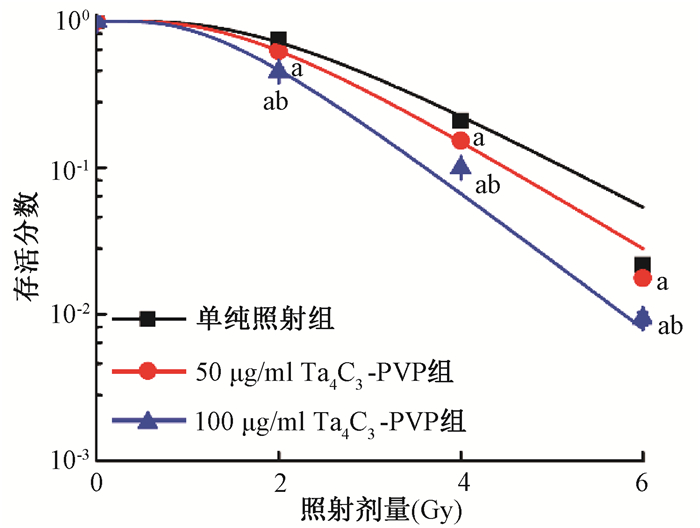
4. Ta4C3-PVP对受照射MDA-MB-231细胞放射敏感性的影响:细胞克隆形成试验显示,50和100 μg/ml Ta4C3-PVP预处理均可使2、4和6 Gy受照细胞的存活分数较单纯照射组明显下降,差异均有统计学意义(q=17.11、14.35、27.59,P<0.05;q=34.68、23.46、37.35,P<0.05),而且100 μg/ml Ta4C3-PVP预处理使2、4和6 Gy受照细胞的存活分数较50 μg/ml Ta4C3-PVP组均明显降低(q=17.57、9.109、9.769,P<0.001),见图3。采用单击多靶模型拟合存活曲线计算所得放射敏感性参数见表1,50和100 μg/ml Ta4C3-PVP预处理的SERD0值分别为1.21和1.45,表明Ta4C3-PVP对MDA-MB-231细胞具有明显的放射增敏作用。
|
注:a与单纯照射组比较,q=17.11、34.68、14.35、23.46、27.59、37.35,P<0.05;b与50 μg/ml Ta4C3-PVP+照射组比较,q=17.57、9.109、9.769,P<0.05 图 3 各组MDA-MB-231细胞照射后的存活曲线 Figure 3 Survival curves of irradiated MDA-MB-231 cells in each group |
|
|
表 1 各组MDA-MB-231细胞放射敏感性参数的变化( |
5. Ta4C3-PVP对受照射MDA-MB-231细胞ROS水平的影响:与空白对照组比较,100 μg/ml Ta4C3-PVP组细胞内ROS未增加;8 Gy γ射线照射后12 h,单纯照射组细胞内ROS比空白对照组显著增加(q=29.23,P< 0.05);8 Gy γ射线照射后2和12 h,Ta4C3-PVP+照射组细胞内ROS比相应的单纯照射组显著增加,差异均有统计学意义(q=20.01、7.193,P< 0.05),表明Ta4C3-PVP具有显著提高辐射诱导的细胞内ROS水平的作用。见表2。
|
|
表 2 各组MDA-MB-231细胞照射后不同时间活性氧的
相对荧光强度( |
6. Ta4C3-PVP对受照射MDA-MB-231细胞DNA DSBs的影响:由表3可见,单独给予100 μg/ml Ta4C3-PVP处理的MDA-MB-231细胞γH2AX焦点产额(Ta4C3-PVP+照射组的0 h)与空白对照组(单纯照射组的0 h)相比无明显增加;给予2 Gy γ射线照射后1、4和8 h,γH2AX焦点产额较空白对照组均显著增加,差异有统计学意义(q=51.85、26.02、6.848,P<0.05),但 随照射后时间的延长而下降;Ta4C3-PVP+照射组于照射后各时间点的γH2AX焦点产额均显著高于单纯照射组(q=36.78、14.87、8.217,P<0.05),表明Ta4C3-PVP加重了辐射诱导的DNA DSBs。
|
|
表 3 两组MDA-MB-231细胞于照射后不同时间含≥5个γH2AX焦点的阳性细胞率(%, |
7. Ta4C3-PVP对受照射MDA-MB-231细胞MDA含量的影响:与空白对照组比较,单独给予100 μg/ml Ta4C3-PVP处理未引起细胞MDA含量的增加;给予8 Gy γ射线照射后24和48 h,可诱导MDA含量较空白对照组显著增加(q=13.77、28.49,P< 0.05);Ta4C3-PVP+照射组MDA含量于照射后24和48 h均显著高于相应的单纯照射组(q=14.02、7.02,P<0.01),表明Ta4C3-PVP加重了辐射诱导的脂质氧化作用。见表4。
|
|
表 4 各组MDA-MB-231细胞照射后不同时间的MDA含量(nmol/mg蛋白, |
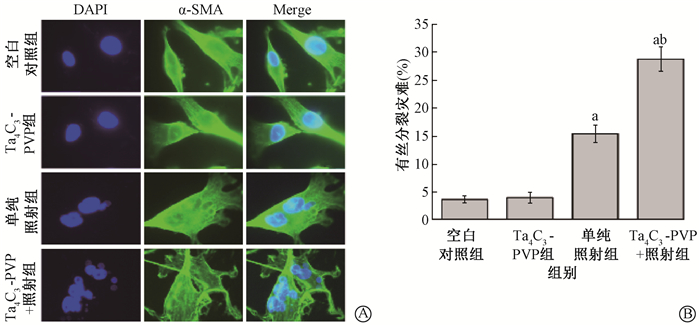
8. Ta4C3-PVP对受照射MDA-MB-231细胞的有丝分裂灾难的影响:如图4A所示,空白对照组和Ta4C3-PVP组主要为含有单个核的细胞,而单 纯照射组和Ta4C3-PVP+照射组显示含有≥3个核的细胞。由图4B可见,单独给予100 μg/ml Ta4C3-PVP处理未引起细胞有丝分裂灾难的 增加,给予8 Gy γ射线照射后72 h,单纯照射组、Ta4C3-PVP+照射组细胞的有丝分裂灾难比例均比空白对照组增加(q=14.29、30.62,P<0.05),而Ta4C3-PVP+照射组有丝分裂灾难的比例又显著高于单纯照射组(q=16.33,P<0.05)。
|
注:DAPI.4′,6-二脒基-2-苯基吲哚染色的荧光图;α-SMA.α平滑肌肌动蛋白染色的荧光图;Merge.DAPI和α-SMA的融合图;a与空白对照组比较,q=14.29、30.62,P<0.05;b与单纯照射组比较,q=16.33,P<0.05 图 4 Ta4C3-PVP对受照射MDA-MB-231细胞有丝分裂灾难的影响 A.免疫荧光染色 ×10 000;B.各组细胞有丝分裂灾难的统计图 Figure 4 Effects of Ta4C3-PVP on mitotic catastrophe in irradiated MDA-MB-231 cells A. Images of immunofluorescent staining ×10 000; B. Statistical results of mitotic catastrophe for each group |
讨论
高原子序数(Z)金属纳米材料对辐射能量的沉积效应使其在肿瘤放射增敏中的作用日益受到研究者们的重视[3-5],其放射增敏作用的主要原理是它具有比软组织更强的吸收射线能量的能力,当射线撞击高Z纳米材料时,高Z原子能够吸收更多的光子,随之光子与高Z纳米材料相互作用产生康普顿效应和光电效应等,发射出各种次级电子如光电子、康普顿电子和俄歇电子,从而增加肿瘤细胞的受照剂量,提高辐射诱导的细胞死亡[5]。近年来,广泛应用于骨再生材料的Ta纳米材料因Ta为高原子序数(Z=73)金属元素且X射线衰减系数较高,在肿瘤放射增敏中的作用亦备受关注。有研究报道,介孔mTa2O5-PEG纳米粒及中空的TaOx-PEG纳米球对小鼠乳腺癌具有一定的放射增敏作用,并可作为药物载体对小鼠乳腺癌放化疗起到协同增效作用[5,11-12]。二维的MXene纳米片是从三元的Mn+1AXn相(M是早期过渡金属元素,A是A族元素,X是C或N元素)中蚀刻去掉A层金属制备而成的一类新型超薄二维纳米材料,其独特的理化性能使其在生物医学研究领域得以迅猛发展[6],其中Ta4C3MXene纳米片的光热转换系数和X射线衰减系数优于其他MXene材料,使其在肿瘤光热/光动力治疗和CT成像中显示出良好的效果[6-9],但在肿瘤放射增敏领域尚未见相关报道。
本研究采用体外细胞克隆形成试验证实,无毒浓度(100 μg/ml)的Ta4C3-PVP纳米片能有效抑制TNBC MDA-MB-231细胞对辐射所致亚致死损伤的修复及细胞增殖,具有明显的放射增敏作用。目前认为,电离辐射杀伤肿瘤细胞这一生物学作用的物理和化学基础,一是射线能量直接被生物分子如脂质、蛋白质尤其是DNA吸收致其损害的直接作用,二是在水介质中诱导ROS生成并损伤DNA等生物分子的间接作用。根据高原子序数Ta的增加射线能量沉积作用和MXene纳米片超薄的结构特性,由此推测Ta4C3-PVP纳米片具有增强电离辐射的直接作用和间接作用的能力。本研究检测到Ta4C3-PVP纳米片能显著提高辐射诱导MDA-MB-231细胞内的ROS生成,导致受照细胞内DNA和脂质分子损伤更为严重,表现为Ta4C3-PVP+照射组的DSBs分子标志物γH2AX焦点产额和脂质氧化产物MDA水平均显著高于单纯照射组,有研究表明MDA继而还能进一步影响蛋白质的功能[13-14],而Ta4C3-PVP纳米片自身并未引起细胞内ROS水平的变 化以及DNA和脂质分子损伤,表明Ta4C3-PVP纳米片具有良好的提高射线能量沉积的作用。有丝分裂灾难是有丝分裂过程失调引起的一种细胞死亡形式,其最突出的形态特征是多核的形成,它也是辐射诱导细胞死亡的主要方式之一[15]。本研究观察到Ta4C3-PVP纳米片能明显提高受照射MDA-MB-231细胞的有丝分裂灾难,可能与其加重辐射诱导的DNA 损伤、使DNA损伤的细胞未经修复便过早进入有丝分裂中期导致染色体分离错误、进而引起有丝分裂灾难有关[15]。
综上所述,本研究证实Ta4C3-PVP纳米片通过提高受照射MDA-MB-231细胞内ROS水平,导致辐射诱导的DNA损伤和脂质过氧化损伤加重,从而增加了辐射诱导的有丝分裂灾难,提高了MDA-MB-231细胞的放射敏感性。本研究为二维Ta4C3 MXene纳米材料在放射增敏领域的应用提供了实验依据,但还有待于进一步采用体内实验加以验证。
利益冲突 全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益
作者贡献声明 尹俊进行实验、数据处理及撰写论文;李欣悦、张旭霞、王梦梦协助实验进行;陈雨、陈红红指导实验和论文修改
| [1] |
Kumar P, Aggarwal R. An overview of triple-negative breast cancer[J]. Arch Gynecol Obstet, 2016, 293(2): 247-269. DOI:10.1007/s00404-015-3859-y |
| [2] |
He MY, Rancoule C, Rehailia-Blanchard A, et al. Radiotherapy in triple-negative breast cancer:current situation and upcoming strategies[J]. Crit Rev Oncol Hematol, 2018, 131: 96-101. DOI:10.1016/j.critrevonc.2018.09.004 |
| [3] |
Xie J, Gong L, Zhu S, et al. Emerging strategies of nanomaterial-mediated tumor radiosensitization[J]. Adv Mater, 2019, 31(3): 1802244. DOI:10.1002/adma.201802244 |
| [4] |
Song G, Cheng L, Chao Y, et al. Emerging nanotechnology and advanced materials for cancer radiation therapy[J]. Adv Mater, 2017, 29(32): 1700996. DOI:10.1002/adma.201700996 |
| [5] |
Brown R, Tehei M, Oktaria S, et al. High-Z nanostructured ceramics in radiotherapy:first evidence of Ta2O5-induced dose enhancement on radioresistant cancer cells in an MV photon field[J]. Part Part Syst Char, 2014, 31(4): 500-505. DOI:10.1002/ppsc.201300276 |
| [6] |
Lin H, Chen Y, Shi J. Insights into 2D MXenes for versatile biomedical applications:current advances and challenges ahead[J]. Adv Sci(Weinh), 2018, 5(10): 1800518. DOI:10.1002/advs.201800518 |
| [7] |
Lin H, Wang YW, Gao SS, et al. The ranostic 2D tantalum carbide (MXene)[J]. Adv Mater, 2018, 30(4): 1703284. DOI:10.1002/adma.201703284 |
| [8] |
Dai C, Chen Y, Jing X, et al. Two-dimensional tantalum carbide (mxenes) composite nanosheets for multiple imaging-guided photothermal tumor ablation[J]. ACS Nano, 2017, 11(12): 12696-12712. DOI:10.1021/acsnano.7b07241 |
| [9] |
Liu Z, Lin H, Zhao M, et al. 2D superparamagnetic tantalum carbide composite mxenes for efficient breast-cancer theranostics[J]. Theranostics, 2018, 8(6): 1648-1664. DOI:10.7150/thno.23369 |
| [10] |
Tang W, Dong Z, Zhang R, et al. Multifunctional two-dimensional core-shell mxene@gold nanocomposites for enhanced photo-radio combined therapy in the second biological window[J]. ACS Nano, 2019, 13(1): 284-294. DOI:10.1021/acsnano.8b05982 |
| [11] |
Song G, Chao Y, Chen Y, et al. All-in-one the ranostic nanoplatform based on hollow TaOx for chelator-free labeling imaging, drug delivery, and synergistically enhanced radiotherapy[J]. Adv Funct Mater, 2016, 26(45): 8243-8254. DOI:10.1002/adfm.201603845 |
| [12] |
Chen Y, Song G, Dong Z, et al. Drug-loaded mesoporous tantalum oxide nanoparticles for enhanced synergetic chemoradiotherapy with reduced systemic toxicity[J]. Small, 2017, 13(8): 1602869. DOI:10.1002/smll.201602869 |
| [13] |
Del Rio D, Stewart AJ, Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J]. Nutr Metab Cardiovasc Dis, 2005, 15(4): 316-328. DOI:10.1016/j.numecd.2005.05.003 |
| [14] |
Gęgotek A, Skrzydlewska E. Biological effect of protein modifications by lipid peroxidation products[J]. Chem Phys Lipids, 2019, 221: 46-52. DOI:10.1016/j.chemphyslip.2019.03.011 |
| [15] |
Eriksson D, Stigbrand T. Radiation-induced cell death mechanisms[J]. Tumour Biol, 2010, 31(4): 363-372. DOI:10.1007/s13277-010-0042-8 |
 2020, Vol. 40
2020, Vol. 40


