据统计,脑转移瘤发生在10%~40%的癌症患者当中[1]。自伽玛刀发明以来,颅内立体定向放疗(SRT)已经成为治疗脑转移瘤的常规手段[2]。近年来,随着容积调强弧形治疗(VMAT)技术的发展,其也被应用于颅内SRT放疗中[3]。与传统大多采用多中心的SRT治疗技术相比,VMAT仅使用单中心治疗就可以达到高度适形的剂量分布,提高了治疗效率[4]。对于SRT技术,其对靶区剂量分布的均匀性要求不高。因此,处方等剂量线(IDL)的选择影响着SRT计划的剂量分布。研究表明,对于基于直线加速器的颅内SRT治疗,最优的IDL在50%~70%之间[5-6]。对于立体定向拉弧(S_ARC),其可以通过改变多叶准直器(MLC)的边界来得到不同IDL的计划。但对于VMAT,MLC随着机架的旋转动态调整,没有固定的外扩边界。因此,对于VMAT计划,一般只能通过改变其优化条件来实现IDL的调整,但该方法无法直接得到指定的IDL,需要进行多次优化迭代。本研究提出了一种用于优化SRT-VMAT计划IDL的方法,其通过使用靶区(PTV)内收一定边界生成新靶区来进行计划设计,从而实现对IDL的调整。
资料与方法1.病例选取:选取8例脑转移瘤病例,患者年龄48~70岁(中位年龄63岁)。靶区体积大小3.45~11.71 cm3(中位数6.32 cm3)。其中 < 4 cm3的3例,>10 cm3的1例。病灶解剖位置位于额叶(3例)、颞叶(2例)、顶叶(1例)、枕叶(1例)以及小脑(1例)。
2.计划设计:为了方便比较,所有计划均给予同一处方剂量进行优化,即总量50 Gy分10次。采用荷兰飞利浦公司Pinnacle(v9.1)治疗计划系统,美国瓦里安公司Edge加速器,MLC宽度为2.5 mm。由于单次分割剂量较大,选取6 MV X射线无均整器(FFF)模式,输出剂量率为1 400 MU/min。对于所有计划,根据肿瘤所在位置以及就近布野的原则选择适当的弧度并采用往返双弧设计,剂量计算的网格精度为0.2 mm。对每一个靶区,都按以下步骤设计IDL不同的多个计划。第一步,对所有靶区,在Pinnacle计划系统的优化器中分别给予PTV相同的优化条件,并限制距PTV 2 cm处的最大剂量(一般为处方剂量的25%)。其他危及器官的限制条件保持一致,且均在临床限量可接受范围内。通过逆向优化得到一个参考计划。第二步,将PTV通过三维内收边界生成新的靶区,每间隔1 mm生成一个新的靶区。由于体积的限制,对于4 cm3以下的靶区一般最多可以内收4 mm,10 cm3以上靶区可以内收7 mm。基于参考计划,保持所有优化参数不变,将优化条件中的原PTV替换为新的内收靶区进行重新优化,并将处方剂量归一到可以覆盖98%的PTV。第三步,计算每个计划的IDL(处方剂量与靶区内的最大剂量之比),并统计每个PTV达到最优IDL范围所需内收的最小边界。
3.计划评价:将达到最优IDL范围最小内收边界靶区进行优化得到的计划与每个PTV的参考计划比较。主要的评价指标为梯度指数(GI),定义为50%处方剂量所包绕的体积与处方剂量所包绕的体积之比[7],GI值越小则表示剂量跌落越快。同时,评价靶区的适形度指数,采用Paddick[8]公式:
| $ CI=TV_{\rm PV}^{2}/(TV×PV) $ |
式中,TVPV为处方剂量所包绕的PTV体积,TV为靶区PTV的体积,PV为处方剂量所包绕的体积。对于正常脑组织,对V40、V30、V20、V10、V5以及其平均剂量Dmean进行比较。
4.统计学处理:利用SPSS 17.0软件对不同的计划数据进行正态分布检验。符合正态分布的数据用x±s表示,采用配对t检验,不符合正态分布的采用Wilcoxon符号秩检验。P < 0.05为差异有统计学意义。
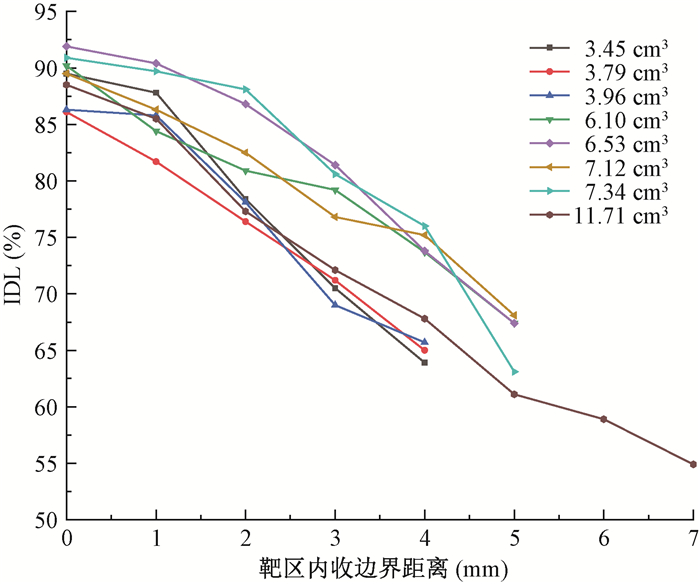
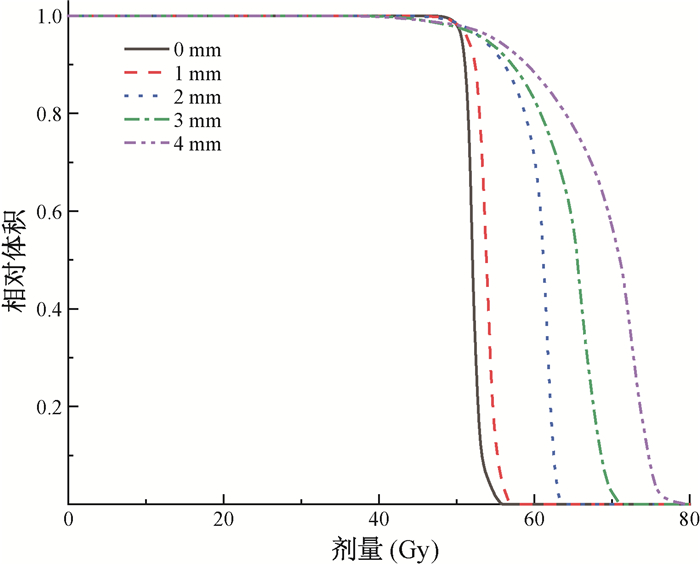
结果1. IDL随内收边界的变化:图 1为所有靶区的IDL随内收边界的变化。可以看出,IDL随着内收边界的增大而下降。内收边界为0 mm的计划即PTV没有内收得到的参考计划。图 2显示,内收不同边界PTV的剂量分布不同,随着内收边界的增加,PTV内的最大剂量增加,均匀性下降。
|
图 1 不同体积靶区IDL随靶区内收边界距离的变化(内收0 mm代表采用原靶区进行计划设计) Figure 1 IDLs of different target volumes vary with the distance of margin contracted (0 mm represents planning with original target volume) |
|
图 2 不同内收边界的靶区优化得到的PTV剂量体积直方图 Figure 2 Dose volume histograms of PTV with variable contracted margins |
2.达到最优IDL范围所需内收的最小边界:从图 1可以看出,所有靶区达到最优IDL范围(50%~70%)所需内收的最小边界均为4或5 mm,其平均IDL为(66.05±0.02)%。其中 < 4 cm3的靶区,其所需内收的最小的边界均为4 mm。
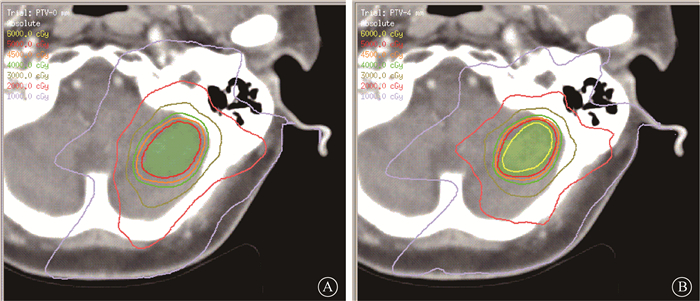
3.GI指数的比较:达到最优范围IDL的最小边界得到的计划与参考计划相比,其平均GI值从4.05±0.39下降到3.37±0.24,下降了20%,其差异有统计学意义(Z=-2.521,P < 0.05)。图 3显示了1例靶区内收4 mm优化生成的计划与其参考计划的剂量分布对比,可以看到内收边界的计划其剂量跌落速度更快。
|
图 3 参考计划(A)和PTV内收4 mm优化得到的计划(图B)剂量分布对比 Figure 3 Comparison of dose distribution of reference plan (A)and plan optimized with PTV contracting 4 mm (B) |
4.正常脑组织中剂量的比较:表 1显示了最优IDL范围计划与其参考计划正常脑组织中受量的平均值对比。和参考计划相比,最优IDL计划其正常脑组织中V40、V30、V5以及平均剂量分别下降了11.5%(Z=-1.973,P < 0.05)、7.2%(Z=-2.105,P < 0.05)、12.8%(Z=-2.521,P < 0.05)以及8.1%(Z=-2.382,P < 0.05),V20、V10以及无明显差异(P>0.05)。靶区适形度指数(CI)无明显变化(P>0.05)。
|
|
表 1 8例脑转移瘤病例正常脑组织中的剂量学参数比较(x±s) Table 1 Comparison of dosimetric parameters for 8 patients with brain metastases in normal brain tissue(x±s) |
5.靶区的平均剂量:采用最优IDL范围内的计划,其PTV的平均剂量和参考计划相比,从(53.16±1.20)Gy增加到(66.69±1.14)Gy,增加了25.4%(Z=-2.521,P < 0.05);GTV的平均剂量和参考计划相比从(53.98±1.62)Gy增加到(70.97±1.13)Gy,增加了31.4%(Z=-2.521,P < 0.05)。由于较低IDL计划其靶区剂量更高,其平均机器跳数也从(850.2±115.8)MU增加到(1 149.1±190.3)MU(Z=-2.521,P < 0.05)。
讨论对于SRT计划,其对靶区的均匀性要求不高,允许靶区内存在一些剂量热点。但由于SRT计划单次分割剂量比较大,因此与常规分割相比,要求更快的剂量跌落以及对正常组织更好地保护。在靶区覆盖度不变的情况下,IDL的选择会带来剂量分布的改变。
同常规的通过改变优化条件多次尝试和迭代来改变VMAT计划IDL的方法相比,采用靶区内收边界进行计划优化的方法更加直观,临床上使用更加方便。研究表明,脑转移瘤SRT内收4或5 mm可以使得IDL达到最优处方剂量线范围。对于内收靶区得到的最优IDL范围的计划,其GI值明显下降(Z=-2.521,P < 0.05),这说明剂量跌落的速度更快。在IDL达到最优IDL范围以后,如果再进一步内收边界从而进一步降低IDL,有可能使得正常组织受量增加,不建议在临床实践中使用。
对于脑转移瘤SRT,需要考虑放射性脑坏死的风险,其与肿瘤的大小、位置、处方剂量、剂量体积参数以及病理有关。因此,需要严格限制正常脑组织的受量。研究表明,采用内收边界的方法得到的最优IDL范围内的计划,其与参考计划相比,正常脑组织中V40、V30、V5以及平均剂量都明显下降。这将有利于降低放射性脑坏死的风险。
Mohammadi等[9]报道,随着处方剂量的增加,脑转移瘤的局部控制率明显增加。Rades等[10]也报道在靶区中增加同步加量区可以提高肿瘤的控制率。虽然以上研究还需要更多的临床研究证实,但增加靶区内的剂量有提高肿瘤控制率的潜在优势。
本研究提出的优化SRT-VMAT计划IDL的方法也适用于调强放疗(IMRT)计划,但有一些局限性。首先,对于体积太小的靶区不太适用,因为内收边界会导致新的靶区体积太小接近于0,超过了机器的限制;另一方面,由于较低IDL计划其靶区内剂量较高,其通常需要更高的机器跳数,从而可能影响治疗的效率。
综上,本研究提出了一种优化立体定向放疗VMAT计划IDL的方法,通过采用内收边界生成的新靶区进行计划设计可以改变计划的IDL。最优IDL范围内的计划与参考计划相比,其GI值降低、剂量跌落快、正常脑组织的受量降低以及靶区的平均剂量增加。这将有利于降低放射性脑损伤的风险以及增加肿瘤的局部控制率。
利益冲突 本文作者无可对研究结果产生影响的不正当财务关系,在此对研究的独立性和科学性予以保证
作者贡献声明 徐源负责研究设计、计划优化及论文撰写;马攀负责数据收集;徐英杰、门阔负责统计分析;戴建荣指导修改论文
| [1] |
Patchell RA. The management of brain metastases[J]. Cancer Treat Rev, 2003, 29: 533-540. DOI:10.1016/S0305-7372(03)00105-1 |
| [2] |
Yaeh A, Nanda T, Jani A, et al. Control of brain metastases from radioresistant tumors treated by stereotactic radiosurgery[J]. J Neurooncol, 2015, 124(3): 507-514. DOI:10.1007/s11060-015-1871-5 |
| [3] |
Roa DE, Schiffner DC, Zhang J, et al. The use of RapidArc volumetric-modulated arc therapy to deliver stereotactic radiosurgery and stereotactic body radiotherapy to intracranial and extracranial targets[J]. Med Dosim, 2012, 37(3): 257-264. DOI:10.1016/j.meddos.2011.09.005 |
| [4] |
徐英杰, 肖建平, 马攀, 等. 容积调强弧形治疗用于单发脑转移瘤的剂量学研究[J]. 中华放射肿瘤学杂志, 2015, 24(3): 306-309. DOI:10.3760/cma.j.issn.1004-4221.2015.03.019 |
| [5] |
Zhao B, Jin JY, Wen N, et al. Prescription to 50-75% isodose line may be optimum for linear accelerator based radiosurgery of cranial lesions[J]. J Radiosurg SBRT, 2014, 3(2): 139-147. |
| [6] |
Zhang Q, Zheng D, Lei Y, et al. A new variable for SRS plan quality evaluation based on normal tissue sparing:the effect of prescription isodose levels[J]. Br J Radiol, 2014, 87(1043): 20140362. DOI:10.1259/bjr.20140362 |
| [7] |
Paddick I, Lippitz B. A simple dose gradient measurement tool to complement the conformity index[J]. J Neurosurg, 2006, 105(Suppl): 194-201. DOI:10.3171/sup.2006.105.7.194 |
| [8] |
Paddick I. A simple scoring ratio to index the conformity of radiosargical treatment plans Technical note[J]. J Neurosurg, 2000, 93(Suppl 3): 219-222. DOI:10.3171/jns.2000.93.supplement |
| [9] |
Mohammadi AM, Schroeder JL, Angelov L, et al. Impact of the radiosurgery prescription dose on the local control of small (2 cm or smaller) brain metastases[J]. J Neurosurg, 2017, 126(3): 735-743. DOI:10.3171/2016.3.JNS153014 |
| [10] |
Rades D, Huttenlocher S, Rudat V, et al. Radiosurgery with 20 Gy provides better local contol of 1-3 brain metastases from breast cancer than with lower doses[J]. Anticancer Res, 2015, 35(1): 333-336. |
 2020, Vol. 40
2020, Vol. 40


