手术治疗为可手术切除食管癌患者的主要治疗手段,但临床上即使接受了根治性手术切除的食管癌患者仍有较高比率出现治疗失败,患者一旦出现了复发或转移,则预示预后不良,筛选出一个或几个指标来预测患者预后,并通过其指导临床医师制定治疗方案,从而减少或延缓治疗失败的出现一直是临床医生比较关心的问题,然而目前临床相关预测指标较多,报道结果也不尽相同。其中阳性淋巴结对数比(log odds,LODDS)在非小细胞肺癌、壶腹癌、直肠癌及乳腺癌等实体肿瘤的预后预测上均有效果较好的报道[1-4],在食管癌术后患者的预后预测亦有报道[5-7],但对接受不同术后辅助治疗方式的食管癌患者是否起到一定的预测作用,从而指导临床治疗方案的选择目前还未见相关报道,为明确LODDS对接受不同辅助治疗的食管鳞癌术后患者预后的评估作用课题组进行了该项研究。
资料与方法1.入组标准:①收集2007年1月至2010年12月在河北医科大学第四医院胸外科接受根治性手术的胸段食管鳞癌患者。②患者临床、病理和随访资料齐全。③术前均未行新辅助治疗及其他肿瘤相关的治疗。④依据2002年国际抗癌联盟(UICC)食管癌TNM分期标准纳入pT0-4N0-1M0期食管癌患者。⑤KPS评分≥80。⑥围手术期死亡患者排除在外。⑦术前辅助检查和术后病理证实无远处转移。
2.LODDS的计算公式[1]:LODDS=Log10(阳性淋巴结数+0.5)/(阴性淋巴结数+0.5)。
3.随访:随访方式以电话随访、门诊复查为主,结合病例资料查阅生存期。自患者手术之日算起,随访截止日期为2017年12月31日,患者第1年每3~6个月复查一次,随后每6~12个月复查一次,失访81例,随访率94.7%,失访病例以末次随访日期按死亡统计。
4.统计学处理:应用SPSS 19.0软件进行统计分析。应用受试者工作特征(ROC)曲线及曲线下面积(AUC)确定LODDS的最佳截点(灵敏度与特异度之和最大点即约登指数最大点)。应用Log-rank检验进行单因素分析,Kaplan-Meier法计算患者生存率,多因素分析采用Cox比例风险模型。P<0.05表示差异有统计学意义。对于多因素分析P<0.05的变量在单纯手术、术后化疗和术后放(化)疗组之间采用1:1 :1倾向得分匹配(propensity score matching,PSM)法配对。
结果1.临床资料结果:依据入组标准共纳入1 546例食管癌术后患者。其中男1 080例,466例;年龄37~80岁,平均年龄60岁;病变位于胸上段、胸中段和胸下段者分别为159、1 075和312例;左侧开胸+胸腹两野清扫术1 430例(92.5%)、右侧开胸+胸腹两野清扫术38例(2.5%)、颈/上腹部开胸+颈腹部清扫术27例(1.7%),另51例(3.3%)患者接受颈/右胸/上腹切开术+三野清扫术;依据术者描述手术时食管病变与周围组织粘连程度(以下称为病变粘连程度)分为无粘连、轻度粘连和中重度粘连者分别为192、786和568例;肿瘤组织分化程度分别为未/低分化和中/高分化分别为233和1 313例;依据2002年UICC食管癌TNM分期0、Ⅰ、ⅡA、ⅡB、Ⅲ期患者分别为34、182、737、114和479例;1 546例患者中单纯手术(simple surgery,SS)717例、术后化疗(postoperative chemotherapy,POCT)610例和术后放(化)疗(postoperative chemoradiotherapy,POCRT)219例;手术清除淋巴结数目为14 545枚,平均9.4枚/例,其中清除淋巴结数目≥10枚者898例,<10枚者648例术后病理显示阳性淋巴结1 259枚,转移率为8.7%。
2.患者生存及ROC曲线分析结果:全组患者1、3、5年生存率分别为87.5%、61.7%和52.2%,中位生存67.0个月(95%CI:58.5~75.0)。全组患者LODDS值为-1.902 1~0.655 4,以LODDS值大小为检验变量,生存情况为状态变量,绘制ROC曲线,评估LODDS预测预后的能力。ROC曲线分析结果显示,当LODDS取值为-1.354 1时,约登指数最大,以-1.354 1为最佳截点值,评估全组患者预后的敏感度为0.505,特异度为0.817,AUC为0.644(95%CI:0.617~0.672),P=0.000;其中,LODDS≤-1.354 1组患者998例,LODDS>-1.354 1组患者548例。见图 1。
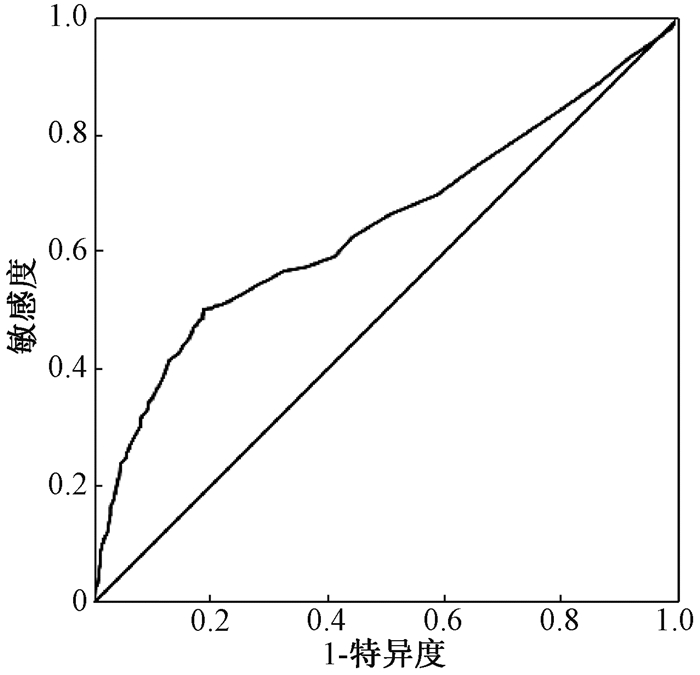
|
图 1 LODDS值的ROC曲线分布图 Figure 1 ROC curve distribution of LODDS values |
3.患者预后影响因素分析结果:将可能影响患者的预后影响因素进行单因素分析,结果显示患者性别、年龄、病变部位、食管钡餐造影病变长度、病变粘连程度、肿瘤组织分化程度、pTNM分期和LODDS值均为其预后影响因素(χ2=27.777、18.805、6.945、49.367、80.515、7.779、282.793、221.694,P < 0.05,表 1);多因素分析结果显示,患者性别、年龄、病变部位、病变粘连程度、术后患者治疗方式、pTNM分期和LODDS值为患者的独立性预后影响因素(P<0.05,表 2)。
|
|
表 1 全组患者预后单因素分析结果 Table 1 Results of single factor analysis of prognosis in the entire group |
|
|
表 2 全组患者预后多因素分析结果 Table 2 Results of multivariate analysis of prognosis in the whole group |
4.不同LODDS取值对不同治疗模式患者的预后分析结果:为进一步明确不同LODDS值在评估胸段食管鳞癌术后患者接受不同治疗方式的预后情况,依据ROC曲线分析结果将LODDS分为LODDS≤-1.354 1和LODDS>-1.354 1两组;每组依据术后治疗方式不同分为SS、POCT和POCRT 3个亚组。结果显示,LODDS≤-1.354 1组不同治疗方式患者3、5年生存率差异无统计学意义(P>0.05),而LODDS>-1.354 1组不同治疗方式患者3、5年生存率差异有统计学意义(χ2=30.800,P < 0.05,表 3和图 2)。
|
|
表 3 不同LODDS取值对不同治疗模式患者生存率单因素分析结果(%) Table 3 Prognostic single analysis results for different LODDS values for patients with different treatment modalities(%) |
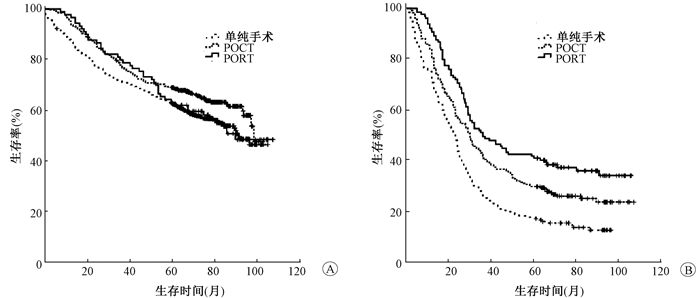
|
图 2 3种不同治疗方式患者生存曲线 A.LODDS≤-1.354 1;B.LODDS>-1.354 1 Figure 2 Survival curves of patients with three different treatment modalities A. LODDS ≤-1.354 1; B. LODDS>-1.354 1 |
5.不同LODDS取值对不同治疗模式患者PSM后的预后分析结果:依据多因素分析结果,将SS、POCT和POCRT 3组患者进行1:1:1的PSM分析,结果显示共有615例患者,每组均为205例患者。对此615例患者进行单因素分析,分析结果显示LODDS≤-1.354 1和LODDS>-1.354 1组患者接受不同方式治疗后,其3、5年生存率差异均有统计学意义(χ2=10.198、24.191,P < 0.05),见图 3,表 4。多因素分析结果显示患者性别、病变粘连程度、术后患者治疗方式、pTNM分期和LODDS值为影响患者的独立性预后影响因素(P<0.05),见表 5。进一步分层分析结果显示,LODDS≤-1.354 1时,SS组患者的OS均差于POCT和POCRT组(χ2=81.470、5.182,P < 0.05),而POCT与POCRT两组患者之间差异无统计学意义(P>0.05);LODDS>-1.354 1时SS组患者的OS均显著差于POCT和POCRT组患者(χ2=4.151、24.020,P < 0.05),且POCT与POCRT两组患者之间差异有统计学意义(χ2=8.728,P < 0.05)。
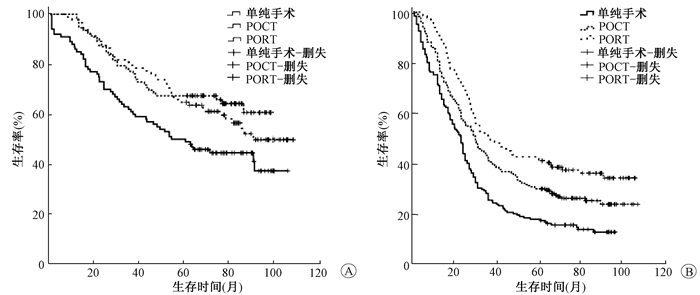
|
A.LODDS≤-1.3541;B.LODDS>-1.354 1 图 3 3种不同治疗方式患者PSM后生存曲线 A.LODDS≤-1.3541; B.LODDS > -1.354 1 Figure 3 Survival curve after PSM in three different treatments |
|
|
表 4 不同LODDS取值对不同治疗模式患者PSM后的生存率单因素分析结果(%) Table 4 Results of different LODDS values for prognosis after PSM in patients with different treatment modes(%) |
|
|
表 5 3种不同治疗方式患者PSM后预后多因素分析结果 Table 5 Results of multivariate analysis of prognosis after PSM in three different treatments |
讨论
淋巴结转移为食管癌术后患者预后不良的重要指标,目前,UICC的食管癌术后病理TNM分期中的N分期主要依据阳性淋巴结转移个数来定义,但由于各研究中心的食管癌手术方式有差异,导致术中淋巴结清扫数目不同而容易引起分期偏倚,另外由于临床送检淋巴结数目的不足也可能造成pN分期准确性下降[8],以上情况均可导致N分期相同的情况下患者生存差异可能明显不同。报道认为LODDS可以在一定程度上克服术中淋巴结清扫数目不足而带弥补pN分期的缺陷[9],也有报道认为LODDS甚至对于淋巴结阴性的食管癌术后患者亦有独特的预测预后的优势[10]。本研究对1 546例食管鳞癌术后患者进行了回顾性分析,单因素分析结果显示,LODDS值的大小为患者的预后影响因素,多因素分析显示,LODDS为本组患者的独立性预后影响因素,依据ROC曲线分析LODDS的临界值取-1.354 1时,曲线下面积最大,对于食管癌术后患者生存率差异有统计学意义。
汪亮等[9]回顾性分析了905例pT3期食管鳞癌术后患者,以评价淋巴结转移数目、淋巴结转移率(MLR)和LODDS为基础的不同分期在预测患者预后的价值,分析结果认为LODDS分期是pT3期食管鳞癌术后患者的独立预后因素,LODDS分期对食管癌患者预后的预测价值或优于以pN分期为基础的TNM分期。Yang等[6]对260例食管鳞癌术后患者的预后进行了分析,结果显示LODDS越大预后越差,多因素分析显示LODDS(HR=1.309,P < 0.05)是所有患者的独立和重要预后因素,且为淋巴结阴性患者的独立预后影响因素(HR =1.610,P < 0.05),该研究认为LODDS可用于无淋巴结转移的晚期食管鳞癌术后患者OS的评估。目前,我国食管癌的术式主要包括左侧开胸入路和右侧开胸入路,不同开胸模式的术中淋巴结清扫范围和程度有差异,毛友生等[12]等对559例食管癌术后患者进行了不同手术入路对患者术后预后影响的研究,接受左、右胸入路的患者分别为281和277例,术中平均清扫淋巴结分别为23.4和24.6枚(P<0.001)、胸部淋巴结转移率分别为34.8%和50.5%(P<0.001)、腹部淋巴结的转移率分别为29.1%和17.7%(P=0.001)、5年生存率分别为38.2%和42.1% (P=0.620)。Li等[13]对300例胸中、下段食管癌术后患者的不同术式进行了比较,其结果显示左胸入路和右胸入路的平均术中淋巴结清扫数目分别为18和22枚(P < 0.001),该研究未对患者预后进行比较。当然这种差异与食管癌病变部位亦有关联[14],本组患者中接受左侧开胸术为1 430例,占92.5%,依据上述报道,对本组患者采用LODDS来评估患者预后可能更有效。
相比于国外较多进行的新辅助治疗,在我国食管癌综合治疗模式目前仍以术后辅助治疗为主,食管癌术后辅助治疗是否能显著性提高患者的预后,目前仍没有统一的意见,有的得出相反的结论,即术后辅助治疗可能导致患者一个较差的预后,但临床上多数研究报道均支持对淋巴结阳性的患者进行术后辅助治疗,且认为此部分患者能从术后辅助治疗中获益[15-18]。Cao等[7]通过对4 123例食管癌术后患者进行分析,比较了阳性淋巴结转移数目(LNMs)、阳性淋巴结转移率(LNR)和LODDS三者对患者预后的影响,最终结果表明对于食管癌术后患者,LODDS比LNM或LNR更准确地预测生存,特别是对于术中淋巴结清扫不足的患者。这与Wu等[11]的研究结论相似,他们分析了589例食管鳞癌术后患者,比较了LODDS、LNMs、LNR、清扫淋巴数目(RLNC)和阴性淋巴结数目(NLNC)对患者预后的影响,结果显示以上5项指标具有较好的关联性,LODDS值越大则预后越差, 且多因素分析结果显示LODDS为影响该组患者OS的唯一独立性预后因素(HR:3.297, 95%CI: 2.684~4.050, P < 0.001),他们认为在确定食管切除术后食管鳞癌(ESCC)患者的预后时,LODDS分期系统优于其他淋巴结分类。目前对于利用LODDS来评估术后辅助治疗的价值的文章未见报道,本研究结果显示,LODDS数值较小组患者接受术后辅助性治疗患者的预后优于单纯手术组患者,但术后化疗与术后放化疗对患者预后无影响;而在LODDS数值较大组,则显示术后放化疗组患者的预后显著性优于其他两组患者。对于术后淋巴结阳性患者术后辅助性化疗亦起到显著的提高患者预后的作用[19-20]。依据以上研究结论和本研究结果,认为应用LODDS来选择不同治疗方式对食管鳞癌术后患者预后有着重要的临床意义和实际价值。
本研究不足之处在于本研究为回顾性研究,故在病例选择等方面可能存在偏倚;本组患者清扫淋巴结数目差异较大,但由于篇幅关系未对其进行进一步分层分析;由于术后同步放化疗和术后放疗患者例数较少,研究中将其整合为一组,可能对研究结果有一定的影响;LODDS相比于LNMs、LNR等计算比较复杂。
综上所述,LODDS为食管鳞癌术后患者的重要预后影响因素,在一定程度上可以指导术后辅助治疗方式的选择,对于LODDS数值较小患者可选择POCT,而对于LODDS数值较大建议应用POCRT来进行术后辅助治疗以提高患者预后。这一结论需要进一步临床研究证实。
利益冲突 全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务或财务利益,所写内容均中立客观,不存在任何利益冲突
作者贡献声明 沈文斌负责研究设计、数据采集分析和论文撰写;许金蕊负责随访;李曙光、李幼梅、宋春洋和赵彦负责病例收集、数据采集;祝淑钗负责研究方案的审核和论文指导
| [1] |
Wen J, Ye F, He X, et al. Development and validation of a prognostic nomogram based on the log odds of positive lymph nodes (LODDS) for breast cancer[J]. Oncotarget, 2016, 7(15): 21046-21053. DOI:10.18632/oncotarget.8091 |
| [2] |
Scarinci A, Di CT, Cavaniglia D, et al. The impact of log odds of positive lymph nodes (LODDS) in colon and rectal cancer patient stratification:a single-center analysis of 323 patients[J]. Updates Surg, 2018, 70(1): 23-31. DOI:10.1007/s13304-018-0519-3 |
| [3] |
Dziedzic D, Piotr R, Langfort R, et al. Log odds of positive lymph nodes as a novel prognostic indicator in NSCLC staging[J]. Surg Oncol, 2017, 26(1): 80-85. DOI:10.1016/j.suronc.2017.01.004 |
| [4] |
Huang B, Chen C, Ni M, et al. Log odds of positive lymph nodes is a superior prognostic indicator in stage Ⅲ rectal cancer patients:A retrospective analysis of 17, 632 patients in the SEER database[J]. Int J Surg, 2016, 32(1): 24-30. DOI:10.1016/j.ijsu.2016.06.002 |
| [5] |
Sun Z, Xu Y, de Li M, et al. Log odds of positive lymph nodes:a novel prognostic indicator superior to the number-based and the ratio-based N category for gastric cancer patients with R0 resection[J]. Cancer, 2010, 116(11): 2571-2580. DOI:10.1002/cncr.24989 |
| [6] |
Yang M, Zhang H, Ma Z, et al. Log odds of positive lymph nodes is a novel prognostic indicator for advanced ESCC after surgical resection[J]. J Thorac Dis, 2017, 9(5): 1182-1189. DOI:10.21037/jtd.2017.03.187 |
| [7] |
Cao J, Yuan P, Ma H, et al. Log odds of positive lymph nodes predicts survival in patients after resection for esophageal cancer[J]. Ann Thorac Surg, 2016, 102(2): 424-432. DOI:10.1016/j.athoracsur.2016.03.030 |
| [8] |
Twine CP, Lewis WG, Morgan MA, et al. The assessment of prognosis of surgically resected oesophageal cancer is dependent on the number of lymph nodes examined pathologically[J]. Histopathology, 2009, 55(1): 46-52. DOI:10.1111/j.1365-2559.2009.03332.x |
| [9] |
汪亮, 蔡磊, 陈倩, 等. pN分期淋巴结转移率分期和阳性淋巴结对数比分期预测T3期食管鳞癌患者预后的价值[J]. 中华肿瘤杂志, 2017, 39(10): 749-753. Wang L, Cai L, Chen Q, et al. Prognostic value of three different staging schemes based on pN, MLR and LODDS in patients with T3 esophageal cancer[J]. Chin J Oncol, 2017, 39(10): 749-753. DOI:10.3760/cma.j.issn.0253-3766.2017.10.006 |
| [10] |
杨明建, 张洪典, 霍小东, 等. 阳性淋巴结对数比对pN0期胸段食管鳞癌术后患者预后的评估价值[J]. 中华胃肠外科杂志, 2016, 19(5): 535-539. Yang MJ, Zhang HD, Huo XD, et al. Predictive value of log odds of positive lymph nodes for the prognosis of patients with nodenegative squamous cell carcinoma of the thoracic esophagus after radical esophagectomy[J]. Chin J Gastrointestinal Surg, 2016, 19(5): 535-539. DOI:10.3760/cma.j.issn.1671-0274.2016.05.013 |
| [11] |
Wu SG, Sun JY, Yang LC, et al. Prognosis of patients with esophageal squamous cell carcinoma after esophagectomy using the log odds of positive lymph nodes[J]. Oncotarget, 2015, 6(34): 36911-36922. DOI:10.18632/oncotarget.5366 |
| [12] |
毛友生, 赫捷, 董静思, 等. 胸段食管癌左右胸入路清扫淋巴结的结果比较[J]. 中华肿瘤杂志, 2012, 34(4): 296-300. Mao YS, He J, Dong JS, et al. Comparison of the results of lymph node dissection via left versus right thoracoto[J]. Chin J Oncol, 2012, 34(4): 296-300. DOI:10.3760/cma.j.issn.0253.3766.2012.04.013 |
| [13] |
Li B, Xiang J, Zhang Y, et al. Comparison of Ivor-Lewis vs Sweet esophagectomy for esophageal squamous cell carcinoma:a randomized clinical trial[J]. JAMA Surg, 2015, 150(4): 292-298. DOI:10.1001/jamasurg.2014.2877 |
| [14] |
许茜, 刘志坤, 曹彦坤, 等. 食管癌大体肿瘤靶区体积与淋巴结转移及预后的关系[J]. 中华肿瘤杂志, 2012, 34(9): 684-687. Xu Q, Liu ZK, Cao YK, et al. Relationship of gross tumor volume with lymph node metastasis and prognosis of esophageal carcinoma[J]. Chin J Oncol, 2012, 34(9): 684-687. DOI:10.3760/cma.j.issn.0253-3766.2012.09.009 |
| [15] |
Xiao ZF, Yang ZY, Liang J, et al. Value of radiotherapy after radical surgery for esophageal carcinoma:a report of 495 patients[J]. Ann Thorac Surg, 2003, 75(2): 331-336. DOI:10.1016/s0003-4975(02)04401-6 |
| [16] |
Hsu PK, Huang CS, Wang BY, et al. Survival benefits of postoperative chemoradiation for lymph node-positive esophageal squamous cell carcinoma[J]. Ann Thorac Surg, 2014, 97(5): 1734-1741. DOI:10.1016/j.athoracsur.2013.12.041 |
| [17] |
Rice TW, Adelstein DJ, Chidel MA, et al. Benefit of postoperative ajuvant chemoradiotherapy in locoregionally advanced esophageal carcinoma[J]. J Thorac Cardiovasc Surg, 2003, 126(5): 1590-1596. DOI:10.1016/S0022 |
| [18] |
Chen J, Pan J, Liu J, et al. Postoperative radiation therapy with or without concurrent chemotherapy for node-positive thoracic esophageal squamous cell carcinoma[J]. Int J Radiat Oncol Biol Phys, 2013, 86(4): 671-677. DOI:10.1016/j.ijrobp.2013.03.026 |
| [19] |
沈文斌, 高红梅, 祝淑钗, 等. 术后化疗对术后淋巴结阳性胸段食管鳞癌患者预后的影响[J]. 肿瘤防治研究, 2018, 45(10): 762-767. Shen WB, Gao HM, Zhu SC, et al. Effect of postoperative chemotherapy on prognosis of postoperative lymph node-positive thoracic esophageal squamous cell carcinoma patients[J]. Cancer Res Prev Treat, 2018, 45(10): 762-767. DOI:10.3971/j.issn.1000-8578.2018.18.0118 |
| [20] |
齐战, 王玉祥, 杨琼, 等. 食管鳞癌术后病理淋巴结阳性患者的预后及其术后化疗的作用[J]. 中华肿瘤杂志, 2017, 39(8): 628-634. Qi Z, Wang YX, Yang Q, et al. Survival and the value of adjuvant chemotherapy in esophageal squmous cell carcinoma patients with lymphatic metastasis[J]. Chin J Oncol, 2017, 39(8): 628-634. DOI:10.3760/cma.j.issn.0253-3766.2017.08.013 |
 2020, Vol. 40
2020, Vol. 40


