2. 重庆市肿瘤医院放疗科 400030
2. Chongqing Cancer Hospital, Chongqing 400030, China
在初诊的鼻咽癌患者中,约70%为局部晚期患者[1],诱导化疗联合同步放化疗是推荐的主要治疗策略之一,其死亡的主要原因是局部复发和远处转移[2]。因此积极寻找鼻咽癌预后可靠的预测指标指导临床至关重要。
鼻咽癌的生长过程离不开肿瘤血管的生成,近年来随着抗血管生成药物治疗的发展,肿瘤血管监测的方法也成为研究的热点,动态增强磁共振(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)是一种无创性评估肿瘤血管的影像学技术,间接反映组织灌注和肿瘤细胞的氧含量来评估肿瘤化放疗的临床疗效,判断肿瘤的预后。国内外研究表明,DCE-MRI在肺癌[3]、食管癌[4]、胃癌[5]、直肠癌[6]、宫颈癌[7]、乳腺癌[8]的应用研究取得了一定成果,DCE-MRI相关参数与肿瘤的总生存期(overall survival, OS)、无进展生存期(progression-free survival, PFS)具有一定的相关性。然而DCE-MRI在鼻咽癌的应用中,大多是关于鼻咽癌诊断、分期及近期疗效方面的研究,本研究将探讨局部晚期鼻咽癌初治患者治疗前的DCE-MRI半定量参数与长期预后的相关性,为局部晚期鼻咽癌患者预后寻找可靠的影像学指标。
资料与方法1.临床资料:入组标准:①病理明确诊断的初治局部晚期鼻咽癌患者(2010国际抗癌联盟(UICC)分期为Ⅲ~ⅣB期)。②无化疗史及头颈部放疗史。③KPS评分≥70。④无不能去除的铁磁性金属。⑤鼻咽腔软组织肿瘤长径>1 cm。⑥原发灶坏死区直径 < 3 mm。⑦血红蛋白>90 g/L。⑧签署知情同意书。排除标准:①有磁共振成像(MRI)检查禁忌的患者。②严重心肺疾病、糖尿病、未控制的感染患者。③明显肿大淋巴结压迫血管的患者。
前瞻性收集2011年1月至2012年1月在贵州省肿瘤医院治疗的局部晚期鼻咽癌患者71例。其中男53例,女18例。中位年龄45岁(范围20~74岁)。临床资料见表 1。
|
|
表 1 71例鼻咽癌患者的临床资料 Table 1 Clinical data of 71 patients with nasopharyngeal carcinoma |
2.动态增强磁共振扫描:应用TOSHIBA Titan 1.5 T磁共振成像系统,患者仰卧,头先进,采用冠状位进行扫描,使用头颈联合线圈,3D FAST TOP SPGR序列(重复时间/回波时间=1.0/5.4 ms,翻转角=80,视野=24 cm,层厚=10 mm,矩阵=128×128)。诱导化疗前行动态增强扫描,并行常规增强MRI测量肿瘤基线值。
注射造影剂前扫描一周期作为基线图像,之后使用MR专用高压注射器经肘静脉团注Gd-DTPA,剂量为0.1 mmol/kg,速度为4 ml/s,注射完造影剂后,以4 ml/s的速度注射生理盐水10 ml。注射造影剂同时开始行MRI动态扫描,每个周期扫描16层,每个周期用时约10 s,共扫描10个周期,整个动态扫描用时为100 s。
3.确定感兴趣区(ROI):选择鼻咽腔肿块最大层面,ROI直径5 mm,位于长短径交叉点,若遇坏死或空腔则沿肿块长径或短径向后方顺移,以未被肿瘤侵及的翼外肌前端作为对照。
4.参数测量:采用FuncTool图像分析后处理工作站,对同一位置的系列图像逐一计算像素,由每个像素的最大斜率值排列成一个数字矩阵,进行数模转换,生成时间信号-曲线。测量各ROI的以下参数:造影剂到达组织时间(T1 on set);造影剂到达强化高峰时间(TTP);最大信号强度值(SI);强化峰值(PV);强化百分数(SI%)。选取肿瘤最大截面,以十字标记内缘为准,测量连续软组织肿瘤长径及短径。
5.治疗方法
(1) 诱导化疗:所有患者均行多西紫杉醇+顺铂+5′-氟尿嘧啶(TPF)方案时辰诱导化疗3周期,具体方案:多西紫杉醇75 mg/m2,静脉滴注,第1天;顺铂75 mg/m2,分5 d用,微量泵入(10 :00 am~10 :00 pm),第1~5天;5′-氟尿嘧啶750 mg·m-2·d-1,微量泵入(10 :00 pm~10 :00 am),第1~5天。21 d为1个周期,共3个周期。
(2) 同期放化疗:诱导化疗结束后2周开始同期放化疗,放疗采用调强适形放疗(IMRT)技术,所有患者治疗前均行CT模拟机定位,体位为仰卧位,头肩颈架面模固定,静脉推注碘氟醇作增强扫描,范围为眉弓上1 cm至胸骨柄下缘,层距3 mm。定位CT与1.5T MRI图像融合进行靶区勾画。采用治疗计划系统(TPS)设计放疗计划,接受直线加速器(瑞典医科达Precise)6 MV X射线照射。根据国际辐射单位与测量委员会(ICRU)50号及62号报告原则进行靶区勾画。鼻咽病灶剂量69.96~73.92 Gy/33次,转移颈淋巴结剂量69.96 Gy/33次,亚临床靶区及高危淋巴引流区剂量60.06 Gy/33次,低危淋巴引流区剂量50.96 Gy/28次。同期化疗采用紫杉醇135 mg/m2,第1天,持续滴注,21~28 d为1个周期,共行2个周期。
6.疗效评价及随访:按实体瘤治疗疗效评价标准(RECIST 1.1)于同步放化疗结束评价近期疗效。随访自治疗之日起截止到2018年5月1日。随访主要内容包括:生存状态、一般情况、死亡时间及原因、复发情况及时间、远处转移情况、转移部位及时间等。主要的预后指标包括OS和PFS。OS时间定义为治疗开始之日至患者死亡时间,PFS时间定义为从治疗开始之日起,到观察到疾病进展或者发生因为任何原因的死亡之间的时间。
7.统计学处理:采用SPSS 22.0软件进行统计分析,用Kaplan-Meier曲线及Log-rank检验判断生存差异。多因素预后分析则采用Cox比例风险回归模型判断影响生存的独立预后因素。符合正态分布或者经转化服从正态分布的计量资料两组间比较采用独立样本t检验。将动态增强磁共振参数值按中位数分为两组,比较两组间预后差异。P<0.05为差异有统计学意义。
结果1.随访情况:77例患者中,71例具有完整的治疗及完成随访,中位随访时间77个月(9~ 86个月),28例出现复发或转移,27例患者死亡。其中,1例死于交通事故,1例死于脑梗死,25例死于复发或转移。3年、5年OS分别为80.2%、67.6%;3年、5年PFS分别为73.2%、60.5%。
2.动态增强磁共振参数与近期疗效的关系:同步放化疗结束时总体近期疗效评价完全缓解(CR)28例,部分缓解(PR)42例,疾病稳定(SD)0例,疾病进展(PD)1例(鼻咽部进展并骨转移)。鼻咽原发病灶疗效评价,完全缓解(CR)30例,部分缓解(PR)40例,疾病稳定(SD)0例,疾病进展(PD)1例。
同步放化疗结束鼻咽病灶近期疗效评价CR组与PR组之间的T1 on set的差异具有统计学意义(t=0.537, P < 0.05, 表 2);同步放化疗结束鼻咽病灶即刻疗效评价CR组与PR组之间的TTP、SI、PV、SI%差异无统计学意义(P>0.05)。
|
|
表 2 同步放化疗后鼻咽原发病灶近期疗效评价CR组与PR组间参数比较(x±s) Table 2 Short-term efficacy evaluation of primary nasopharyngeal lesions after concurrent chemoradiotherapy: comparison of parameters between CR group and PR group(x±s) |
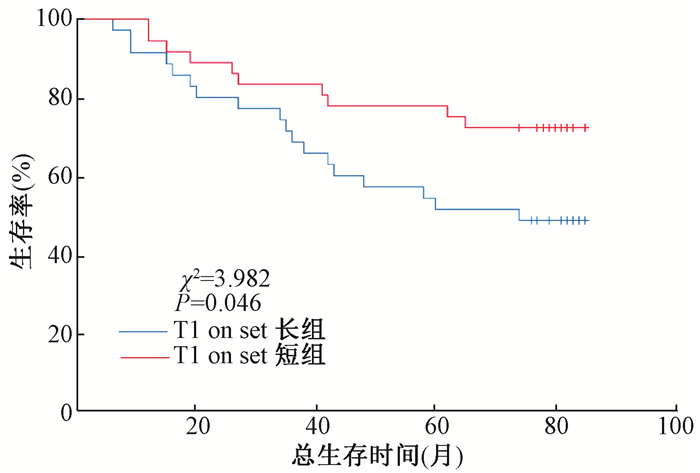
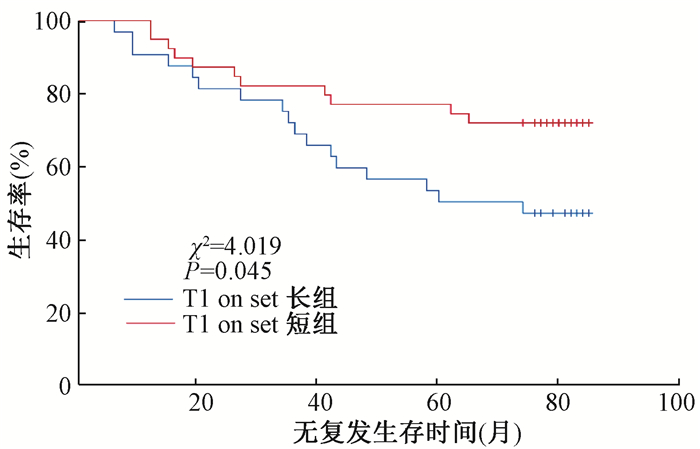
3.单因素分析动态增强磁共振参数与OS、PFS的关系:单因素分析发现,T1 on set短组的OS(χ2=3.982, P < 0.05)和PFS(χ2=4.019, P < 0.05)均高于T1 on set长组;年龄≥45岁的患者OS(χ2=7.593, P < 0.05)和PFS(χ2=5.624, P < 0.05)低于年龄<45岁的患者。见图 1、2及表 3。
|
图 1 造影剂到达组织时间长短与OS的关系 Figure 1 Comparison of OS between different arrival times of the contrast agent |
|
图 2 造影剂到达组织时间长短与PFS的关系 Figure 2 Comparison of PFS between different arrival times of the contrast agent |
|
|
表 3 鼻咽癌患者OS和PFS的单因素分析 Table 3 Univariate analysis of OS and PFS in nasopharyngeal carcinoma |
4.多因素分析动态增强磁共振参数与OS、PFS的关系:Cox多因素回归模型发现,临床分期晚(ⅣA、ⅣB期)(P=0.048)、年龄≥45岁(P=0.031)是鼻咽癌患者OS的独立不良预后因素;而T1 on set长(P=0.018)、年龄≥45岁(P=0.004)、N(2~3期)分期晚(P=0.032)和PV<3 000(P=0.005)则为鼻咽癌患者PFS的独立不良预后因素,详见表 4。
|
|
表 4 鼻咽癌患者OS和PFS的多因素分析 Table 4 Multivariate analysis of OS and PFS in nasopharyngeal carcinoma |
讨论
近年来,DCE-MRI相关参数在肿瘤领域的应用研究已成为热点。研究报道肿瘤的生长、侵袭、转移、复发和预后均与肿瘤血管生成有关[9-10]。DCE-MRI可以在活体反映组织的微血管灌注和毛细血管通透性,是一种非侵入性评价肿瘤血管的影像学监测手段之一,因此在肿瘤的诊断、治疗、复发转移、疗效评价及预后方面被广泛研究。
本研究涉及的半定量参数为T1 on set、TTP、SI、PV、SI%,主要反映造影剂通过血管的整个变化过程,从而间接反映肿瘤血管的微循环、血容量及氧含量等情况。有研究表明,DCE-MRI可作为组织乏氧性、肿瘤坏死区判断的一种手段[11]。组织缺氧明显、血供差、组织坏死严重,对放化疗抵抗从而导致疗效差[12]。
本研究中入组病例治疗前均给予鼻咽部DCE-MRI,同步放化疗结束鼻咽病灶近期疗效CR组T1 on set明显比PR组短。T1 on set短,说明组织血供越丰富,化疗药物顺利抵达肿瘤组织并达到较高的药物浓度,加强对肿瘤细胞的杀伤力度及抑制细胞增殖速度;抗癌药物在肿瘤组织中的分布取决于血浆药代动力学、肿瘤血管系统的结构和功能以及药物在微血管壁和血管外组织中移动时的转运特点[13],所以肿瘤血管密度作为化疗疗效的重要影响因素之一。对于放疗,乏氧是导致放疗抵抗重要影响因素,肿瘤细胞的乏氧程度越高,放疗的敏感性就越差[14-15],导致临床治疗失败的概率增大。Graham和Unger[16]研究显示增加肿瘤组织氧渗透性肿瘤治疗疗效明显改善。DCE-MRI参数SI与平均氧分压呈正相关,而与乏氧细胞比例呈反比[17]。治疗前高灌注的肿瘤放化疗疗效优于低灌注的肿瘤患者。翁克贵等[18]在本课题前期研究工作中对DCE-MRI预测鼻咽癌诱导化疗疗效的研究中显示参数T1 on set、TTP与肿瘤缩小率呈负相关。郭笑寒等[19]对DCE-MRI在鼻咽癌疗效预测的研究中显示,TTP与肿瘤消退率呈负相关,当肿瘤高强化区TTP<65.53 s时诊断性能最好,TTP较短的患者肿瘤血流灌注水平较高、血氧丰富,对治疗敏感;相反,TTP较长的患者肿瘤血流灌注较差、组织相对乏氧,对治疗反应较差。高影嫦等[20]在DCE-MRI预测鼻咽癌放化疗敏感性研究中结果显示,鼻咽癌患者放疗前、中、后的DCE-MRI参数SI值的差异有统计学意义,说明在放疗过程中肿瘤内部会发生明显血管闭塞坏死,病灶内的微血管密度明显降低,通过DCE-MRI参数间接反映肿瘤组织内部血流变化的过程。在一定程度上可预测预后。由此可见,DCE-MRI半定量参数对鼻咽癌患者进行无创性、非侵入性的血管生成活性评价,为DCE-MRI半定量参数在鼻咽癌的诊疗应用中提供理论基础。
在本研究中,单因素分析显示T1 on set与鼻咽癌患者OS、PFS有关,同时多因素分析也显示T1 on set与PFS有关,T1 on set有望成为独立预后因素。T1 on set短者,表明组织灌注良好,较T1 on set长者而言,肿瘤组织相对氧含量丰富。肿瘤组织普遍处于乏氧状态,乏氧状态与局部复发或远处转移密切相关[21-22]。本研究结果与孟云等[23]对DCE-MRI在鼻咽癌患者预后评估中的作用研究结果一致,TTP短,反映高血流灌注量,提示富氧状态,故放化疗的疗效更好。Hall等[24]对PET/CT和DCE-MRI作为恶性胸膜间皮瘤的影像学的研究表明恶性间皮瘤患者参数SI%越高,则OS更长。本研究单因素及多因素分析显示年龄大的患者OS、PFS较年龄小者预后较差,与田允铭等[25]研究结果一致,年龄亦可作为鼻咽癌患者预后的独立因素。
本研究存在一定的局限和不足,主要是样本量较小,其次由于当时的影像技术限制未能对颈部淋巴结进行DCE-MRI,故转移淋巴结的影响因素未能分析,随着影像技术的提高,在今后研究中进一步完善这方面的检测及扩大病例数,从而寻找更准确的影像学预后指标。
DCE-MRI半定量参数T1 on set与鼻咽病灶近期疗效评价有一定相关性,CR组T1 on set明显短于PR组;DCE-MRI半定量参数T1 on set与鼻咽癌患者OS、PFS存在相关性,T1 on set短者提示预后更好;DCE-MRI半定量参数T1 on set可能成为局部晚期鼻咽癌患者预后可靠的影像学指标。
利益冲突 所有作者在进行该研究时,未因执行此研究而获得职务、金钱及其他不正当财务利益
作者贡献声明 杨春李负责数据分析及论文撰写;吴伟莉负责研究设计与论文修改;金风负责论文修改;李媛媛、龙金华、罗秀玲、翁克贵负责数据收集;陈宇、唐红、张芒负责数据分析与文献查找
| [1] |
Chen X, Zhu X, Wang J, et al. NACT+IMRT versus NACT+IMRT+CCRT in locoregionally advanced NPC patients:a retrospective study[J]. Onco Targets Ther, 2019, 12(12): 1553-1562. DOI:10.2147/OTT.S183483 |
| [2] |
Liu M, You W, Song YB, et al. The changing role of chemotherapy in locoregionally advanced nasopharyngeal carcinoma:a updated systemic review and network meta-analysis[J]. Front Oncol, 2018, 8(6): 597-604. DOI:10.3389/fonc.2018.00597 |
| [3] |
Boogaart VE, de Lussanet QG, Houben RM, et al. Inter-reader reproducibility of dynamic contrast-enhanced magnetic resonance imaging in patients with non-small cell lung cancer treated with bevacizumab and erlotinib[J]. Lung Cancer, 2016, 93(8): 20-27. DOI:10.1016/j.lungcan.2015.12.009 |
| [4] |
Ye ZM, Dai SJ, Yan FQ, et al. DCE-MRI-derived volume transfer constant (k\r, trans\r, ) and DWI apparent diffusion coefficient as predictive markers of short- and long-term efficacy of chemoradiotherapy in patients with esophageal cancer[J]. Technol Cancer Res Treat, 2018, 17(1): 1-10. DOI:10.1177/1533034618765254 |
| [5] |
Giganti F, Tang L, Baba H. Gastric cancer and imaging biomarkers:Part 1-a critical review of DW-MRI and CE-MDCT findings[J]. Eur Radiol, 2018, 4(29): 1743-1753. DOI:10.1007/s00330-018-5732-4 |
| [6] |
Kim YE, Joo B, Park MS, et al. Dynamic contrast-enhanced magnetic resonance imaging as a surrogate biomarker for bevacizumab in colorectal cancer liver metastasis:a single-arm, exploratory trial[J]. Cancer Res Treat, 2016, 48(4): 1210-1221. DOI:10.4143/crt.2015.374 |
| [7] |
Lund KV, Simonsen TG, Kristensen GB, et al. Pretreatment late-phase DCE-MRI predicts outcome in locally advanced cervix cancer[J]. Acta Oncologica, 2017, 56(5): 675-681. DOI:10.1080/0284186X.2017.1294762 |
| [8] |
Li A, Pan Y, Chen B, et al. Association of parameters in dynamic contrast-enhanced MRI using reference region model with prognostic factors and molecular subtypes of breast cancer[J]. J Zhejiang Univ, 2017, 46(5): 505-510. DOI:10.3785/j.issn.1008-9292.2017.10.09 |
| [9] |
Steingoetter A, Menne D, Braren RF. Assessing antiangiogenic therapy response by DCE-MRI:development of a physiology driven multi-compartment model using population pharmacometrics[J]. PLoS One, 2011, 6(10): 263-266. DOI:10.1371/journal.pone.0026366 |
| [10] |
Chen BB, Tien YW, Chang MC, et al. Multiparametric PET/MR imaging biomarkers are associated with overall survival in patients with pancreatic cancer[J]. Eur J Nucl Med Mol Imaging, 2018, 45(7): 1205-1217. DOI:10.1007/s00259-018-3960-0 |
| [11] |
Liao WH, Yang LF, Liu XY, et al. DCE-MRI assessment of the effect of Epstein-Barr virus-encoded latent membrane protein-1 targeted DNAzyme on tumor vasculature in patients with nasopharyngeal carcinomas[J]. BMC Cancer, 2014, 14(1): 835-843. DOI:10.1186/1471-2407-14-835 |
| [12] |
Hou J, Yu X, Hu Y, et al. Value of intravoxel incoherent motion and dynamic contrast-enhanced MRI for predicting the early and short-term responses to chemoradiotherapy in nasopharyngeal carcinoma[J]. Medicine, 2016, 95(35): 4320-4330. DOI:10.1097/MD.0000000000004320 |
| [13] |
Dewhirst MW, WSecomb T. Transport of drugs from blood vessels to tumour tissue[J]. Nat Rev Cancer, 2017, 17(12): 738-750. DOI:10.1038/nrc.2017.93 |
| [14] |
Takakusagi Y, Naz S, Takakusagi K, et al. A multimodal molecular imaging study evaluates pharmacological alteration of the tumor microenvironment to improve radiation response[J]. Cancer Res, 2018, 78(24): 6828-6837. DOI:10.1158/0008-5472.CAN-18-1654 |
| [15] |
Wilson WR, Hay MP. Targeting hypoxia in cancer therapy[J]. Nat Rev Cancer, 2011, 11(6): 393-410. DOI:10.1038/nrc3064 |
| [16] |
Graham K, Unger E. Overcoming tumor hypoxia as a barrier to radiotherapy, chemotherapy and immunotherapy in cancer treatment[J]. Int J Nanomedicine, 2018, 13(4): 6049-6058. DOI:10.2147/IJN.S140462 |
| [17] |
Cooper RA, Carrington BM, Loncaster JA, et al. Tumour oxygenation levels correlate with dynamic contrast-enhanced magnetic resonance imaging parameters in carcinoma of the cervix[J]. Radiother Oncol, 2000, 57(1): 53-59. DOI:10.1016/S0167-8140(00)00259-0 |
| [18] |
翁克贵, 吴伟莉, 金风, 等. 动态增强磁共振预测鼻咽癌原发灶化疗疗效的临床研究[J]. 中国肿瘤临床, 2012, 39(24): 2036-2039. Weng KG, Wu WL, Jin F, et al. Clinical study of dynamic enhanced magnetic resonance imaging in predicting the efficacy of primary chemotherapy for nasopharyngeal carcinoma[J]. Chin J Oncol, 2012, 39(24): 2036-2039. DOI:10.3969/j.issn.1000-8179.2012.24.012 |
| [19] |
郭笑寒, 田兴仓, 李文玲, 等. 动态增强MRI对鼻咽癌放化疗疗效的预测价值[J]. 磁共振成像, 2016, 7(11): 837-841. Guo XH, Tian XC, Li WL, et al. Predictive value of dynamic contrast-enhanced MRI in chemoradiotherapy for nasopharyngeal carcinoma[J]. Chin J Magn Reson Imag, 2016, 7(11): 837-841. DOI:10.12015/issn.1674-8034.2016.11.008 |
| [20] |
高影嫦, 李建生, 黄健球, 等. MR动态灌注增强预测鼻咽癌放化疗敏感性研究[J]. 影像诊断与介入放射学, 2016, 25(1): 41-45. Gao YC, Li JS, Huang JQ, et al. Sensitivity of MR dynamic perfusion enhancement in predicting radiotherapy and chemotherapy of nasopharyngeal carcinoma[J]. Imaging Diag Interv Radiol, 2016, 25(1): 41-45. DOI:10.3969/j.issn.1005-8001.2016.01.009 |
| [21] |
Kundu S, Mahantshetty U, Shrivastava SK, et al. Functional magnetic resonance imaging in cervical cancer:current evidence and future directions[J]. J Cancer Res Ther, 2012, 8(1): 11-18. DOI:10.4103/0973-1482.95167 |
| [22] |
Masoud G, Li W. HIF-1alpha pathway:role, regulation and intervention for cancer therapy[J]. Acta Pharm Sin B, 2015, 5(5): 378-389. DOI:10.1016/j.apsb.2015.05.007 |
| [23] |
孟云, 程敬亮, 张春旺. 动态增强MRI在鼻咽癌患者预后评估中的作用研究[J]. 中国CT和MRI杂志, 2016, 14(10): 1-3, 7. Meng Y, Cheng JL, Zhang CW. Study on the role of dynamic enhanced MRI in prognosis evaluation of patients with nasopharyngeal carcinoma[J]. Chin J CT MRI, 2016, 14(10): 1-3, 7. DOI:10.3969/j.issn.1672-5131.2016.10.001 |
| [24] |
Hall DO, Hooper CE, Searle J, et al. 18F-Fluorodeoxyglucose PET/CT and dynamic contrast-enhanced MRI as imaging biomarkers in malignant pleural mesothelioma[J]. Nucl Med Commun, 2018, 39(2): 161-170. DOI:10.1097/MNM.0000000000000789 |
| [25] |
田允铭, 韩非, 曾雷, 等. 鼻咽癌调强放疗后长期生存结果及失败模式分析[J]. 中华放射肿瘤学杂志, 2018, 27(10): 880-885. Tian YM, Han F, Zeng L, et al. Analysis of long-term survival and failure patterns after intensity modulated radiotherapy for nasopharyngeal carcinoma[J]. Chin J Radiat Oncol, 2018, 27(10): 880-885. DOI:10.3760/cma.j.issn.1004-4221.2018.10.002 |
 2020, Vol. 40
2020, Vol. 40


