2. 中国科学院大学附属肿瘤医院 浙江省肿瘤医院放疗科 中国科学院肿瘤与基础医学研究所, 杭州 310022;
3. 中国科学院大学附属肿瘤医院 浙江省肿瘤医院放射科, 杭州 310022
2. Department of Radiation Oncology, Cancer Hospital of University of Chinese Academy of Sciences, Zhejiang Cancer Hospital, Institute of Cancer Research and Basic Medical Sciences of Chinese Academy of Sciences, Hangzhou 310022, China;
3. Department of Radiology, Cancer Hospital of University of Chinese Academy of Sciences, Zhejiang Cancer Hospital, Hangzhou 310022, China
随着低剂量CT筛查的普及,越来越多的患者被诊断为早期肺癌[1-2]。肺叶切除术联合纵隔淋巴结清扫是早期非小细胞肺癌(NSCLC)患者的标准治疗[3-4]。然而,许多患者因无法耐受术后并发症或个人倾向,放弃进行开胸手术。与开放式肺叶切除术相比,胸腔镜(video-assisted thoracoscopic surgery,VATS)肺叶切除术术后并发症发生率低,术后功能恢复好[5-8],扩大了可手术患者的人群。立体定向放疗(stereotactic body radiotherapy,SBRT)具有分割次数少、有效剂量高的特点,其通过精确的图像引导对肿瘤靶区进行高剂量照射,在靶区外剂量跌落迅速,从而可以在有效消融肿瘤的同时,保护周围组织[9]。美国国立综合癌症网络(NCCN)临床实践指南和欧洲肿瘤内科学会(ESMO)共识中,均建议将SBRT作为Ⅰ~Ⅱ期NSCLC的非手术治疗选择[10-11]。SBRT的持续发展和引入,将有望改善潜在可手术患者的预后[12-16]。本研究中,通过倾向评分匹配(PSM)分析,比较了VATS和SBRT治疗T1-2N0M0期NSCLC患者的结果。研究表明,这两种治疗方法的效果相近。这为SBRT的适用范围提供指导,并有助于未来设计相关的随机试验。
资料与方法1.研究对象:2012年1月至2016年12月在浙江省肿瘤医院接受VATS肺叶切除术或SBRT治疗的早期NSCLC患者。所有患者治疗前按国际抗癌联盟(UICC)肺癌TNM分期系统第7版进行临床分期,检查包括胸部和上腹部增强CT扫描、全身骨扫描和脑部MRI检查,必要时行PET/CT检查、内超声检查或纵隔镜检查。以T1-2N0M0期NSCLC为纳入条件,即当肿瘤直径≤7 cm时或具有以下任一项:侵犯脏层胸膜,累及主支气管,距隆突≥2 cm,部分肺不张;无淋巴结转移和远处转移。排除标准:肿瘤直径>5.0 cm;生物学等效剂量(biological equivalent dose,BED) < 100 Gy。
2.治疗程序:对肺功能良好且无其他严重合并症的患者进行VATS肺叶切除术。手术在全身麻醉下,通过双腔支气管导管在单侧卧位进行单肺通气,常规行纵隔淋巴结清扫术。经外科医生评估后不可手术患者则接受SBRT。患者通过热塑体模或真空负压袋进行体位固定,平静呼吸状态下行4D平扫/增强扫描或普通平扫/增强扫描,扫描范围包括第4颈椎上缘到第2腰椎下缘,层厚3~ 5 mm。在CT模拟透视下记录普通扫描患者的病灶呼吸活动度,根据肿瘤移动范围确定内肿瘤靶体积(internal gross tumor volume, IGTV)。4D-CT扫描以10%为呼吸时相间隔,每层面包括10个呼吸时相图像,再由10个呼吸时相CT图像融合而成的最大密度投影(maximum intensity projection, MIP)图像上合并同时参考放疗前胸部CT或PET-CT结果,对比肺窗及纵隔窗进行IGTV勾画。计划靶体积(planning target volume, PTV)在IGTV范围前后左右外扩3~5 mm。同时勾画包括脊髓、两侧肺、气管、胸壁、臂丛神经、心脏和食管等周围危及器官(organ at risk, OAR)。靶区勾画,适形性以及正常组织的剂量限制参考美国放射治疗协作组(Radiation Therapy Oncology Group,RTOG)0236研究。对于较大(最大截面直径>4 cm)或中央型病灶,通过降低单次剂量、增加照射次数的方式来满足治疗要求[17]。在每次SBRT治疗前,患者均进行CBCT体积图像引导来实现软组织靶标配准。使用公式BEDα/β=nd [1+d/(α/β)]计算BED。式中,n为照射次数,d为分次剂量,肿瘤组织α/β取10。
3.随访:治疗结束后1个月、前2年每3个月、2年后每半年复查一次,如怀疑复发,则进行PET-CT或病理活检。常规复查项目包括记录病史、体格检查和胸部、上腹部增强CT,必要时选择相应检查。局部区域复发(locoregional failure)定义为在PTV及同侧肺门或纵隔淋巴结范围再次明确发现肿瘤证据。局部和区域外的肿瘤发生定义为转移[11, 18]。研究主要分析了两组的总生存率(OS)、局部控制率(locoregional control,LRC)、癌症特异性生存率(cancer-specific survival,CSS)、无病生存率(disease-free survival,DFS)以及相关不良反应。OS以患者开始治疗时间为起点,至患者因任何原因死亡或最近一次随访时间为终点。CSS定义为排除因肿瘤疾病本身和肿瘤治疗相关死亡后所得到的生存时间。DFS定义为从治疗开始至疾病复发或由于疾病进展导致患者死亡的时间。
4.统计学处理:采用SPSS 24.0软件进行统计分析。计量数据成正态分布,连续变量采用两独立样本t检验,分类变量采用χ2检验。采用Kaplan-Meier法计算生存率。使用R MatchIt包执行倾向评分匹配(propensity score matching,PSM)。P < 0.05为差异有统计学意义。
结果1.患者特征:研究共纳入567例有效病例,其中VATS组患者458例,SBRT组109例,匹配前两组基线特征如表 1所示。相比手术组,SBRT组患者具有更低的KPS评分、更差的肺功能和更高的年龄,查尔森合并症指数(Charlson comorbidity index,CCI)较高,并且年龄大于接受VATS肺叶切除术的患者。此外,研究发现男性患者似乎更倾向接受非侵入性治疗。所有放疗患者均接受BED10≥100 Gy(范围100~120 Gy)治疗。SBRT的详细信息剂量分割模式如表 2所示。手术组中,淋巴结清扫数为(13.3±6.3)个,91%的患者的淋巴结清扫数目≥6个。
|
|
表 1 567例早期非小细胞肺癌患者一般临床资料 Table 1 Characteristics of 567 patients with early-stage NSCLC |
|
|
表 2 放疗患者剂量分割模式 Table 2 Fractionation scheme of SBRT patients |
经PSM后共104例患者(52例SBRT治疗的患者和52例VATS治疗的患者)符合进一步分析。SBRT组和VATS组在年龄(中位68岁vs. 67岁)、性别、肿瘤大小(中位2.0 cm vs. 2.0 cm)、CCI和呼吸功能等方面差异无统计学意义(P>0.05),见表 3。
|
|
表 3 倾向匹配后患者一般临床资料 Table 3 Characteristics of patients following propensity score matching |
2.生存分析:随访截至2019年3月。中位随访时间44个月。随访期间,VATS组有4例(8%)患者死亡,SBRT组有7例(14%)患者死亡。死亡患者中9例(82%)是与肿瘤相关;另外2例(18%)患者,其中1例死于肺炎;另例死因不详。VATS组的3年和5年的OS分别为94.2%和91.6%, 而SBRT的3年和5年OS分别为88.6%和79.9%,两组总生存相当(P=0.097,图 1A)。VATS和SBRT的3年期和5年期CSS分别为94.2%,91.6%和92.9%,83.7%(P=0.270,图 1B),两组间CSS无显著差异;在VATS队列中,5例出现局部失败,在SBRT队列有2例。VATS和SBRT的3年、5年LRC分别为94.0%、85.9%和93.5%、93.5% (P=0.621,图 1C),两组间LRC率无显著差异。两组间共有13例患者出现远处转移,其中手术组7例,放疗组6例,最常见的转移部位为肺内转移(n=9)。接受VATS肺叶切除术的患者出现复发的中位时间为27.9个月,SBRT患者为24.9个月。VATS组3年和5年的DFS分别为90.2%和80.5%,SBRT组为84.3%和79.0% (P=0.624,图 1D),两队列间DFS相当。
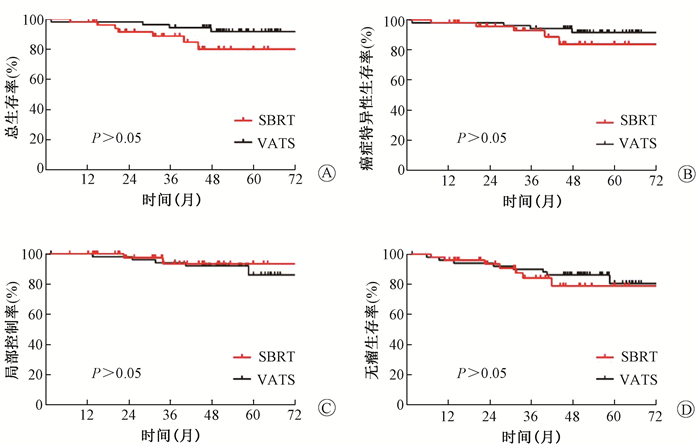
|
图 1 倾向评分匹配后VATS肺叶切除和SBRT治疗患者的总生存率(A)、癌症特异性生存率(B)、局部控制率(C)和无进展生存率(D)的Kaplan-Meier曲线 Figure 1 Kaplan-Meier curves for overall survival rate (A), cancer-specific survival rate (B), locoregional control rate (C), and disease-free survival rate (D) of patients after VATS lobectomy or SBRT following propensity score matching |
3.治疗不良反应:SBRT组中,有18例(35%)患者出现了治疗相关不良反应,以呼吸困难最为常见;分别有14例患者出现1级不良反应,2例患者出现2级不良反应和1例患者出现3级不良反应并发展为放射性肺炎,未见4级或5级不良反应;全身反应以治疗期间的疲劳、厌食为主,对症治疗后症状有效缓解;没有放疗患者在治疗后30 d内发生死亡。手术组中,共有24例(46%)患者出现治疗相关不良反应,以肺炎和胸腔积液为主;分别有13例患者出现1级不良反应,6例患者出现2级不良反应和4例患者出现3级不良反应;有1例(2%)患者因严重肺部感染引起的败血症所致的多器官衰竭而死亡。整体共有2例接受VATS肺叶切除的患者和1例接受SBRT治疗的患者在治疗后90 d内再次进行住院治疗。
讨论肺叶切除联合纵隔淋巴结清扫是早期NSCLC公认的标准治疗[19]。这一标准现在正受到SBRT的挑战,而对于高龄或有严重合并症的患者更是如此。早期有报道显示,即使在可手术的患者中,SBRT也可以达到与手术相当的效果[12, 15, 20-21]。两项前瞻性Ⅱ期临床试验日本临床肿瘤研究组(JCOG) 0403和美国肿瘤放射治疗协作组(RTOG) 0618评估了SBRT在可手术非小细胞肺癌中的作用,结果显示3年总生存期为76%~85%,与手术相当[13-14]。不过,在这些研究中,大多数手术患者接受的是开胸手术,而不是不良反应更轻微的VATS[7, 22-23]。此外,4项正在进行的比较手术与SBRT的随机试验中,没有一项包含了VATS [VALOR (NCT02984761)、POSTILV (NCT01753414)、Stable Mates (NCT01622621)和RAXSIA (NCT03431415)]。因此,在没有充分的前瞻证据来指导临床医生选择治疗早期NSCLC的最佳方案情况下,回顾性研究可能提供一些有效的线索,而本研究可能会给未来比较VATS和SBRT的前瞻试验提供参考。
倾向评分匹配分析在一定意义上可以识别出具有相似特征的患者,使之近似于一项随机对照试验。所以本研究通过倾向匹配分析对VATS肺叶切除术和SBRT进行分析研究。结果表明,接受SBRT治疗的患者的3年和5年CSS与接受VATS的患者相当,两种治疗方法在LRC或DFS中也未观察到明显差异,正如预期的那样,SBRT与VATS两种治疗效果比较一致[22, 24]。
在本研究中,1名资深放射科医师对SBRT患者治疗后影像图像进行复审,以区分放射性肺损伤和肿瘤进展。因为两种治疗方案长期生存相近,我们也对比了两种治疗的不良反应。不过,观察到两组的不良反应都十分有限。在两者临床效果相近的情况下,SBRT与手术相比其治疗相关的发病率和死亡率更低,未来可能会是治疗早期NSCLC更佳的一种选择。
必须承认这项研究存在某些局限性。尽管本研究对分析人群进行倾向匹配,但该研究依然是一项回顾性研究,一些未记录的因素可能会影响分析结果,例如,已经发现鳞状细胞癌和低/未分化的肿瘤与较差的LRC和OS相关[25-26]。其次,接受SBRT的患者只进行了临床分期,而VATS的患者接受了病理分期;由于大多数SBRT患者未进行淋巴结清扫,这些患者的分期可能被低估。此外,研究样本量相对较小、随访时间有限,也可能会影响评估两组疗效的准确性。
综上所述,本研究表明,在倾向匹配分析队列中,SBRT的总体临床疗效与VATS肺叶切除术相当。这些数据可以为临床医生的决策提供参考,但最终需要包含大量病例的随机试验才能准确比较这两种方法的疗效。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及各相关方的利益冲突,对研究的独立性和科学性予以保证
作者贡献声明 钱昆负责实验设计、数据采集和论文撰写;董百强负责数据统计分析;陆芳晓负责患者影像复审;陈明和曹建平负责总体指导和论文修改
| [1] |
Kang HR, Cho JY, Lee SH, et al. Role of low-dose computerized tomography in lung cancer screening among never-smokers[J]. J Thorac Oncol, 2019, 14(3): 436-444. DOI:10.1016/j.jtho.2018.11.002 |
| [2] |
Aberle DR, DeMello S, Berg CD, et al. Results of the two incidence screenings in the National Lung Screening Trial[J]. N Engl J Med, 2013, 369(10): 920-931. DOI:10.1056/NEJMoa1208962 |
| [3] |
Howington JA, Blum MG, Chang AC, et al. Treatment of stage Ⅰ and Ⅱ non-small cell lung cancer:Diagnosis and management of lung cancer, 3rd ed:American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5 Suppl): e278S-e313S. DOI:10.1378/chest.12-2359 |
| [4] |
Aberle DR, DeMello S, Berg CD, et al. Results of the two incidence screenings in the National Lung Screening Trial[J]. N Engl J Med, 2013, 369(10): 920-931. DOI:10.1056/NEJMoa1208962 |
| [5] |
Nwogu CE, D'Cunha J, Pang H, et al. VATS lobectomy has better perioperative outcomes than open lobectomy:CALGB 31001, an ancillary analysis of CALGB 140202(Alliance)[J]. Ann Thorac Surg, 2015, 99(2): 399-405. DOI:10.1016/j.athoracsur.2014.09.018 |
| [6] |
Burt BM, Kosinski AS, Shrager JB, et al. Thoracoscopic lobectomy is associated with acceptable morbidity and mortality in patients with predicted postoperative forced expiratory volume in 1 second or diffusing capacity for carbon monoxide less than 40% of normal[J]. J Thorac Cardiovasc Surg, 2014, 148(1): 19-29. DOI:10.1016/j.jtcvs.2014.03.007 |
| [7] |
Paul S, Sedrakyan A, Chiu YL, et al. Outcomes after lobectomy using thoracoscopy vs. thoracotomy:a comparative effectiveness analysis utilizing the nationwide inpatient sample database[J]. Eur J Cardiothorac Surg, 2013, 43(4): 813-817. DOI:10.1093/ejcts/ezs428 |
| [8] |
Detillon D, Veen EJ. Postoperative outcome after pulmonary surgery for non-small cell lung cancer in elderly patients[J]. Ann Thorac Surg, 2018, 105(1): 287-293. DOI:10.1016/j.athoracsur.2017.07.032 |
| [9] |
Tandberg DJ, Tong BC, Ackerson BG, et al. Surgery versus stereotactic body radiation therapy for stage Ⅰ non-small cell lung cancer:A comprehensive review[J]. Cancer, 2018, 124(4): 667-678. DOI:10.1002/cncr.31196 |
| [10] |
Vansteenkiste J, Crino L, Dooms C, et al. 2nd ESMO Consensus Conference on Lung Cancer:early-stage non-small-cell lung cancer consensus on diagnosis, treatment and follow-up[J]. Ann Oncol, 2014, 25(8): 1462-1474. DOI:10.1093/annonc/mdu089 |
| [11] |
Grills IS, Mangona VS, Welsh R, et al. Outcomes after stereotactic lung radiotherapy or wedge resection for stage Ⅰ non-small-cell lung cancer[J]. J Clin Oncol, 2010, 28(6): 928-935. DOI:10.1200/jco.2009.25.0928 |
| [12] |
Tandberg DJ, Tong BC, Ackerson BG, et al. Surgery versus stereotactic body radiation therapy for stage Ⅰ non-small cell lung cancer:A comprehensive review[J]. Cancer, 2018, 124(4): 667-678. DOI:10.1002/cncr.31196 |
| [13] |
Timmerman RD, Paulus R, Pass HI, et al. Stereotactic body radiation therapy for operable early-stage lung cancer:findings from the NRG Oncology RTOG 0618 Trial[J]. JAMA Oncol, 2018, 4(9): 1263-1266. DOI:10.1001/jamaoncol.2018.1251 |
| [14] |
Nagata Y, Hiraoka M, Shibata T, et al. Prospective trial of stereotactic body radiation therapy for both operable and inoperable T1N0M0 non-small cell lung cancer:Japan Clinical Oncology Group Study JCOG0403[J]. Int J Radiat Oncol Biol Phys, 2015, 93(5): 989-996. DOI:10.1016/j.ijrobp.2015.07.2278 |
| [15] |
Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage Ⅰ non-small-cell lung cancer:a pooled analysis of two randomised trials[J]. Lancet Oncol, 2015, 16(6): 630-637. DOI:10.1016/s1470-2045(15)70168-3 |
| [16] |
Lagerwaard FJ, Verstegen NE, Haasbeek CJ, et al. Outcomes of stereotactic ablative radiotherapy in patients with potentially operable stage Ⅰ non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1): 348-353. DOI:10.1016/j.ijrobp.2011.06.2003 |
| [17] |
Videtic GMM, Donington J, Giuliani M, et al. Stereotactic body radiation therapy for early-stage non-small cell lung cancer:executive summary of an ASTRO evidence-based guideline[J]. Pract Radiat Oncol, 2017, 7(5): 295-301. DOI:10.1016/j.prro.2017.04.014 |
| [18] |
Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-1076. DOI:10.1001/jama.2010.261 |
| [19] |
Ettinger DS, Wood DE, Akerley W, et al. NCCN guidelines insights:non-small cell lung cancer, version 4.2016[J]. J Natl Compr Canc Netw, 2016, 14(3): 255-264. DOI:10.6004/jnccn.2016.0031 |
| [20] |
Palma DA, Senan S. Improving outcomes for high-risk patients with early-stage non-small-cell lung cancer:insights from population-based data and the role of stereotactic ablative radiotherapy[J]. Clin Lung Cancer, 2013, 14(1): 1-5. DOI:10.1016/j.cllc.2012.06.005 |
| [21] |
Louie AV, Rodrigues G, Hannouf M, et al. Stereotactic body radiotherapy versus surgery for medically operable Stage Ⅰ non-small-cell lung cancer:a Markov model-based decision analysis[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): 964-973. DOI:10.1016/j.ijrobp.2010.06.040 |
| [22] |
Paul S, Isaacs AJ, Treasure T, et al. Long term survival with thoracoscopic versus open lobectomy:propensity matched comparative analysis using SEER-medicare database[J]. BMJ, 2014, 349: g5575. DOI:10.1136/bmj.g5575 |
| [23] |
Zhang Z, Zhang Y, Feng H, et al. Is video-assisted thoracic surgery lobectomy better than thoracotomy for early-stage non-small-cell lung cancer? A systematic review and meta-analysis[J]. Eur J Cardiothorac Surg, 2013, 44(3): 407-414. DOI:10.1093/ejcts/ezt015 |
| [24] |
Verstegen NE, Oosterhuis JW, Palma DA, et al. Stage Ⅰ-Ⅱ non-small-cell lung cancer treated using either stereotactic ablative radiotherapy (SABR) or lobectomy by video-assisted thoracoscopic surgery (VATS):outcomes of a propensity score-matched analysis[J]. Ann Oncol, 2013, 24(6): 1543-1548. DOI:10.1093/annonc/mdt026 |
| [25] |
Woody NM, Stephans KL, Andrews M, et al. A histologic basis for the efficacy of SBRT to the lung[J]. J Thorac Oncol, 2017, 12(3): 510-519. DOI:10.1016/j.jtho.2016.11.002 |
| [26] |
Leeman JE, Rimner A, Montecalvo J, et al. Histologic subtype in core lung biopsies of early-stage lung adenocarcinoma is a prognostic factor for treatment response and failure patterns after stereotactic body radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2017, 97(1): 138-145. DOI:10.1016/j.ijrobp.2016.09.037 |
 2020, Vol. 40
2020, Vol. 40


