射频辐射(radiofrequency, RF)是指频率在100 kHz~300 GHz的电磁辐射,主要由无线通讯设备包括手机、Wi-Fi、雷达等产生。其中,5.8 GHz频段是开放的、较少被使用的公共无线频段,其带宽高、干扰低。因此,5.8 GHz无线技术有望代替目前主流的2.4 GHz无线技术。我国现已将5.8 GHz频段作为点对点或点对多点扩频通信系统、高速无线局域网、宽带无线接入系统、蓝牙技术设备及车辆无线自动识别系统等无线电台站的共用频段。迄今为止,5.8 GHz RF是否引起神经行为尤其是学习记忆能力改变,少见报道。为科学评价5.8 GHz RF的潜在健康危害提供理论和实验参考,本研究探讨了5.8 GHz RF对大鼠学习记忆能力和海马神经元突触可塑性的影响。
材料与方法1.动物分组和取材:56只健康成年雄性Sprague-Dawley大鼠购自空军军医大学动物实验中心,体重(180±3)g,合格证号:XK(陕2014-002)。实验前,所有动物适应饲养环境3 d。动物饲养在(23±2)℃的恒温环境中,湿度保持在40%~70%,保证每天12 h的光照并避免噪音,饲养期间所有动物可自由摄食。所有实验均获得了空军军医大学伦理委员会的批准(20170606)。大鼠用随机数表法分为假暴露组(Sham)和射频暴露组(RF),每组28只,于暴露后不同时间点(15和30 d)进行实验,每个时间点每组各14只。
2.射频暴露系统及暴露参数:本研究应用的射频暴露源由西北核技术研究所提供,该装置由信号发生器、放大器和天线3部分组成。暴露组动物自由体位放置于距离信号源3.3 m处的有机玻璃盒内(26 cm×8 cm×7 cm,各壁均有气孔)。暴露参数为:频率5.8 GHz,平均功率密度74.25 W/m2,全身比吸收率1.15 W/kg,每天暴露1 h,连续暴露15或30 d。Sham组动物处理方式同RF组,但无RF输出。
3. Morris水迷宫实验:每组10只大鼠分2批在第10~15天及第25~30天进行Morris水迷宫实验,第10~14天及第25~29天进行定向巡航训练,第15及30天进行空间探索测试。实验时水温保持(22±1)℃,水中倒入墨汁以避免大鼠观察水池底(圆柱形水池直径150 cm,高50 cm)。定向巡航训练期间,逃生平台(直径12 cm)位于水下2 cm处。连续训练5 d,每天4次,每次选择不同象限的入水点将大鼠轻放入水中允许其自由探索1 min;空间探索测试期间,撤去平台,任其自由探索1 min[1]。实验期间录像对大鼠的定向巡航训练阶段的逃逸潜伏期,空间探索测试阶段的首次到达平台潜伏期、穿越平台的次数以及平台所在象限停留时间百分比进行分析,以观察其空间学习记忆能力。
4. Nissl染色:每组3只大鼠以1%戊巴比妥钠按60 mg/kg体重剂量腹腔注射麻醉,生理盐水心脏灌注冲去残血,4%多聚甲醛快速灌注10 min后转为缓慢滴灌20 min,灌注结束后断头取脑,4%多聚甲醛4℃后固定过夜。次日修剪脑组织块、梯度乙醇脱水、石蜡包埋。用石蜡切片机(德国Leica公司)作大鼠海马区冠状切片,切片厚度4 μm。Nissl染色时,生物透明剂透明后梯度乙醇复水后进行染色,使用甲苯胺蓝法Nissl染色试剂盒(北京Solarbio科技有限公司)进行具体染色操作。中性树胶封片后避光干燥24 h,显微镜下(德国Leica公司)拍照观察海马区结构形态,200倍镜下检测每视野内CA1区及DG区神经元数量。
5. Golgi染色:每组3只大鼠腹腔麻醉后快速断头取脑,脑组织置于提前1 d配置好的Golgi溶液(A液:B液=1:1)中浸泡2周后,更换C液浸泡1周。用冰冻切片机(德国Leica公司)作大鼠海马区冠状切片,切片厚度150 μm。切片干燥后去离子水清洗并用Golgi溶液(D :E :去离子水=1:1 :2)染色,梯度乙醇脱水,生物透明剂透明,中性树胶封片。具体操作步骤参考FD Rapid Goigi stain kit说明书(美国FD Neurotech公司)。通风条件下避光干燥24 h后,显微镜下(日本Olympus公司)拍照观察海马CA1区锥体神经元二三级树突中段树突棘,用Fiji分析树突棘密度(个/10 μm)。
6.蛋白质免疫印迹实验(Western blot):每组3只大鼠腹腔麻醉后快速断头取脑,预冷的磷酸盐缓冲液(PBS)冲洗,冰上快速剥离海马组织。海马组织称重后按1 g :10 ml加入含蛋白酶抑制剂和磷酸酶抑制剂的组织裂解液,匀浆后离心15 min(4℃,12 000 r/min,离心半径8.4 cm),收集上清液。二辛可酸(BCA)法测定蛋白浓度后按1:4加入5×上样缓冲液,100℃金属浴10 min,冷却备用。制备聚丙烯酰胺凝胶后按20 μg/孔等质量上样,80 V恒压电泳、250 mA恒流转膜,5%脱脂牛奶封闭1 h后,兔抗PSD95(1:300,英国Abcam公司)、鼠抗Synaptophysin(1:1 000,美国Sigma公司)、鼠抗β-肌动蛋白(1:5 000,美国CMCTAG公司)等一抗孵育过夜,相应二抗室温孵育2 h,化学发光法发光并照相,Quantity One分析条带灰度值。
7.神经递质检测:每组5只大鼠腹腔麻醉后快速断头取脑,预冷的PBS冲洗,冰上快速剥离海马组织。海马组织称重后按1 g :10 ml加入预冷的甲酸乙腈溶液(乙腈:甲酸:去离子水=1:9 :9 000),匀浆后离心15 min(4℃,12 000 r/min,离心半径8.4 cm)收集上清液。上清液经0.22 μm微孔膜过滤后,液相色谱-质谱联用仪(LC-MS)(美国SCIEX公司)检测单胺类递质(多巴胺、乙酰胆碱、去甲肾上腺素、5\|羟色胺)、氨基酸类递质(组氨酸、甘氨酸、谷氨酸、γ-氨基丁酸、天冬氨酸)、肽类递质(亮氨酸脑啡肽、蛋氨酸脑啡肽、普罗瑞林)等。
8.统计学处理:采用SPSS 20.0进行数据统计分析,所有数据符合正态分布,以 x±s表示。两组间均数比较采用两独立样本t检验。P<0.05为差异有统计学意义。
结果1.大鼠学习记忆行为的变化:由图 1可见,Morris水迷宫实验是评价大鼠空间学习记忆能力的一种常用方法。本研究结果显示,在定向巡航阶段,大鼠逃逸潜伏期随着训练时间的延长而缩短,但各组间差异无统计学意义(P>0.05)。Sham 15 d组、RF 15 d组、Sham 30 d组、RF 30 d组在空间探索阶段,各组大鼠穿过平台的次数(3.60±0.52、3.50±0.62、3.40±0.45、3.10±0.64)、目标象限停留时间百分比(27.07%±1.58%、28.87%±1.55%、29.83%±2.54%、29.33%±2.30%)、首次到达平台的潜伏期[(9.02±1.68)、(8.38±0.76)、(8.40±1.76)、(9.38±1.37)s]等指标差异均无统计学意义(P>0.05)。提示在本实验条件下,5.8 GHz RF暴露15及30 d不能引起大鼠空间学习记忆行为的明显改变。
|
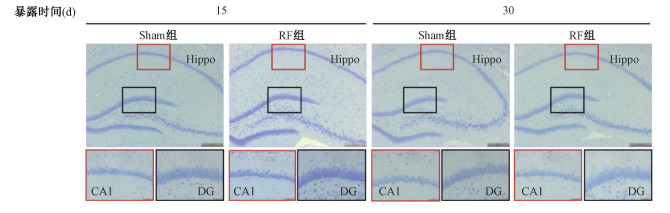
图 1 5.8 GHz RF暴露对大鼠海马形态结构的影响Nissl染色Hippo区×50、CA1区×200、DG区×200 Figure 1 The influence of 5.8 GHz RF exposure on the morphology of hippocampus Nissl stain Hippo ×50, CA1 ×200, DG ×200 |
2.大脑海马形态结构的变化:Nissl染色结果显示,各组大鼠海马神经元均排列紧密,Nissl体呈斑驳状,RF暴露后,Sham 15 d组、RF 15 d组、Sham 30 d组、RF 30 d组每视野CA1区神经元数量分别为148.67±12.44、133.00±8.29、138.00±6.36、140.00±3.18;每视野DG区神经元数量分别为308.00±17.03、302.33±21.42、296.00±8.89、291.33±4.91,各组间海马CA1区及DG区神经元数量差异无统计学意义(P>0.05)。提示本实验条件下5.8 GHz RF暴露15及30 d不能引起大鼠海马形态结构及神经元数量的变化(图 1)。
3.大脑海马CA1区树突棘密度的变化:Golgi染色结果显示,Sham 15 d组、RF 15 d组、Sham 30 d组、RF 30 d组顶树突棘密度分别为(5.10±0.20)、(4.89±0.24)、(4.58±0.27)、(4.49±0.24)个/10 μm;基树突棘密度分别为(4.81±0.17)、(4.79±0.34)、(4.20±0.27)、(4.22±0.17)个/10 μm。RF 15 d组及RF 30 d组大鼠顶树突棘及基树突棘密度与Sham组相比,差异均无统计学意义(P>0.05)。提示本实验条件下5.8 GHz RF暴露15及30 d不能引起大鼠海马CA1区锥体神经元树突棘密度的明显改变(图 2)。

|
图 2 5.8 GHz RF暴露对大鼠CA1区树突棘密度的影响Golgi染色×1 000 Figure 2 The influence of 5.8 GHz RF exposure on the dendritic spines in CA1 region Golgi stain ×1000 |
4.大脑海马区突触相关蛋白的变化:结果显示,Sham 15 d组、RF 15 d组、Sham 30 d组、RF 30 d组海马组织内突触后致密蛋白PSD95相对表达量分别为0.99±0.04、0.95±0.07、1.05±0.07、0.96±0.07;突触小泡蛋白Synaptophysin相对表达量分别为1.11±0.10、1.02±0.03、1.01±0.05、0.94±0.04。RF 15 d组及RF 30 d组大鼠海马组织内突触相关蛋白(PSD95、Synaptophysin)表达水平与Sham组相比,差异均无统计学意义(P>0.05)。提示本实验条件下5.8 GHz RF暴露15及30 d不能引起大鼠海马组织内突触相关蛋白表达水平的改变(图 3)。

|
1.Sham 15 d;2.RF 15 d;3.Sham 30 d;4.RF 30 d 图 3 5.8 GHz RF暴露对大鼠海马区突触相关蛋白表达的影响 Figure 3 The influence of 5.8 GHz RF exposure on the expression of synaptic related proteins of hippocampus |
5.大脑海马神经递质表达水平的变化:LC-MS结果显示,RF 15 d组及RF 30 d组大鼠海马组织内多种神经递质含量与Sham组相比,差异均无统计学意义(P>0.05)。提示本实验条件下5.8 GHz RF暴露15及30 d未能引起大鼠海马组织内神经递质表达水平的改变(表 1)。
|
|
表 1 5.8 GHz RF暴露对大鼠海马神经递质含量的影响(ng/ml,x±s) Table 1 The influence of 5.8 GHz RF exposure on the level of neurotransmitters in hippocampus(ng/ml, x±s) |
讨论
目前,RF是否可诱发学习记忆障碍仍然存在争议。一些流行病学调查研究报道RF可引起的神经性认知障碍,甚至会增加神经退行性病变的风险,但也有流行病学调查结果显示,RF暴露对人体无害[3-8]。不同实验室的研究也表明,不同频率、强度及时间的RF暴露可对啮齿类动物学习记忆产生不同甚至相反的实验结果[9-13]。5.8 GHz无线技术良好的应用前景也引起了公众对5.8 GHz RF对人体健康特别是对大脑影响的关注。本研究以Morris水迷宫实验检测5.8 GHz RF暴露对学习记忆行为的影响,以海马区神经元数量、树突棘密度、突触相关蛋白表达水平以及神经递质含量为主要检测指标,探讨5.8 GHz RF暴露对海马区神经元突触可塑性的影响。
Morris水迷宫实验可较好地反映大鼠空间学习记忆能力。本实验中5.8 GHz(1 h/d,1.15 W/kg) RF暴露15及30 d,暴露后RF组大鼠Morris水迷宫实验中多项指标与Sham组相比,差异均无统计学意义。Daniels等[9]研究结果显示,RF暴露后大鼠Morris水迷宫实验中空间记忆行为无明显变化;Dubreuil等[10]利用八臂迷宫实验和新物体识别实验观察大鼠RF暴露对学习记忆行为的影响,也没有发现阳性结果;本实验结果与上述文献结果一致。Tan等[11]研究发现,1.5 GHz(6 min,1.8 W/kg)及2.856 GHz(6 min,1.7 W/kg)RF单次暴露后大鼠学习记忆行为没有明显的改变,但1.5 GHz(6 min,3.7 W/kg)及2.856 GHz(6 min,3.3 W/kg)RF单次暴露可显著延长大鼠在Morris水迷宫实验中的逃逸潜伏期;Shahin等[12]研究表明,2.45 GHz(2 h/d,0.014 6 W/kg) RF暴露15 d可通过诱导小鼠神经元凋亡,从而导致Morris水迷宫实验中多项指标的显著改变。本研究中5.8 GHz RF暴露对大鼠学习记忆行为无明显影响,推测本实验条件下RF暴露即便可以引起大鼠学习记忆物质基础的改变,但或是这些改变轻微且可逆,或是大鼠对其有良好的适应性,不足以引起学习记忆行为的明显改变。
海马区与学习、记忆等高级脑功能密切相关,海马区的正常形态结构是维持其正常功能的物质基础[14]。Nissl染色可标记神经元,观察是否神经元丢失,在病理情况下,Nissl体减少还可提示神经元蛋白合成能力的减弱。本实验中,RF组海马CA1及DG区神经元排列紧密,神经元数量均没有显著的降低。有报道称,RF暴露可引起大鼠大脑海马神经元凋亡或自噬[15-16]。Karimi等[17]研究发现,2.45 GHz(2 h/d,0.017 W/kg)RF暴露40 d后大鼠海马CA1区神经元密度明显降低。Tan等[11]研究结果显示,RF暴露后Nissl体数量的减少与暴露强度有关而与暴露频率的无关,暴露强度较低时,Nissl体数量无明显变化。本实验中神经元数量未见显著减少,可能与本实验的暴露强度较低有关。
突触可塑性是学习和记忆的物质基础,包括与储存信息有关的突触形态、突触相关蛋白及神经递质表达变化的结构可塑性和传递信息有关的长时程增强或长时程抑制的功能可塑性[18-20]。树突棘是形成突触的主要部位,也是神经元接受和传递信息的重要结构,突触相关蛋白(PSD95和Synaptophysin)与神经递质的改变可引起神经元兴奋性的变化,这些变化与突触可塑性密切相关[21-24]。本研究结果显示,5.8 GHz暴露后,RF组大鼠海马CA1区锥体神经元树突棘的密度、海马组织突触相关蛋白表达水平以及神经递质含量检测均未发现有显著的改变,提示本实验条件下,大鼠海马区突触结构可塑性与功能可塑性没有显著变化。Pakhomov等[25]研究结果也显示,9.3 GHz高功率微波辐射也不能引起大鼠海马神经元突触可塑性的变化。本实验结果与此一致。但是也有研究发现,RF暴露不仅可引起突触结构可塑性的损伤,也可以减少兴奋性突触的生成,引起突触功能可塑性如长时程增强、递质代谢等改变[12, 26-27]。神经元的基本功能如神经递质释放、酶激活、细胞内信号转导和基因表达等大都依赖于Ca2+内流。已有研究表明,RF暴露对大鼠海马及皮层神经元Ca2+稳态无明显影响[28-29]。5.8 GHz RF暴露是否可以通过诱导神经元Ca2+稳态变化引起长时程增强或长时程抑制,从而导致学习记忆行为的改变,仍有待进一步研究。RF暴露对生物体造成损伤的程度与其频率、强度、暴露时间以及辐射源与暴露目标的耦合程度密切相关。目前,5.8 GHz RF暴露的生物体效应研究少见报道,对学习记忆的研究更是罕见。现有的研究也多为阴性结果,如Miyakoshi等[30]研究发现5.8 GHz(24 h,1 mW/cm2)RF暴露对人眼细胞的微核形成、DNA链断裂和HSP表达几乎没有影响;Kuzniar等[31]以5.8 GHz(24 h,9.5 V/mRMS)RF对人骨肉瘤细胞、人成纤维细胞以及小鼠胚胎干细胞进行暴露,结果显示RF暴露后只有不到1%的蛋白质出现蛋白质丰度的微小变化。由于不同组织细胞对射频辐射的敏感性或耦合程度不一致,现有的5.8 GHz RF暴露的研究均为离体实验且暴露程序(单次长时间暴露)也与本实验存在差异,故现有研究对本实验研究的参考意义有限。而本研究结果与部分其他实验室的研究结果不一致的原因可能与本实验的暴露条件有关,如频率较高,暴露强度及暴露时间也有区别等;另外,5.8 GHz RF是否与大鼠海马区神经元耦合程度较低,难以产生较为显著的生物学效应,也需要进一步研究。
综上所述,本实验条件下5.8 GHz RF暴露没有引起大鼠学习记忆行为的明显改变,也没有引起海马区神经元突触可塑性的显著变化,增加暴露的时间和强度是否会对学习记忆行为及突触可塑性产生影响有待进一步研究。
利益冲突 无
作者贡献声明 芮刚负责实验操作、数据采集、统计分析和论文撰写;刘力源、郭玲、薛一哲、来盼盼、高鹏协助实验操作、数据采集;林加金负责暴露参数计算与核实;邢俊玲、丁桂荣负责指导课题设计和修改论文
| [1] |
Vorhees CV, Williams MT. Morris water maze:procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc, 2006, 1(2): 848-858. DOI:10.1038/nprot.2006.116 |
| [2] |
Hutter HP, Moshammer H, Wallner P, et al. Subjective symptoms, sleeping problems, and cognitive performance in subjects living near mobile phone base stations[J]. Occup Environ Med, 2006, 63(5): 307-313. DOI:10.1136/oem.2005.020784 |
| [3] |
Abdel-Rassoul G, El-Fateh OA, Salem MA, et al. Neurobehavioral effects among inhabitants around mobile phone base stations[J]. Neurotoxicology, 2007, 28(2): 434-440. DOI:10.1016/j.neuro.2006.07.012 |
| [4] |
Gunnarsson LG, Bodin L. Occupational exposures and neurodegenerative diseases:a systematic literature review and meta-analyses[J]. Int J Environ Res Public Health, 2019, 16(3): 337. DOI:10.3390/ijerph16030337 |
| [5] |
Belyaev I, Dean A, Eger H, et al. EUROPAEM EMF Guideline 2016 for the prevention, diagnosis and treatment of EMF-related health problems and illnesses[J]. Rev Environ Health, 2016, 31(3): 363-397. DOI:10.1515/reveh-2016-0011 |
| [6] |
Andel R, Crowe M, Feychting M, et al. Work-related exposure to extremely low-frequency magnetic fields and dementia:results from the population-based study of dementia in Swedish twins[J]. J Gerontol A Biol Sci Med Sci, 2010, 65(11): 1220-1227. DOI:10.1093/gerona/glq112 |
| [7] |
Repacholi MH, Lerchl A, Röösli M, et al. Systematic review of wireless phone use and brain cancer and other head tumors[J]. Bioelectromagnetics, 2012, 33(3): 187-206. DOI:10.1002/bem.20716 |
| [8] |
Jarideh S, Taeb S, Pishva SM, et al. Does occupational exposure of Shahid Dastghieb international airport workers to radiofrequency radiation affect their short term memory and reaction time?[J]. J Biomed Phys Eng, 2015, 5(3): 143-150. |
| [9] |
Daniels WM, Pitout IL, Afullo TJ, et al. The effect of electromagnetic radiation in the mobile phone range on the behaviour of the rat[J]. Metab Brain Dis, 2009, 24(4): 629-641. DOI:10.1007/s11011-009-9164-3 |
| [10] |
Dubreuil D, Jay T, Edeline JM. Head-only exposure to GSM 900-MHz electromagnetic fields does not alter rat's memory in spatial and non-spatial tasks[J]. Behav Brain Res, 2003, 145(1-2): 51-61. DOI:10.1016/s0166-4328(03)00100-1 |
| [11] |
Tan S, Wang H, Xu X, et al. Study on dose-dependent, frequency-dependent, and accumulative effects of 1.5 GHz and 2.856 GHz microwave on cognitive functions in Wistar rats[J]. Sci Rep, 2017, 7(1): 10781. DOI:10.1038/s41598-017-11420-9 |
| [12] |
Shahin S, Banerjee S, Singh SP, et al. 2.45 GHz microwave radiation impairs learning and spatial memory via oxidative/nitrosative stress induced p53-dependent/independent hippocampal apoptosis:molecular basis and underlying mechanism[J]. Toxicol Sci, 2015, 148(2): 380-399. DOI:10.1093/toxsci/kfv205 |
| [13] |
Son Y, Kim JS, Jeong YJ, et al. Long-term RF exposure on behavior and cerebral glucose metabolism in 5xFAD mice[J]. Neurosci Lett, 2018, 666: 64-69. DOI:10.1016/j.neulet.2017.12.042 |
| [14] |
Basu J, Siegelbaum SA. The corticohippocampal circuit, synaptic plasticity, and memory[J]. Cold Spring Harb Perspect Biol, 2015, 7(11). DOI:10.1101/cshperspect.a021733 |
| [15] |
Ertilav K, Uslusoy F, Ataizi S, et al. Long term exposure to cell phone frequencies (900 and 1800 MHz) induces apoptosis, mitochondrial oxidative stress and TRPV1 channel activation in the hippocampus and dorsal root ganglion of rats[J]. Metab Brain Dis, 2018, 33(3): 753-763. DOI:10.1007/s11011-017-0180-4 |
| [16] |
Kim JH, Yu DH, Kim HJ, et al. Exposure to 835 MHz radiofrequency electromagnetic field induces autophagy in hippocampus but not in brain stem of mice[J]. Toxicol Ind Health, 2018, 34(1): 23-35. DOI:10.1177/0748233717740066 |
| [17] |
Karimi N, Bayat M, Haghani M, et al. 2.45 GHz microwave radiation impairs learning, memory, and hippocampal synaptic plasticity in the rat[J]. Toxicol Ind Health, 2018, 34(12): 873-883. DOI:10.1177/0748233718798976 |
| [18] |
Caroni P, Donato F, Muller D. Structural plasticity upon learning:regulation and functions[J]. Nat Rev Neurosci, 2012, 13(7): 478-490. DOI:10.1038/nrn3258 |
| [19] |
Bliss TV, Collingridge GL. A synaptic model of memory:long-term potentiation in the hippocampus[J]. Nature, 1993, 361(6407): 31-39. DOI:10.1038/361031a0 |
| [20] |
Collingridge GL, Peineau S, Howland JG, et al. Long-term depression in the CNS[J]. Nat Rev Neurosci, 2010, 11(7): 459-473. DOI:10.1038/nrn2867 |
| [21] |
Becher A, Drenckhahn A, Pahner I, et al. The synaptophysin-synaptobrevin complex:a hallmark of synaptic vesicle maturation[J]. J Neurosci, 1999, 19(6): 1922-1931. DOI:10.1523/JNEUROSCI.19-06-01922.1999 |
| [22] |
El-Husseini AE, Schnell E, Chetkovich DM, et al. PSD-95 involvement in maturation of excitatory synapses[J]. Science, 2000, 290(5495): 1364-1368. DOI:10.1126/science.290.5495.1364 |
| [23] |
Segal M. Dendritic spines, synaptic plasticity and neuronal survival:activity shapes dendritic spines to enhance neuronal viability[J]. Eur J Neurosci, 2010, 31(12): 2178-2184. DOI:10.1111/j.1460-9568.2010.07270.x |
| [24] |
Lovinger DM. Neurotransmitter roles in synaptic modulation, plasticity and learning in the dorsal striatum[J]. Neuropharmacology, 2010, 58(7): 951-961. DOI:10.1016/j.neuropharm.2010.01.008 |
| [25] |
Pakhomov AG, Doyle J, Stuck BE, et al. Effects of high power microwave pulses on synaptic transmission and long term potentiation in hippocampus[J]. Bioelectromagnetics, 2003, 24(3): 174-181. DOI:10.1002/bem.10079 |
| [26] |
Zhao XY, Liu MG, Yuan DL, et al. Nociception-induced spatial and temporal plasticity of synaptic connection and function in the hippocampal formation of rats:a multi-electrode array recording[J]. Mol Pain, 2009, 5: 55. DOI:10.1186/1744-8069-5-55 |
| [27] |
Xu S, Ning W, Xu Z, et al. Chronic exposure to GSM 1800-MHz microwaves reduces excitatory synaptic activity in cultured hippocampal neurons[J]. Neurosci Lett, 2006, 398(3): 253-257. DOI:10.1016/j.neulet.2006.01.004 |
| [28] |
O'Connor RP, Madison SD, Leveque P, et al. Exposure to GSM RF fields does not affect calcium homeostasis in human endothelial cells, rat pheocromocytoma cells or rat hippocampal neurons[J]. PLoS One, 2010, 5(7). DOI:10.1371/journal.pone.0011828 |
| [29] |
Platano D, Mesirca P, Paffi A, et al. Acute exposure to low-level CW and GSM-modulated 900 MHz radiofrequency does not affect Ba2+ currents through voltage-gated calcium channels in rat cortical neurons[J]. Bioelectromagnetics, 2007, 28(8): 599-607. DOI:10.1002/bem.20345 |
| [30] |
Miyakoshi J, Tonomura H, Koyama S, et al. Effects of exposure to 5.8 GHz electromagnetic field on micronucleus formation, DNA strand breaks, and heat shock protein expressions in cells derived from human eye[J]. IEEE Trans Nanobioscience, 2019, 18(2): 257-260. DOI:10.1109/TNB.2019.2905491 |
| [31] |
Kuzniar A, Laffeber C, Eppink B, et al. Semi-quantitative proteomics of mammalian cells upon short-term exposure to non-ionizing electromagnetic fields[J]. PLoS One, 2017, 12(2). DOI:10.1371/journal.pone.0170762 |
 2020, Vol. 40
2020, Vol. 40


