宫颈癌是常见的女性恶性肿瘤,其发病率和死亡率均排在全球女性恶性肿瘤的第4位[1]。放射治疗在宫颈癌的治疗中占有重要的地位。调强放射治疗(IMRT)技术目前已得到广泛应用,可以减少危及器官的受照剂量,同时获得满意的靶区覆盖率[2]。随着宫颈癌患者治疗疗效的改善,对患者不良反应的管理变得越来越重要。对于接受放射治疗的患者,早期不良反应会影响治疗的强度和进程,并且降低了患者的生活质量[3-4]。本研究对接受术后调强放疗的宫颈癌患者进行分析,评估早期不良反应的发生率及其影响因素。
资料与方法1.患者资料:本研究回顾了2014年1月至2017年12月在苏州大学附属第二医院行术后调强放射治疗的宫颈癌患者共106例。初诊时平均年龄为49.0岁(范围28~88岁), 患者的临床特征列于表 1。所有患者均使用2009年版国际妇产科联盟(FIGO)分期系统。有99例患者接受常规手术方式,即全子宫切除术+双侧附件切除术+盆腔淋巴结清扫术。2例患者仅行全子宫切除术,5例患者行全子宫切除术+双侧附件切除术,未行盆腔淋巴结清扫术。13.2%的患者在手术前接受新辅助化疗。63.2%的患者接受同步化疗。
|
|
表 1 106例宫颈癌患者的一般资料 Table 1 Characteristics of 106 cervical carcinoma patients |
2.治疗方法:使用瑞典医科达Synergy直线加速器,6 MV X射线IMRT技术进行外照射放疗。患者于定位CT扫描前1 h饮水至膀胱充盈,仰卧位双手抱头,热塑模固定体位,采用增强CT扫描定位,层距5 mm。扫描结束后将影像资料传至Pinnacle放疗计划系统进行靶区勾画。术后辅助性放疗靶区:CTV包含髂总、髂内、髂外、骶前、闭孔淋巴引流区、宫旁,并根据阴道受侵情况包括部分或全部阴道。照射剂量为45.0~50.4 Gy。放疗靶区内局部加量包含两种情况:第1种情况是淋巴结清扫为阴性,宫颈原发病灶较晚的患者,给予盆腔淋巴引流区45.0 Gy,局部(宫旁及阴道)同步或序贯加量至50.0 Gy;第2种情况是患者术后存在盆腔或后腹膜转移淋巴结,予转移淋巴结同步加量放疗,局部加量至54.0~66.0 Gy。同步化疗选择以铂类为基础的方案。对于小肠和结肠(包括盲肠)危及器官的勾画采用仅勾画肠管的方法。
3.随访:随访包括临床表现、症状体征、影像学检查,对临床怀疑复发的患者考虑进行可疑局部病变的活体组织检查。总生存期(OS)定义为从患者宫颈癌确诊日期至死亡或随访终止的时间。无疾病进展生存期(PFS)定义为从患者宫颈癌确诊日期至随访终止或者出现疾病复发或转移的时间。局部复发定义为骨盆内疾病复发,远处复发定义为骨盆外疾病复发。根据美国肿瘤放射治疗协作组织(RTOG)早期放射损伤分级标准进行分级,放疗期间及结束后3个月内出现的不良反应为早期反应(又称急性放射反应)。3级及以上的不良反应定义为严重不良反应。最后随访日期为2019年1月31日。
4.统计学处理:采用SPSS 20.0软件进行数据分析。生存分析采用Kaplan-Meier分析,单因素预后分析采用Log-rank检验,多因素分析采用Cox比例风险模型。计数资料采用χ2检验。P < 0.05为差异有统计学意义。
结果1.临床疗效:共有106例接受术后调强放射治疗的患者,中位随访时间为28个月。3年OS为88.1%,3年PFS为84.8%(图 1)。

|
图 1 106例接受术后辅助性放疗患者的生存曲线(A)和无疾病进展生存曲线(B) Figure 1 Overall survival curve (A) and progression-free survival curve (B) of 106 patients treated with postoperative IMRT |
2.预后影响因素:单因素分析表明,病理类型、盆腔淋巴结状况、腹主动脉旁淋巴结状况、靶区内是否有局部加量是影响预后的因素(表 2)。将以上影响预后的单因素纳入多因素分析,结果显示,病理类型和盆腔淋巴结状况是影响患者生存的独立预后影响因素(表 3)。
|
|
表 2 106例宫颈癌术后辅助放疗患者的单因素分析结果 Table 2 Univariate analysis results of 106 cervical carcinoma patients treated with postoperative IMRT |
|
|
表 3 106例宫颈癌术后辅助放疗患者的多因素分析结果 Table 3 Multi-factor analysis results of 106 cervical carcinoma patients treated with postoperative IMRT |
3.不良反应:所有患者未发生治疗相关性死亡,放疗期间不良反应主要为消化道和血液学不良反应。3级和4级急性血液学不良反应的发生率分别为27.4%(29例)和5.7%(6例)。急性肠道不良反应以1级和2级为主,发生率为11.3%(12例)和21.7%(23例)。3级和4级急性肠道不良反应各有1例,发生率均为0.9%。急性泌尿系统的不良反应以1级为主,发生率为16%(17例)。2级和3级不良反应分别有1例,发生率均为0.9%。
4.严重急性血液学不良反应的影响因素:单因素分析结果显示,与严重急性血液学不良反应相关的因素为放疗前血红蛋白的水平、腹主动脉旁淋巴引流区是否接受放疗、靶区内是否局部加量、是否接受化疗治疗(表 4)。多因素分析结果显示,是否接受同步化疗是影响严重急性血液学不良反应的独立预后因素(表 5)。
|
|
表 4 严重急性血液学不良反应(3级及以上)的单因素分析结果 Table 4 Univariate analysis results of severe acute hematologic toxicity(grade 3 and above) |
|
|
表 5 严重急性血液学不良反应的多因素分析结果 Table 5 Multi-factor analysis results of severe acute hematologic toxicity |
5.肠道的剂量-体积与早期肠道不良反应的关系:对102例数据完整的患者进行肠道剂量-体积与早期肠道不良反应关系的分析。不同患者的肠道在照射区内的体积差异较大。小肠、小肠+结肠平均体积分别为(441.4±20.7)、(777.5±20.7)cm3(表 6)。在对肠道剂量-体积与急性肠道不良反应的分析过程中并未发现差异有统计学意义的预测指标,但是小肠+结肠的受照剂量体积参数V15 < 70%,V30 < 30%,V45 < 10%的患者,2级及以上急性肠道不良反应发生率更低(表 7)。
|
|
表 6 小肠和小肠+结肠的受照体积(x±s) Table 6 Volume of the irradiated small intestine and small intestine + colon(x±s) |
|
|
表 7 肠道剂量-体积与急性肠道不良反应的关系(%) Table 7 The dose-volume relationship between bowel irradiation and acute bowel toxicity |
讨论
本研究患者中67例为FIGO Ⅰ期,39例为FIGO Ⅱ期。3年OS为88.1%,3年PFS为84.8%。既往研究早期(FIGO ⅠB~ⅡB期)并具有高危因素的宫颈癌患者接受根治性手术及辅助性放(化)疗后5年OS为78.9%~95.1%[5],本研究结果与其相似。
在多因素分析中发现,病理类型和盆腔淋巴结状况是影响宫颈癌术后调强放射治疗患者生存的独立预后因素。Fabio等[6]发现在接受根治性手术或放疗的FIGO ⅠB~ⅡA期宫颈癌患者中鳞癌患者的OS高于腺癌患者(P=0.020)。本研究显示,肿瘤组织学病理类型为鳞癌的患者PFS和OS显著优于非鳞癌患者,3例小细胞癌或低分化癌患者均发生复发和死亡。有证据表明,无论FIGO分期如何,淋巴结转移都会降低患者的疗效,OS下降35%~40%[7]。2009版FIGO分期没有考虑淋巴结状态,目前淋巴结状态已被证明是一个重要的预后因素,所以在2018新版FIGO分期中淋巴结状态是影响分期的重要依据。对于有淋巴结转移证据的患者,建议首选根治性放化疗治疗[8]。
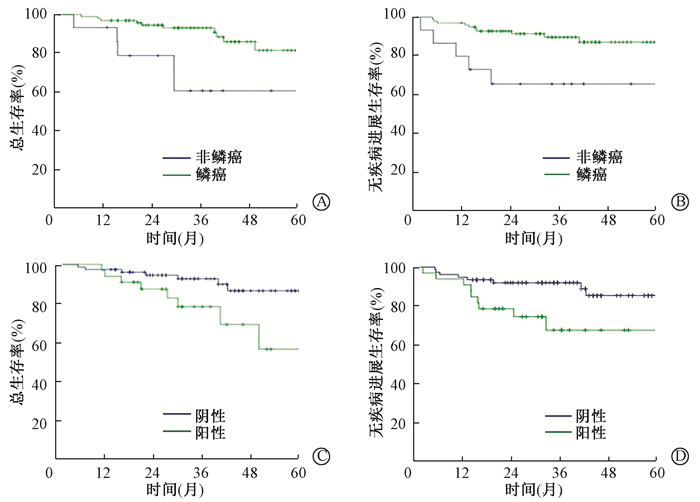
|
图 2 宫颈癌术后辅助性放疗患者生存曲线 A.是否为鳞癌的总生存曲线;B.是否为鳞癌的无疾病进展生存曲线;C.盆腔淋巴结是否阳性的总生存曲线;D.盆腔淋巴结是否阳性的无疾病进展生存曲线 Figure 2 Survival curve of the cervical carcinoma patients treated with postoperative IMRT A. OS curve comparison of pathological type; B.PFS curve comparison of pathological type; C.OS curve comparison of pelvic lymph node status; D.PFS curve comparison of pelvic lymph node status |
Folkert等[9]分析了34例接受术后辅助性放疗同步顺铂化疗的宫颈癌患者,急性严重(3~4级)血液学不良反应发生率为32.3%。本研究统计的术后辅助性放疗组患者的严重血液学不良反应(3级及以上)发生率为33%,同上述研究结果相仿。Folkert等[9]报道,术后辅助性放化疗的宫颈癌患者急性胃肠道不良反应发生率2级为23.5%,3级为2.9%。急性泌尿生殖系统不良反应发生率1级20.6%,2级14.7%。本研究结果与上述接近,3级及以上肠道和泌尿生殖系统不良反应发生率较低。
Kavanagh等[10]在QUANTEC系列研究中推荐当仅勾画小肠肠管时V15 < 120 ml。但对于宫颈癌术后放疗的患者,盆腔内肠道体积较大。本研究结果发现,小肠V15平均体积355 ml,V15 < 120 ml的剂量限制对于接受宫颈癌术后放疗的患者很难实现。本研究发现,对于小肠+结肠受照剂量体积参数V15 < 70%、V30 < 30%、V45 < 10%的患者,2级及以上的急性肠道不良反应的发生率更低,但差异无统计学意义。对于宫颈癌术后辅助放疗的患者,如何预测和降低肠道不良反应的发生率仍有待进一步研究。
总之,宫颈癌接受术后调强放射治疗的患者可取得良好的疗效和长期生存,且不良反应可耐受。病理类型和盆腔淋巴结状况是影响患者生存的独立预后因素。3级及以上的不良反应主要为急性血液学不良反应,早期严重的肠道不良反应发生率较低。
利益冲突 无
作者贡献声明 郭旗负责数据分析,论文撰写;许碧纯、刘叶红、钱建军负责病例收集、随访;田野负责研究方案的设计、论文撰写指导
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Mell L, Sirak I, Wei L, et al. Bone marrow-sparing intensity modulated radiation therapy with concurrent cisplatin for stage ⅠB-ⅣA cervical cancer:an international multicenter phase Ⅱ clinical trial (INTERTECC-2)[J]. Int J Radiat Oncol Biol Phys, 2017, 97(3): 536-545. DOI:10.1016/j.ijrobp.2016.11.027 |
| [3] |
Kibsgaard JNB, Richard P, Kathrin K, et al. Bowel morbidity following radiochemotherapy and image-guided adaptive brachytherapy for cervical cancer:physician- and patient reported outcome from the EMBRACE study[J]. Radiother Oncol, 2018, 127: 431-439. DOI:10.1016/j.radonc.2018.05.016 |
| [4] |
Uk LS, Ae KY, Youngho Y, et al. General health status of long-term cervical cancer survivors after radiotherapy[J]. Strahlenther Onkol, 2017, 193: 543-551. DOI:10.1007/s00066-017-1143-8 |
| [5] |
Okazawa-Sakai M, Yokoyama T, Fujimoto E, et al. Long-term outcomes of postoperative taxane/platinum chemotherapy for early stage cervical cancer:a retrospective study[J]. Int J Clin Oncol, 2018, 23: 715-725. DOI:10.1007/s10147-018-1249-8 |
| [6] |
Fabio L, Alessandro C, Rodolfo M, et al. Randomized study between radical surgery and radiotherapy for the treatment of stage ⅠB-ⅣA cervical cancer:20-year update[J]. J Gynecol Oncol, 2017, 28(3): e34. DOI:10.3802/jgo.2017.28.e34 |
| [7] |
Lim A, Sia S. Outcomes of chemoradiotherapy in cervical cancer-the Western Australian experience[J]. Int J Radiat Oncol Biol Phys, 2012, 82(4): 1431-1438. DOI:10.1016/j.ijrobp.2011.04.047 |
| [8] |
Bhatla N, Denny L. FIGO Cancer Report 2018[J]. Int J Gynecol Obstet, 2018, 143: 2-3. DOI:10.1002/ijgo.12608 |
| [9] |
Folkert MR, Shih KK, Aburustum NR, et al. Postoperative pelvic intensity-modulated radiotherapy and concurrent chemotherapy in intermediate- and high-risk cervical cancer[J]. Gynecol Oncol, 2013, 128(2): 288-293. DOI:10.1016/j.ygyno.2012.11.012 |
| [10] |
Kavanagh BD, Pan CC, Dawson LA, et al. Radiation dose-volume effects in the stomach and small bowel[J]. Int J Radiat Oncol Biol Phys, 2010, 76: 101-107. DOI:10.1016/j.ijrobp.2009.05.071 |
 2020, Vol. 40
2020, Vol. 40


