非小细胞肺癌(NSCLC)占肺癌总数的80% ~ 85%, 其中30% ~ 50%合并脑转移。由于血脑屏障(BBB)的存在, 脑转移患者化疗疗效差, 中位生存时间仅4 ~ 6个月[1-2]。随着靶向药物酪氨酸激酶抑制剂(TKIs)的出现, 不仅改善了合并脑转移的表皮生长因子受体(EGFR)突变NSCLC患者颅内无进展生存(iPFS)时间, 而且提高了患者总生存(OS)时间[3-4]。对于EGFR突变的NSCLC患者脑转移的治疗, 包括手术、放射治疗及TKI药物治疗。其中放射治疗主要包括全脑放射治疗(WBRT)和立体定向放射外科(SRS)。放疗方式的选择主要考虑脑转移的特征, 如数量、大小、病灶部位及症状[5]。有数据表明, EGFR突变的NSCLC患者更易发生脑转移[6-7], 因此, 对于这部分患者脑转移的治疗策略的探讨具有重要意义, 目前对于合并脑转移的EGFR突变NSCLC的治疗仍有许多争议[8]。因此, 本研究对既往未接受TKI治疗的EGFR突变的非小细胞肺癌脑转移患者进行回顾性分析, 探讨脑部放疗是否改善患者预后, 以及放疗的最佳介入时机和方式。
资料与方法1.研究对象:收集2014年1月至2018年9月武汉大学中南医院治疗的非小细胞肺癌患者资料。入组标准: ①组织、细胞或者血液标本通过实时聚合酶链反应(PCR)、高通量测序(NGS)、荧光原位杂交(FISH)或者免疫组织化学法(ICH)明确诊断为具有EGFR敏感的基因突变, EGFR突变主要包括: 18号外显子点突变、19号外显子缺失突变、20号外显子插入突变和21号外显子点突变。②影像学检查明确诊断为脑转移。③确诊脑转移前未使用过TKI药物治疗。④美国东部肿瘤协作组(ECOG)评分系统体力状态(PS)评分0 ~ 2分。⑤确诊脑转移后生存时间>3个月。收集患者相关资料, 包括年龄、性别、吸烟史、ECOG评分、EGFR突变的类型、脑转移的数量、是否存在颅外转移灶、脑放疗的类型、脑转移是否存在症状等。其中, 患者伴有中枢神经系统症状的常见表现有头痛、头晕、恶心、呕吐、言语不清或肢体活动障碍等。入组的患者根据脑放疗介入时间和方式分为两组:早放疗组即确诊脑转移后先行脑部放疗并接受TKI药物治疗, 其中包括早WBRT组及早SRS组; 晚放疗组即确诊脑转移后先使用TKI药物至颅内病灶进展再行脑放疗, 其中包括截止随访终点颅内病灶稳定仍未接受脑放疗的患者。
2.治疗方式:所有EGFR突变NSCLC患者确诊脑转移后全身治疗均为TKI药物, 患者使用的TKI药物包括吉非替尼(250 mg / d)、厄洛替尼(150 mg / d)、埃克替尼(125 mg, 每日3次)及奥希替尼(80 mg / d)。脑放疗的类型包括WBRT和SRS, 全脑放疗剂量为28 ~ 30 Gy, 分8 ~ 10次, 每周5次, SRS剂量为单次剂量16 ~ 20 Gy, 体积较大脑转移瘤可采用分次剂量, 27 ~ 30 Gy, 分3 ~ 5次。
3.随访:采用影像学评估病情, 包括胸部和上腹部计算机断层扫描(CT)、脑部磁共振成像(MRI)、骨骼的发射计算机断层扫描(ECT)或正电子发射计算机断层显像(PET-CT)。其中胸部及腹部CT每2 ~ 3个月重复检查1次, 脑部MRI每1 ~ 2个月检测1次, 骨ECT每6个月检测1次。某次影像学检查时出现进展, 那么其进展日期就记录为检查的这一天。主要观察指标为无进展生存期(progression-free survival, PFS), 定义为接受TKI药物治疗时间开始至疾病进展或因任何原因死亡的时间; 颅内无进展生存期(intracranial progression free survival, iPFS), 定义为从脑转移诊断时间到颅内病变进展或因任何原因死亡的时间, 总生存(overall survival, OS), 定义为诊断脑转移至患者死亡或末次随访的时间。
4.统计学处理:使用SPSS 22. 0软件进行数据分析, 计数资料组间差异比较采用x2检验或Fisher精确检验, 生存率分析采用Kaplan-Meier法, 生存率的组间比较采用Log-rank检验, COX模型进行单因素分析, P < 0. 05为差异具有统计学意义。
结果1.临床资料:根据入组标准最后纳入分析患者69例, 其中早放疗组45例, 晚放疗组24例, 占总体比例分别是65%和35%。早放疗组中20例接受WBRT, 25例接受SRS; 晚放疗组中5例接受WBRT, 4例接受SRS, 晚放疗组截止至随访终点15例患者颅内病灶稳定仍未接受脑放疗。所有患者中位随访时间是23. 3个月(95% CI: 16. 9 ~ 29. 6个月), 诊断脑转移的年龄是36 ~ 73岁, 中位年龄是54岁。早放疗组与晚放疗组存在症状性脑转移的比例分别是60%和33% (x2 = 4. 453, P < 0. 05), 早放疗组中更多的患者存在脑转移灶引起的相关临床症状。两组患者在年龄、性别、ECOG评分、是否吸烟、EGFR突变类型、是否使用奥希替尼及是否存在颅外转移比较差异均无统计学意义(P > 0. 05, 表 1)。
|
|
表 1 69例非小细胞肺癌脑转移患者患者临床基本资料 Table 1 Clinical characteristics of patients with brain metastases resulted from non-small cell lung cancer |
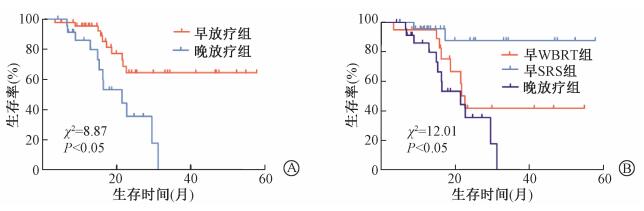
2.生存分析:入组69例患者的中位OS为31. 2个月, 1、2、3年的生存率分别为92%、55%和46%。早放疗组与晚放疗组1年和2年OS分别为95%、64%和80%、35%, 两组差异有统计学意义(x2 = 8. 87, P < 0. 05)。进一步分析显示, 早WBRT组、早SRS组及晚放疗组1年和2年OS分别为95%、96%、80%和42%、88%、35% (x2 = 12. 01, P < 0. 05)。早SRS组较晚放疗组有OS获益(HR: 0. 10, 95%CI: 0. 23~0. 46, P= 0. 003), 而早WBRT组较晚放疗组OS无显著获益(HR: 0. 54, 95%CI: 0. 21~1. 32, P= 0. 180), 生存曲线见图 1。
|
图 1 患者生存曲线A.早放疗组与晚放疗组; B.早WBRT、早SRS及晚放疗组 Figure 1 Overall Survival of patients A. Patients treated with upfront radiotherapy group and deferred radiotherapy group; B. Upfront WBRT group, upfront SRS group and deferred radiotherapy group |
3.颅内及全身疾病控制情况:入组患者中位iPFS为24. 7个月(95% CI: 14. 2 ~ 35. 2个月), 中位PFS为11. 9个月(95%CI: 8. 4~15. 3个月)。早放疗组与晚放疗组的1年iPFS与PFS分别为77%、52%和55%、28%, 两组差异均无统计学意义(P > 0. 05)。
4.治疗失败模式及后续治疗:早放疗组中TKI药物治疗后出现进展30例(颅内进展10例, 颅外进展15例, 同时进展5例), 晚放疗组15例(颅内进展7例, 颅外进展6例, 同时进展2例)。早放疗组和晚放疗组疾病进展后的治疗包括:铂类双药或者单药化疗8例(26%)和4例(26%), 局部放疗13例(43%)和9例(60%), 更换第3代TKI药物奥克替尼9例(30%)和2例(13%)。晚放疗组颅内病灶进展后均接受了脑部放疗, 两组患者后续治疗差异无统计学意义(P >0. 05)。
讨论近年来, 随着分子靶向药物的出现, EGFR突变的NSCLC脑转移患者生存得到很大的改善。目前临床数据已经证实对于EGFR突变的NSCLC脑转移患者, TKI药物治疗的有效性, 中位生存时间可达15 ~ 20个月, 颅内病灶无进展生存期可达6. 6~11. 7个月[9]。吴一龙教授的埃克替尼对比全脑放疗Ⅲ期临床研究结果显示, 对于合并无症状脑转移的EGFR突变NSCLC患者的一线治疗, 相比放疗联合化疗, 单纯使用TKI能带来更长的PFS和颅内PFS[10], 但该研究并没有将TKI药物联合脑放疗进行比较。由于TKI较化疗等药物具有更高的血脑屏障透过率, 同时考虑到脑放疗对认知功能与生活质量的影响, 有观点认为应该尽量推迟或者避免对EGFR突变的NSCLC脑转移患者进行脑放疗。本研究探讨了对于EGFR突变的NSCLC脑转移患者, 脑部放疗介入的时机及方式是否影响了患者的预后, 结果表明早期的脑部放疗较先使用TKI药物推迟脑部放疗有生存时间获益, 其中使用SRS较使用WBRT获益更加明显。
在一项入组1 086例患者的Meta分析中, 结果显示早期的脑放疗联合TKI药物较单纯TKI相比可以获得更好的OS和颅内PFS, 特别是对于脑转移个数较少的患者, 这种生存获益更加明显[11]。在另一项荟萃分析中同样证实早期脑放疗联合TKI对比单纯TKI可以改善患者颅内PFS和OS[12], 而且在Gerber等[13]研究中发现相对于单纯使用厄洛替尼靶向药物, 早期的脑部放疗无论是WBRT或SRS, 都可以带来颅内PFS的获益, 脑部放疗的介入联合TKI药物治疗的有效性和安全性得到临床研究的证实[14-15]。因此, 脑部放疗对于EGFR突变的NSCLC脑转移仍存在意义。本研究中, 早放疗组与晚放疗组1年和2年OS分别为95%、64%和80%、35%, 早放疗组较晚放疗组有OS获益(P < 0. 05)。本研究支持早期脑部放疗对于EGFR突变NSCLC脑转移患者可以带来生存获益。早放疗组与晚放疗组的1年iPFS分别为77%和52%, 早放疗组在颅内病灶控制方面显示出一定的优势, 但是两组差异无统计学意义, 可能与晚放疗组中仍有15例患者颅内病灶稳定未行脑放疗有关。
WBRT曾经是脑转移的标准治疗手段。随着放射技术的不断改进, WBRT所导致的神经认知功能损害引起人们的关注。近年来SRS的适应证有拓展, JLGK0901研究显示对于5 ~ 10个脑转移灶SRS对比WBRT同样可显示出优势[16]。目前关于脑放疗的方式仍没有定论。Magnuson等[8]报道, 351例EGFR突变NSCLC脑转移患者分为3组, 分别是早SRS组、早WBRT组及早TKI组, 中位生存时间对应是47、30及25个月(P= 0. 001)。早期脑放疗可以显著延长OS, 且早期使用SRS组生存时间最长, 可达到47个月。Miyawaki等[17]与Jiang等[18]的研究表明, 早期WBRT对于多发脑转移患者并未带来生存获益。Li和Brown[19]基于多个Ⅲ期临床研究证明, 对于有限的脑转移灶的患者, SRS较全脑放疗更有优势。另外, 全脑放疗可能导致海马神经干细胞损伤, 从而影响患者的认知功能, 相比较下, 脑SRS似乎是更好的选择[20-21]。本研究中也对脑放疗方式进行了分析, 早SRS组较晚放疗组OS存在明显获益, 而早WBRT组较晚放疗组则无明显生存获益。因此, 对于脑部放疗更推荐使用SRS。但对于多发(>4个)脑转移的治疗, 不能完全否定WBRT的地位, 特别是现在的海马保护的全脑放疗的开展, 在降低对认知功能影响的前提下, 达到的治疗效果与传统WBRT相同。本研究中, 早SRS组脑转移个数在1 ~ 4个占68%, 而早WBRT组仅占15%。早SRS组颅内肿瘤负荷较低, 高剂量的脑部放疗与TKI药物联合可以更好的控制疾病, 从而延长生存时间。而对于接受WBRT的患者, 多发脑转移或症状性脑转移的可能性更高, 因此, 早WBRT组OS较早SRS组的患者更短。WBRT在多发脑转移患者中的应用价值, 急需前瞻性临床研究结果证实。
本研究仍存在局限性: ①本研究是单中心小样本回顾性研究, 样本量较小, 结论可能无法代表大样本数据结论。②早放疗组和晚放疗组在颅内PFS及PFS方面差异无统计学意义, 造成此结果的原因可能是晚放疗组脑转移灶较小, 且无明显临床症状, 肿瘤负荷较小。③对于接受全脑放疗的患者, 目前无法进行神经认知功能的评价, 无法确定全脑放疗的远期影响。综上, 本研究认为对于合并脑转移的EGFR突变NSCLC患者, 早期脑放疗介入可以有生存获益, 对于脑放疗方式, SRS较WBRT获益可能更加明显。
利益冲突 无
作者贡献声明 周燕和欧阳雯负责收集资料、整理数据、统计分析、撰写论文及修改论文; 余静、龚俊、胡静、徐禹、陈刚、龚䶮及张俊红负责提供数据和修改论文; 谢丛华负责研究设计和修改论文
| [1] |
Tan CS, Cho BC, Soo RA. Treatment options for EGFR mutant NSCLC with CNS involvement-Can patients BLOOM with the use of next generation EGFR TKIs?[J]. Lung Cancer, 2017, 108: 29-37. DOI:10.1016/j.lungcan.2017.02.012 |
| [2] |
Yap TA, Macklin-Doherty A, Popat S. Continuing EGFR inhibition beyond progression in advanced non-small cell lung cancer[J]. Eur J Cancer, 2017, 70: 12-21. DOI:10.1016/j.ejca.2016.10.014 |
| [3] |
Venur VA, Ahluwalia MS. Targeted therapy in brain metastases: ready for primetime?[J]. Am Soc Clin Oncol Educ Book, 2016, 35: e123-130. DOI:10.1200/edbk_100006 |
| [4] |
Baik CS, Chamberlain MC, Chow LQ. Targeted therapy for brain metastases in EGFR-mutated and ALK-rearranged non-small-cell lung cancer[J]. J Thorac Oncol, 2015, 10(9): 1268-1278. DOI:10.1097/JTO.0000000000000615 |
| [5] |
Soon YY, Leong CN, Koh WY, et al. EGFR tyrosine kinase inhibitors versus cranial radiation therapy for EGFR mutant nonsmall cell lung cancer with brain metastases: a systematic review and meta-analysis[J]. Radiother Oncol, 2015, 114(2): 167-172. DOI:10.1016/j.radonc.2014.12.011 |
| [6] |
Chang WY, Wu YL, Su PL, et al. The impact of EGFR mutations on the incidence and survival of stages I to Ⅲ NSCLC patients with subsequent brain metastasis[J]. PLoS One, 2018, 13(2): e0192161. DOI:10.1371/journal.pone.0192161 |
| [7] |
Ge M, Zhuang Y, Zhou X, et al. High probability and frequency of EGFR mutations in non-small cell lung cancer with brain metastases[J]. J Neurooncol, 2017, 135(2): 413-418. DOI:10.1007/s11060-017-2590-x |
| [8] |
Magnuson WJ, Lester-Coll NH, Wu AJ, et al. Management of brain metastases in tyrosine kinase inhibitor-na?ve epidermal growth factor receptor-mutant non-small-cell lung cancer: a retrospective multi-institutional analysis[J]. J Clin Oncol, 2017, 35(10): 1070-1077. DOI:10.1200/JCO.2016.69.7144 |
| [9] |
Zimmermann S, Dziadziuszko R, Peters S. Indications and limitations of chemotherapy and targeted agents in non-small cell lung cancer brain metastases[J]. Cancer Treat Rev, 2014, 40(6): 716-722. DOI:10.1016/j.ctrv.2014.03.005 |
| [10] |
Yang JJ, Zhou C, Huang Y, et al. Icotinib versus whole-brain irradiation in patients with EGFR-mutant non-small-cell lung cancer and multiple brain metastases (BRAIN): a multicentre, phase 3, open-label, parallel, randomised controlled trial[J]. Lancet Respir Med, 2017, 5(9): 707-716. DOI:10.1016/s2213-2600(17)30262-x |
| [11] |
Wang C, Lu X, Lyu Z, et al. Comparison of up-front radiotherapy and TKI with TKI alone for NSCLC with brain metastases and EGFR mutation: a meta-analysis[J]. Lung Cancer, 2018, 122: 94-99. DOI:10.1016/j.lungcan.2018.05.014 |
| [12] |
Soon YY, Leong CN, Koh WY, et al. EGFR tyrosine kinase inhibitors versus cranial radiation therapy for EGFR mutant nonsmall cell lung cancer with brain metastases: a systematic review and meta-analysis[J]. Radiother Oncol, 2015, 114(2): 167-172. DOI:10.1016/j.radonc.2014.12.011 |
| [13] |
Gerber NK, Yamada Y, Rimner A, et al. Erlotinib versus radiation therapy for brain metastases in patients with EGFRmutant lung adenocarcinoma[J]. Int J Radiat Oncol Biol Phys, 2014, 89(2): 322-329. DOI:10.1016/j.ijrobp.2014.02.022 |
| [14] |
Jiang T, Min W, Li Y, et al. Radiotherapy plus EGFR TKIs in non-small cell lung cancer patients with brain metastases: an update meta-analysis[J]. Cancer Med, 2016, 5(6): 1055-1065. DOI:10.1002/cam4.673 |
| [15] |
Wang X, Xu Y, Tang W, et al. Efficacy and safety of radiotherapy plus EGFR-TKIs in NSCLC patients with brain metastases: a meta-analysis of published data[J]. Transl Oncol, 2018, 11(5): 1119-1127. DOI:10.1016/j.tranon.2018.07.003 |
| [16] |
Yamamoto M, Serizawa T, Shuto T, et al. Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study[J]. Lancet Oncol, 2014, 15(4): 387-395. DOI:10.1016/S1470-2045(14)70061-0 |
| [17] |
Miyawaki E, Kenmotsu H, Mori K, et al. Optimal sequence of local and EGFR-TKI therapy for EGFR-mutant non-small cell lung cancer with brain metastases stratified by number of brain metastases[J]. Int J Radiat Oncol Biol Phys, 2019, 104(3): 604-613. DOI:10.1016/j.ijrobp.2019.02.051 |
| [18] |
Jiang T, Su C, Li X, et al. EGFR TKIs plus WBRT demonstrated no survival benefit other than that of tkis alone in patients with NSCLC and EGFR mutation and brain metastases[J]. J Thorac Oncol, 2016, 11(10): 1718-1728. DOI:10.1016/j.jtho.2016.05.013 |
| [19] |
Li J, Brown PD. The diminishing role of whole-brain radiation therapy in the treatment of brain metastases[J]. JAMA Oncol, 2017, 3(8): 1023-1024. DOI:10.1001/jamaoncol.2016.5411 |
| [20] |
Gondi V, Pugh SL, Tome WA, et al. Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933): a phase Ⅱ multi-institutional trial[J]. J Clin Oncol, 2014, 32(34): 3810-3816. DOI:10.1200/jco.2014.57.2909 |
| [21] |
Yamamoto M, Serizawa T, Higuchi Y, et al. A multiinstitutional prospective observational study of stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901 Study Update): irradiation-related complications and long-term maintenance of mini-mental state examination scores[J]. Int J Radiat Oncol Biol Phys, 2017, 99(1): 31-40. DOI:10.1016/j.ijrobp.2017.04.037 |
 2020, Vol. 40
2020, Vol. 40


