我国肺癌、食管癌发病率居全球第一, 每年发病约103万[1]。同期放化疗是局部晚期非小细胞肺癌和食管癌的主要治疗模式, 局部区域未控和复发仍是主要的失败模式之一[2-4]。在没有很好的控制不良反应的前提下, 通过增加放疗剂量来提高局部控制率和改善生存是不可行的[4-5]。
重组人血管内皮抑制素(recombinant human endostatin, rh-ES)联合放化疗能够提高局部晚期非小细胞肺癌和食管癌的疗效[6-7]。但在临床研究中很少关注rh-ES联合同期放化疗的远期心脏不良反应。rh-ES可对心肌组织产生抗血管生成作用, 并对心肌细胞有直接不良反应[7]。即使在精准放疗时代, 胸部肿瘤放射治疗过程中, 心脏仍不可避免地受到一定剂量照射而出现放射性心肌损伤(radiation-induced heart disease, RIHD)。由于放疗与rh-ES导致的心脏不良反应机制相似, 放疗与rh-ES联用很可能会造成心脏的不良反应叠加。通过临床病理标本评价放射性心肌纤维化困难, 本研究旨在通过大鼠模型探讨rh-ES对放射性心肌纤维化的影响及其潜在机制。
材料与方法1.主要仪器及试剂:瑞典医科达Precise电子直线加速器; 转化生长因子-β1 (TGF-β1)、结缔组织生长因子(CTGF)、β-肌动蛋白、鼠单克隆抗体购自英国Abcam公司, rh-ES (恩度)由江苏先声药业惠赠。
2.动物分组及处理:采用40只健康状况良好的SD大鼠, 月龄3 ~ 4个月, 体重(270 ± 30) g, 各种反射正常, 养殖于贵州医科大学SPF级动物基地[合格证号: SCXK (黔) 2012-0001]。颗粒饲料喂养, 自由进食及饮水, 清洁舒适环境, 温度23 ~ 25℃, 湿度45% ~ 55%。将40只SD大鼠按随机数表法分为4组(A、B、C、D组), 每组10只。A组为健康对照组, 不给予照射及恩度干预; B组为恩度干预组; C组为单纯照射组; D组为照射+恩度干预组。
3.心脏照射方法及rh-ES给药方法:采用乙醚麻醉大鼠后, 固定于直线加速器下, 通过大鼠体表心脏搏动范围, 使心脏置于射野中心。在目前放射治疗中, 按照常规分割放疗, 控制心脏损伤标准的耐受量剂量是40 Gy(V40≤80%) [8], 按EQD2 = D×(d+α/β)/(2+α/β)计算, 将临床常规40 Gy / 20次换算为本实验25 Gy / 5次照射剂量, 单野照射, 射野大小3 cm× 3 cm, 胸前垫1 cm厚蜡模, 源皮距100 cm, 5.0 Gy /次, 剂量率600cGy / min, 1次/ d, 连续照射5 d, 射线能量为6 MV X射线。rh-ES 6 mg/kg[7], 用生理盐水稀释至浓度0. 75 mg / ml, 于照射开始第1 ~ 14天行腹腔注射, 1次/ d。
4. Masson染色:照射后1、3个月时各组麻醉处死5只大鼠, 取左心室组织用10%甲醛溶液固定, 常规石蜡包埋, 按5 μm厚度切片, 用于Masson染色。Masson染色试剂盒购自北京索莱宝科技有限公司, 切片常规脱蜡至水, 经Masson染色后大鼠心肌细胞为红色, 胶原纤维为蓝色。光学显微镜200倍下观察, 采用MIAS图像分析软件进行半定量分析, 计算心肌胶原容积分数(collagen volume fraction, CVF), CVF =视野中胶原面积/视野总面积。每张标本随机选取5个不重复视野。
5.蛋白免疫印迹法(Western blot)检测蛋白表达:使用蛋白裂解液提取心肌组织样品蛋白, 通过二喹啉甲酸(BCA)法测定蛋白样品浓度, 取30 μg蛋白样品于12%分离胶中电泳, 电泳后进行转膜, 将转好的膜置于TBST配置的5%脱脂奶粉中室温封闭1 h后, TBST洗膜3次, 按目的蛋白大小剪取膜, 分别加入一抗(TGF-β1浓度1 : 2 000, CTGF浓度1 : 1 000、β-肌动蛋白浓度1 : 2 000)于4℃摇床过夜, 使用TBST溶液洗膜3次, 加入辣根过氧化物酶标记的相应二抗, 37℃孵育1 h, 然后采用电化学发光(ECL)法进行显影。采用Image J图像处理软件对条带进行分析, 以吸光度/面积进行蛋白定量, β-肌动蛋白作为内参照, 以TGF-β1及CTGF蛋白与β-肌动蛋白的比值作为相对蛋白表达量。
6.统计学处理:采用SPSS 22. 0软件对实验结果进行分析, 计量数据呈正态分布, 以x±s表示, 符合方差齐性采用单因素方差分析(One-way ANOVA), 采用t检验及Bonferroni校正进行组间比较。P < 0. 05为差异有统计学意义。
结果1. Masson染色评估纤维化情况: 1个月时, A、B组胶原纤维呈蓝色, 散在分布于心肌细胞间质; C组心肌间质及血管周围分布蓝染纤维, 较A、B组明显增多; D组心肌间质及血管周围蓝染纤维较C组更明显(图 1)。3个月时, A、B组心肌细胞外、血管周围基质含量较少, 见少量蓝染纤维沉积; C组心肌细胞间质蓝染纤维明显增多, 可见条索状纤维沉积; D组心肌细胞间大量胶原纤维沉积, 延伸至细胞间隙, 血管周围见环状蓝染纤维环胶原纤维(图 2)。
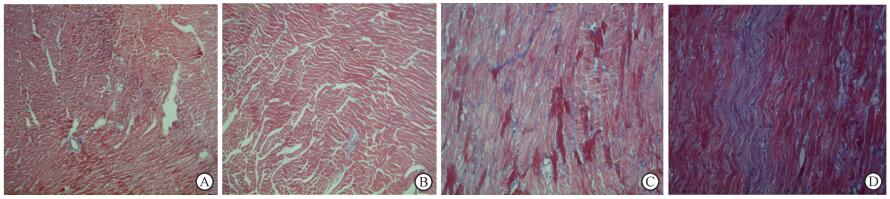
|
图 1 各组照后1个月放射性心肌纤维化的发生情况Masson染色×200 A.健康对照组; B.恩度干预组; C.单纯照射组; D.照射+恩度干预组 Figure 1 The occurrence of radioactive myocardial fibrosis in each goup at 1 month after irradiation Masson staining ×200 A. Healthy control group; B. Endu intervention group; C. Single exposure group; D. Irradiation + endodontic intervention group |
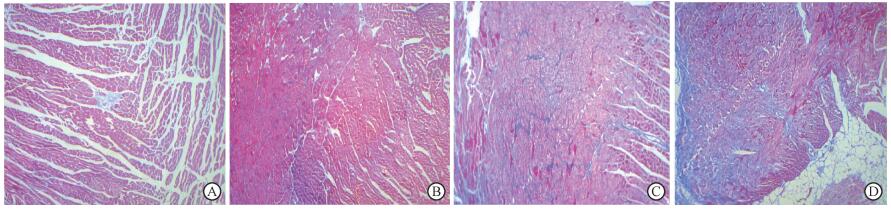
|
图 2 各组照后3个月放射性心肌纤维化的发生情况Masson染色×200 A.健康对照组; B.恩度干预组; C.单纯照射组; D.照射+恩度干预组 Figure 2 The occurrence of radioactive myocardial fibrosis in each group at 3 month after irradiation Masson staining ×200 A. Healthy control group; B. Endu intervention group; C. Single exposure group; D. Irradiation + endodontic intervention group |
2.心肌胶原半定量分析:如表 1所示, 照射后1个月, 半定量分析结果显示C组和D组的CVF明显高于A组(t = 4. 74、4. 93, P < 0. 01), C组和D组的CVF接近(P > 0. 05);照射后3个月, C组和D组的CVF明显升高, 与A组比较(t= 4. 49、6. 61, P < 0. 01), C组的CVF低于D组(t= 3. 19, P < 0. 05)。C组照射后3个月与照射后1个月的CVF比较有增加趋势, 但差异无统计学意义(P > 0. 05), D组照射后3个月的CVF明显高于照射后1个月(t = 3. 87, P < 0. 01)。
|
|
表 1 各组大鼠不同时间心肌胶原容积分数(%, x±s) Table 1 Cardiac collagen volume fraction at different time in each group of rats (%, x±s) |
3. Western blot检测心肌TGF-β1、CTGF及COL-I表达
(1) TGF-β1表达:照射后1个月, 与A组比较, C组的表达量明显升高(t= 5. 81, P < 0. 01), A组与B组、C组与D组表达量差异无统计学意义(P > 0. 05);照射后3个月, C组表达量仍明显比A组升高(t= 4. 19, P < 0. 01), D组的表达量明显高于C组(t= 7. 24, P < 0. 01); A组与B组表达量的差异无统计学意义(P > 0. 05), D组照射后1个月的TGF-β1表达量明显低于照射后3个月(t= 8. 08, P < 0. 01)。
(2) CTGF表达:照射后1个月, 与A组比较, C组表达量明显升高(t= 4. 04, P < 0.01), A组与B组、C组与D组表达量的差异也无统计学意义(P > 0. 05);放疗后3个月, C组表达量也比A组升高(t= 4. 62, P < 0.01), D组的表达量明显高于C组(t= 9. 32, P < 0.01), D组照射后1个月的CTGF表达量明显低于照射后3个月(t= 8. 43, P < 0.01)。
(3) 胶原蛋白I (COL-I)表达:照射后1个月, A、B、C、D各组间COL-I表达的差异无统计学意义(P > 0. 05);放疗后3个月, 与A组比较, C组的表达量升高(t= 3. 54, P < 0. 05), A组与B组、C组与D组表达量的差异也无统计学意义(P > 0. 05)。C组照射后1个月与照射后3个月、D组照射后1个月与照射后3个月COL-I表达量的差异也无统计学意义(P > 0. 05)。各组TGF-β1、CTGF及COL-I表达详见表 2。
|
|
表 2 各组照后1、3个月TGF-β1、CTGF及COL-I的表达(x±s) Table 2 Expressions of TGF-β1, CTGF and COL-I in each group at 1 and 3 months after irradiation (x±s) |
讨论
目前, 抗血管生成治疗在肿瘤领域, 尤其是在肺癌治疗方面取得了较大成功, 显著提高了肿瘤的疗效, 已被推荐为肺癌等恶性肿瘤的主要治疗方法。放射治疗是肺癌、乳腺癌、食管癌等胸部恶性肿瘤的主要治疗手段。在胸部放射治疗中心脏不可避免地受到一定剂量照射而出现损伤。随着生存时间的延长, 放射性心脏损伤成为影响胸部恶性肿瘤患者长期生存率和生活质量的重要原因, 同时RIHD也是限制放射剂量而影响肿瘤治疗效果的重要因素。重组人血管内皮抑制素(恩度)是我国自主研发的抗血管生成药物, 与放射治疗联合能够进一步提高疗效[9]。同时, 重组人血管内皮抑制素是抗血管靶向药物, 对心脏有潜在不良反应。临床工作中担忧两者联用可能会造成不良反应叠加。
本研究通过Masson染色观察到大鼠心脏照射后心肌纤维化的形成, 随着时间推移纤维化加重, 这与文献报道的结果一致[10-11]。研究证实心血管疾病患者血清内皮抑素水平明显升高[12], 如心肌梗死[13]、心肌肥大等[14], 循环内皮抑素水平还与高血压的持续时间有关[15]。由此可见, 恩度可能增加放射性心肌损伤。本研究结果显示, 在照射后1个月, 与健康对照组比较, 恩度干预组心肌CVF无明显变化; 单纯照射组、照射+恩度组的心肌纤维化加重, CVF显著增高, 但单纯照射组与照射+恩度组的心肌纤维化程度和CVF相似。照射后3个月, 健康对照组和单纯恩度干预组仍无明显的心肌纤维改变, 照射组和照射+恩度组的心肌纤维化加重明显; 而且照射+恩度组比单纯照射组的CVF显著增高, 纤维化的程度更为严重。覃晶等[7]报道重组人血管内皮抑制素对大鼠心肌细胞具有不良反应, 可通过诱导心肌细胞凋亡参与了心肌损伤的病理过程。本研究从心肌损伤情况来看, 整体表现为单纯恩度处理, 所造成的大鼠心肌纤维化是轻微的。放射治疗25 Gy/ 5次可以导致比较明显的心肌纤维化, 且随时间推移纤维化加重, 符合放射性心肌纤维化是一个逐渐加重过程的特点, 联合恩度增加了放射性心肌纤维化的程度。本研究中, 单纯恩度处理组的心肌损伤轻微, 可能与使用的恩度剂量较低有关。覃晶等[7]分别给予3、6、12 mg·kg-1·d-1 rh-ES大鼠腹腔注射, 3、6 mg·kg-1·d-1剂量组无明显心肌损伤的病理形态及超微结构改变, 12 mg·kg-1·d-1组光镜下可见心肌损伤的病理形态及超微结构改变。同时提示单纯低剂量的rh-ES对心肌损伤虽然轻微, 但与照射联合时可进一步增加放射性心肌纤维化, 应当引起重视。
放射性心肌纤维化则主要由于成纤维细胞过度活化导致肌成纤维细胞的过度增殖和细胞外基质(ECM)过度沉积所致。Okada等[16]研究发现, 心肌成纤维细胞在心肌损伤后的心脏重塑过程中被激活, 内皮抑素可促进心肌成纤维细胞的增殖, 迁移和胶原合成。TGF-β1作为一种细胞生长和分化的调节因子, 是目前典型的促纤维化细胞生长因子。CTGF是TGF-β1的下游反应元件, CTGF可以介导组织修复和纤维化的过程[17]。体外实验表明, CTGF能刺激心脏成纤维细胞的增殖, 增加细胞外基质的产生[18]。在心肌损伤、修复和纤维化过程中, CTGF是成纤维细胞的活化标志。CTGF作为调节心肌纤维化过程中的重要基质细胞蛋白使其成为心肌纤维化的一个重要生物标志物, 已逐渐成为心肌组织纤维化的新指标[19]。本研究结果显示, 照射后1个月(早期), 单纯照射组与照射+恩度干预组的心肌CVF沉积相似, 而且TGF- β1、CTGF表达也接近。值得注意的是, 放射性纤维化是一个动态的过程, 照射后3个月(晚期), 照射+恩度干预组的TGF-β1、CTGF比单纯照射组显著增高, 同时心肌纤维化的程度也在加重。Lin等[20]研究发现, 在叶酸诱导的肾病急性期, 给予恩度降低肾脏毛细血管密度, 而在慢性期给予恩度对毛细血管密度影响不明显, 表明恩度更大的作用主要局限于血管生成过程, 在成熟的血管系统中作用减弱。Isobe等[21]发现, 心肌梗死的大鼠模型中血管内皮抑素的表达升高, 阻断内皮抑素可加重大鼠模型的心肌梗死症状和预后更差。本研究结果显示, 正常情况下给予恩度, TGF-β1和CTGF水平不升高; 而单纯照射组给予恩度, 可使TGF-β1和CTGF水平升高。其原因可能在于, 放射线损伤血管导致的缺血性心脏病是放射性心脏损伤的主要机制之一, 在放疗早期给予恩度影响心肌修复并促进心肌纤维化过程, 导致TGF-β1和CTGF升高。本研究认为恩度可增加放射性心肌纤维化, 恩度可能通过激活TGF-β1和CTGF通路加重心肌纤维化的发生发展。
综上所述, 射线可引起心肌纤维化的形成, 重组人血管内皮抑制素可能会增加晚期放射纤维化的形成。TGF-β1和CTGF通路激活可能与促进纤维化发展有关。需要开展进一步深入的研究, 探索阻断TGF-β1和CTGF通路是否能减轻放射性心肌纤维化进程。
利益冲突 无
作者贡献声明 旷华香负责实验操作, 撰写论文; 徐世林、赵朝芬负责实验操作和数据分析; 欧阳伟炜、马筑协助修改论文; 李晓阳、陈霞霞、杨文刚协助实验操作; 卢冰、苏胜发指导课题设计和修改论文
| [1] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [2] |
Ahn JS, Ahn YC, Kim JH, et al. Multinational randomized phase Ⅲ trial with or without consolidation chemotherapy using docetaxel and cisplatin after concurrent chemoradiation in inoperable stage Ⅲ non-small-cell lung cancer: KCSG-LU05-04[J]. J Clin Oncol, 2015, 33(24): 2660-2666. DOI:10.1200/JCO.2014.60.0130 |
| [3] |
Wanet M, Delor A, Hanin FX, et al. An individualized radiation dose escalation trial in non-small cell lung cancer based on FDGPET imaging[J]. Strahlenther Onkol, 2017, 193(10): 812-822. DOI:10.1007/s00066-017-1168-z |
| [4] |
任雪姣, 王澜, 韩春, 等. 食管癌同期放化疗不同放疗剂量远期疗效分析[J]. 中华放射肿瘤学杂志, 2017, 26(9): 1006-1011. Ren XJ, Wang L, Han C, et al. Long-term efficacy of concurrent chemoradiotherapy at different radiotherapy doses in treatment of esophageal carcinoma[J]. Chin J Radiat Oncol, 2017, 26(9): 1006-1011. DOI:10.3760/cma.j.issn.1004-4221.2017.09.006 |
| [5] |
Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiothrapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage ⅢA or ⅢB non-small-cell lung cancer (RTOG 0617) : a randomised, two-by-two factorial phase 3 study[J]. Lancet Oncol, 2015, 16(2): 187-199. DOI:10.1016/S1470-2045(14)71207-0 |
| [6] |
Bao Y, Peng F, Zhou QC, et al. Phase Ⅱ trial of recombinant human endostatin in combination with concurrent chemoradiotherapy in patients with stage Ⅲ non-small-cell lung cancer[J]. Radiother Oncol, 2015, 114(2): 161-166. DOI:10.1016/j.radonc.2014.11.039 |
| [7] |
覃晶, 钱新宇, 陆慧琦, 等. 重组人血管内皮抑素诱导大鼠心肌细胞凋亡的体内实验研究[J]. 解放军医学杂志, 2014, 39(1): 5-10. Qin J, Qian XY, Lu HQ, et al. Experimental research on recombinant human endostatin-induced cardiomyocyte apoptosis in rats[J]. Med J Chin PLA, 2014, 39(1): 5-10. DOI:10.11855/j.isssn.0577-7402.2014.01.02 |
| [8] |
National Comprehensive Cancer Network. NCCN clinical practice
guidelines in oncology. Version 3 [ EB / OL ]. (2018-02-21)
[2019-09-10]. [DOI:10.1109/IGARSS.2002.1025902] https: //www.nccn.org/professionals/physician_gls/default.aspx
|
| [9] |
翟志刚. 重组人血管内皮抑制素联合调强放疗治疗老年中晚期食管癌的近期效果观[J]. 中国民康医学, 2018, 30(23): 37-38. Zhai ZG. Recombinant human endostatin combined with intensity-modulated radiotherapy for elderly patients observation of the short-term effect of middle and advanced esophageal cancer[J]. Med J Chin People Health, 2018, 30(23): 37-38. DOI:10.3969/j.issn.1672-0369.2018.23.018 |
| [10] |
刘慧, 熊迈, 戎铁华, 等. 大鼠心脏组织TGF-β1 mRNA表达水平与放射性损伤关系的实验研究[J]. 癌症, 2008, 27(1): 18-24. Liu H, Xiong M, Rong TH, et al. Correlation of TGF-β1 mRNA expression toirradiation-induced heart damage in rats[J]. Chin J cancer, 2008, 27(1): 18-24. |
| [11] |
武亚晶, 王雪锋, 王军, 等. 急性期放射性心肌损伤病理学表现及损伤机制研究[J]. 中华放射肿瘤学杂志, 2016, 25(10): 1117-1122. Wu YJ, Wang XF, Wang J, et al. Pathological manifestations of acute-stage radioactive myocardial damage and related mechanisms[J]. Chin J Radiat Oncol, 2016, 25(10): 1117-1122. DOI:10.3760/cma.j.issn.1004-4221.2016.10.021 |
| [12] |
Mitsuma W, Kodama M, Hanawa H, et al. Serum endostatin in the coronary circulation of patients with coronary heart disease and its relation to coronary collateral formation[J]. Am J Cardiol, 2007, 99(4): 494-498. DOI:10.1016/j.amjcard.2006.09.095 |
| [13] |
Nikolova A, Ablasser K, Wyler von Ballmoos MC, et al. Endogenous angiogenesis inhibitors prevent adaptive capillary growth in left ventricular pressure overload hypertrophy[J]. Am J Cardiol, 2012, 94(5): 1509-1517. DOI:10.1016/j.athoracsur.2012.05.052 |
| [14] |
Somanna NK, Valente AJ, Krenz M, et al. The Nox1 / 4 dual inhibitor GKT137831 or Nox4 knockdown inhibits angiotensin-? 9 Ⅱ-induced adult mouse cardiac fibroblast proliferation and migration[J]. J Cell Physio, 2016, 231(5): 1130-1141. DOI:10.1002/jcp.25210 |
| [15] |
Barjaktarovic Z, Schmaltz D, Shyla A, et al. Radiation-induced signaling results in mitochondrial impairment in mouse heart at 4 weeks after exposure to X-rays[J]. PLoS One, 2011, 6(12): e27811. DOI:10.1371/journal.pone.0027811 |
| [16] |
Okada M, Oba Y, Yamawaki H. Endostatin stimulates proliferation and migration of adult rat cardiac fibroblasts through PI3K / Akt pathway[J]. Eur J Pharmacol, 2015, 750: 20-26. DOI:10.1016/j.ejphar.2015.01.019 |
| [17] |
Shimo T, Nakanishi T, Nishida T, et al. Connective tissue growth factor induces the proliferation, migration, and tube formation of vascular endothelial cells in vitro, and angiogenesis in vivo[J]. J Biochem, 1999, 126(1): 137-145. DOI:10.1093/oxfordjournals.jbche-m.a022414 |
| [18] |
Wang B, Haldar SM, Lu Y, et al. The Kruppel-like factor KLF15 inhibits connective tissue growth factor (CTGF) expression in cardiac fibroblasts[J]. J Mol Cell Cardiol, 2008, 45(2): 193-197. DOI:10.1016/j.yjmcc.2008.05.005 |
| [19] |
Kular L, Pakradouni J, Kitabgi P, et al. The CCN family: a new class of inflammation modulators[J]. Biochimie, 2011, 93(3): 377-388. DOI:10.1016/j.biochi.2010.11.010 |
| [20] |
Lin CH, Chen J, Zhang Z, et al. Endostatin and transglutaminase 2 are involved in fibrosis of the aging kidney[J]. Kidney Int, 2016, 89(6): 1281-1292. DOI:10.1016/j.kint.2016.01.030 |
| [21] |
Isobe K, Kuba K, Maejima Y, et al. Inhibition of endostatin / collagen Ⅹ Ⅷ deteriorates left ventricular remodeling and heart failure in rat myocardial infarction model[J]. Circ J, 2010, 74(1): 109-119. DOI:10.1253/circj.cj-09-0486 |
 2020, Vol. 40
2020, Vol. 40


