2. 东华理工大学核科学与工程学院, 南昌 330013
2. School of Nuclear Science and Engineering, East China University of Technology, Nanchang 330013, China
铀是重要的核燃料,是发展核电的前提条件之一。但在天然铀生产过程中不可避免地会产生含铀放射性废水,一旦未经处理,肆意排放到环境中,则会对自然界构成巨大威胁,对此应予以处理[1-3]。近年来,碳纳米材料常被用来吸附分离和回收水体中的铀[4-7]。其中石墨烯纳米带(GNRs)是新发现的碳纳米材料之一,它是宽度为几十nm、长宽比>10的石墨烯,兼具碳纳米管和石墨烯两者的优良性质[8],已被应用到吸附领域[9-10]。研究表明,含氧基团丰富的氧化石墨烯纳米带(GONRs)对铀有很好的吸附效果[11]。若对GONRs进一步功能化,如偕胺肟化[12]和磁性功能化[13],可以大大提高其对铀的吸附性能。为此,本研究将酰胺基团(AM)接枝到GONRs上,合成得到酰胺功能化石墨烯纳米带(GONRs-AM),并将其应用于放射性废水中分离和回收铀。
材料与方法1.主要仪器:电子天平(北京赛多利斯仪器系统有限公司,BS124S型)、可见光分光光度计(天津冠泽科技有限公司,722型)、循环水真空泵(郑州英峪予华仪器有限公司,SHZ-DⅢ型)、pH计(上海仪电科学仪器股份有限公司,PHS-3C型)、集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司,DF-101S型)、数控超声波清洗器(昆山市超声仪器有限公司,KH2200型)、程控箱式炉(杭州卓驰仪器有限公司,SXL-1216型)、真空干燥箱(天津泰斯特仪器有限公司,DZ-2BCⅡ型)、扫描电子显微镜(日本Hitachi公司,S4800型)、红外光谱仪(美国PerkinElmer公司,IR-843型)。
2.主要试剂:浓硫酸(H2SO4)、高锰酸钾(KMnO4)、过硫酸钾(K2S2O8)、无水乙醇(C2H5OH)、过氧化氢(H2O2)、硝酸(HNO3)、氢氧化钠(NaOH)、硝酸钠(NaNO3)、丙烯酰胺、氯乙酸、乙酸钠、偶氮胂(Ⅲ)均购自国药集团化学试剂有限公司。硝酸铀酰购自西安鼎天化工有限公司。多壁碳纳米管购自中国科学院成都有机化学研究所。
3. GONRs的制备:GONRs的制备参见文献[12-14],主要包括H2SO4预氧化,KMnO4氧化、水解和纯化等过程。具体步骤为在三口烧瓶中装入150 ml H2SO4溶液,然后称取1 g多壁碳纳米管装入,于室温下搅拌6 h。搅拌后,称取5 g KMnO4加入混合液中,再搅拌1 h。搅拌完成后将混合液加热到55℃,保持该温度继续反应30 min。之后将温度升至70℃,在该温度下继续反应5 min后冷却至室温。将混合物倒入含有5 ml H2O2的400 ml冰水中,用5.0 μm的聚四氟乙烯膜过滤。所得固体物加入100 ml去离子水,经超声分散30 min后,用截留分子量为3 500的透析袋透析1周。最后,将透析后的混合液体加热蒸发至1 000 ml。所得产物即为GONRs的分散液。
4.酰胺功能化石墨烯纳米带复合材料(GONRs-AM)的合成:获得GONRs分散液后,取50 ml于烧杯中,再向烧杯中加入1 g丙烯酰胺,使用磁力搅拌将其完全溶解,接着加入0.02 g的过硫酸钾作为反应引发剂,再将溶液转移至不锈钢反应釜中,于180℃反应14 h,冷却至室温后过滤。然后,使用去离子水和无水乙醇反复洗涤所得黑色沉淀去除杂质,再置于80℃真空中干燥12 h,最后得到酰胺化石墨烯纳米带(GONRs-AM)。
5.材料表征:对所制得的GONRs和GONRs-AM进行扫描电镜(SEM)表征时,分别取适量样品粘贴到导电胶上,经喷金镀膜后在S4800型扫描电子显微镜上进行微观结构表征。在对GONRs和GONRs-AM进行傅里叶红外光谱(FT-IR)表征时,分别取适量样品加入到KBr固体中,充分研磨后,在压片机上压片后取出,在IR-843型红外光谱仪上进行官能团表征。
6.吸附实验:采用批处理实验方法研究GONRs-AM对铀的吸附性能,考察溶液pH、吸附时间、铀初始浓度、温度和离子强度等对吸附的影响。再对实验结果所得吸附过程的动力学和热力学参数进行计算。用pH计对铀溶液的pH值进行测定,通过HNO3溶液和NaOH溶液进行调节;离子强度通过铀溶液与硝酸钠溶液(体积比1:1)混合来获得。在一定的条件下(pH、离子强度),向50 ml的锥形瓶中加入25 ml一定浓度的铀溶液和一定量的GONRs-AM。再将锥形瓶在一定的温度(T,K)下震荡一定时间(t,min)。震荡完成后,从锥形瓶中取5 ml吸附后的溶液进行离心,转速9 000 r/min,离心半径160 mm,离心30 min后,取1 ml上层清液装入25 ml容量瓶中,用分光光度法对其中的铀浓度进行测量。分光光度法标准曲线绘制过程如下:分别移取含有0、1、2、3、4和5 ml的铀标准溶液(10 mg/ml)于25 ml的容量瓶中,再向其中分别加入5 ml的pH=2.5的氯乙酸-乙酸钠缓冲溶液和浓度为0.06%偶氮胂(Ⅲ)溶液,最后用去离子水进行定容,在波长为650 nm处对其吸光度值进行测量。以空白试剂作参照对比来测定不同浓度铀溶液的吸光度,并在所得数据的基础上绘制标准曲线。吸附后溶液中的铀浓度按上述绘制标准曲线的相同步骤进行分析、测量。
计算吸附量qe和吸附率p,见式(1)和(2)[14]:
| $q_{\mathrm{e}}=\frac{C_{0}-C_{\mathrm{e}}}{m} \times V $ | (1) |
| $P=\frac{C_{0}-C_{\mathrm{e}}}{C_{0}} \times 100 \% $ | (2) |
式中,C0为铀的初始浓度,mg/L;Ce为平衡时铀浓度,mg/L;V为溶液体积,L;m为GONRs-AM的质量,g;qe为平衡时吸附量,mg/g;P为吸附率,%。
7.吸附动力学、吸附等温线模拟和热力学计算方法:使用几种不同的动力学模型,即准一级动力学、准二级动力学和粒内扩散模型,对实验数据进行拟合,3个模型的线性方程分别由式(3)、(4)和(5)表示[15]:
| $\ln \left(q_{\mathrm{e}}-q_{\mathrm{t}}\right)=\ln q_{\mathrm{e}}-k_{1} t $ | (3) |
| $\frac{t}{q_{1}}=\frac{1}{k_{2} q_{\mathrm{e}}^{2}}+\frac{t}{q_{\mathrm{e}}} $ | (4) |
| $q_{\rm{t}}=k_{{i} {\rm{d}}} t^{0.5} $ | (5) |
式中,qe为吸附达到平衡时的吸附量,mg/g;qt是时间为t时的吸附量,mg/g;k1为准一级动力学方程的吸附速率常数,min-1;k2为准二级动力学方程的吸附速率常数,g·mg-1·min-1;kid为颗粒内扩散速率常数,mg·g-1·min-1。
使用Langmuir和Freundlich模型对吸附过程进行吸附等温线模拟,分别由式(6)、(7)表示[15]:
| $\frac{c_{\mathrm{e}}}{q_{\mathrm{e}}}=\frac{1}{b q_{\mathrm{m}}}+\frac{c_{\mathrm{e}}}{q_{\mathrm{m}}} $ | (6) |
| $\ln q_{\rm{e}}=\ln K_{\mathrm{F}}+\frac{1}{n} \ln C_{\mathrm{e}} $ | (7) |
式中,qm为单分层分子吸附能力,mg/g;b为平衡常数,L/mg;KF为一定范围内表示该吸附过程的经验参数,(mg·g-1) (L·mg-1)1/n。
计算用到的主要热力学的参数如吉布斯自由能ΔG(kJ/mol)、焓变ΔH(kJ/mol)、熵变ΔS(kJ·mol-1·K-1)遵循式(8)、(9)转换关系[16]:
| $\ln K_{\mathrm{d}}=\frac{\Delta S}{R}-\frac{\Delta H}{R T} $ | (8) |
| $\Delta G=\Delta H-T \Delta S $ | (9) |
式中,Kd为分配系数,ml/g;T为绝对温度,K;R为气体常数,J·mol-1·K-1。
结果1.材料表征
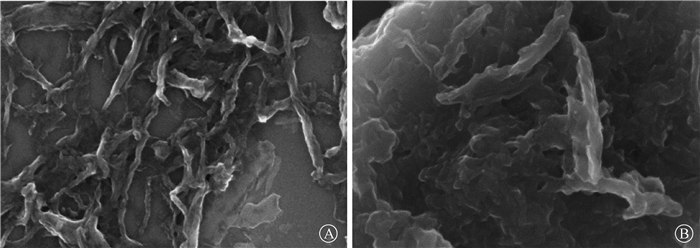
(1) 扫描电镜(SEM):对GONRs和GONRs-AM进行了SEM表征。由图 1可知,GONRs呈纳米带状,直径为30 ~ 100 nm。与GONRs相比,经酰胺功能化的GONRs表面似乎有一层附着物,粘连现象严重,这可能是由于已接枝上的有机功能基团与GONRs表面的强烈的相互作用。
|
注:GONRs.氧化石墨烯纳米带;GONRs-AM.酰胺功能化石墨烯纳米带 图 1 GONRs (A)和GONRs-AM (B)的扫描电镜图×100 000 Figure 1 SEM images of GONRs(A) and GONRs-AM(B) ×100 000 |
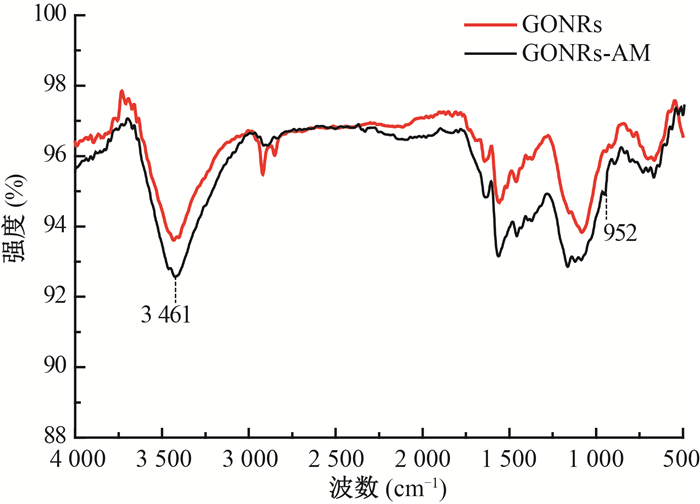
(2) 傅里叶红外光谱(FT-IR):对GONRs和GONRs-AM进行了FT-IR表征。由图 2可知,GONRs在3 440、2 920、1 634和1 578/cm处分别出现了归属于石墨烯纳米带表面羟基或者物理吸附水中羟基的振动峰,饱和C—H的振动吸收峰,C=C基团的特征吸收峰,石墨结构特征峰[15]。在1 714/cm和1 580/cm的峰分别为C=O和C=C—O基团的特征吸收峰。在GONRs-AM的红外谱图中可以看出,在3 461和952/cm处分别出现了属于N—H和C—NH2的伸缩振动峰,这表明GONRs已被成功接枝上酰胺基团[16]。
|
注:GONRs.氧化石墨烯纳米带;GONRs-AM.酰胺功能化石墨烯纳米带 图 2 GONRs和GONRs-AM红外光谱图 Figure 2 FTIR spectra of GONRs and GONRs-AM |
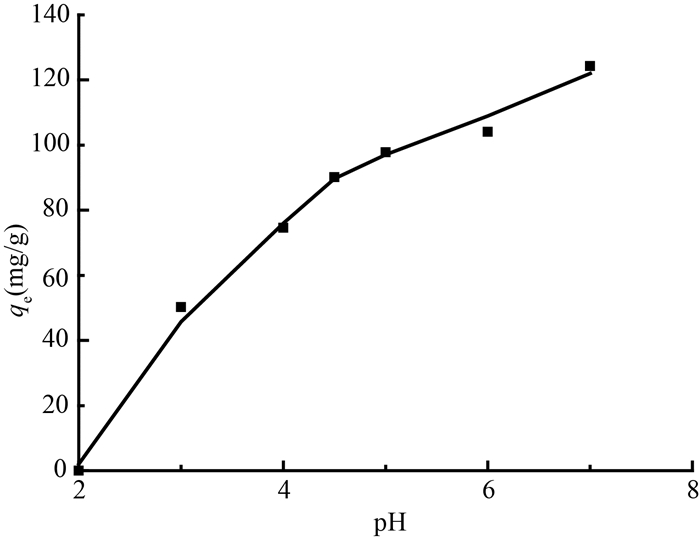
2. pH对吸附性能的影响:pH对吸附剂吸附铀的能力影响显著,图 3显示GONRs-AM在不同pH值下对铀(Ⅵ)吸附量。GONRs-AM对铀(Ⅵ)的吸附能力随着pH的增大而增大,在pH=7时吸附量达到最大值。因为pH较低时,铀(Ⅵ)以UO2+的形式存在于水溶液中,而在pH较低时GONRs-AM对铀的吸附量较低正是H+与UO2+相互竞争的结果[17]。而在pH值较高时吸附量达到最大值,可能是由于铀(Ⅵ)与GONRs-AM之间的静电作用增强了吸附效果。
|
注:实验条件w=10 mg,C0 =50 mg/L,V=25 ml,T=25℃, t=24 h 图 3 pH对GONRs-AM吸附铀的影响 Figure 3 Effect of pH on uranium adsorption on GONRs-AM |
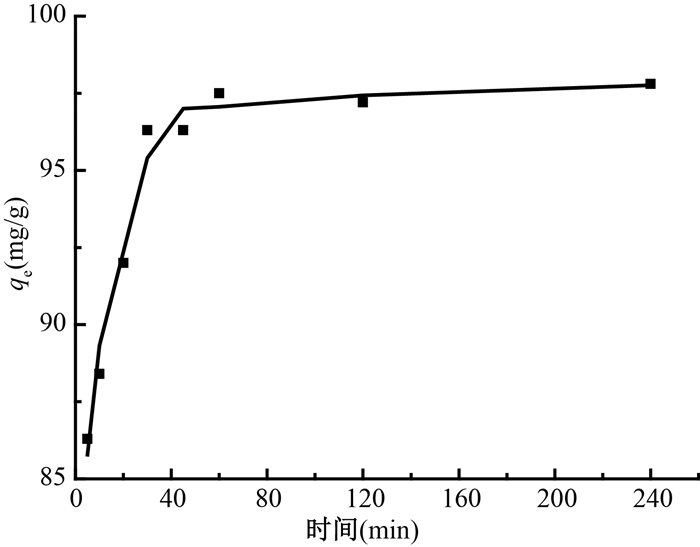
3.吸附时间对吸附的影响及吸附动力学:GONRs-AM对铀的吸附量随吸附时间的变化如图 4所示,在前30 min GONRs-AM对铀的吸附量迅速增加,并在30 min时达到最大吸附量的90%,在60 min基本完成吸附平衡。结果表明GONRs-AM对铀的吸附是一个相对快速过程。
|
注:实验条件w=10 mg,C0 =50 mg/L,V=25 ml,pH=5,T=25℃ 图 4 时间对GONRs-AM吸附铀的影响 Figure 4 Relationship between qe and time for uranium adsorption on GONRs-AM |
通过对吸附过程进行准一级动力学、准二级动力学和粒内扩散模型进行模拟,绘制出ln(qe-qt)与t、t/qt与t和qt与t0.5直线图,根据直线的截距与斜率可计算出式(3)、(4)、(5)中的常数值。
经过计算,酰胺功能化石墨烯纳米带(GONRs-AM)吸附铀的动力学参数:吸附达到平衡时的吸附量qe为97.80 mg/g。准一级动力学模型中,准一级动力学方程的吸附速率常数k1为0.002 8/min,计算所得平衡吸附量qe, cal为6.99 mg/g,相关系数R2为0.548 3。准二级动力学模型中,准二级动力学方程的吸附速率常数k2为0.012 0 g·mg-1·min-1,计算所得平衡吸附量qe, cal为98.14 mg/g,相关系数R2为0.999 9。粒内扩散模型中,粒内扩散速率常数kid为0.792 4 mg·mol·g-1·min-1,相关系数R2为0.950 3。
由此可知,准二级动力学的实际吸附量和理论吸附量很相近,而且其R2接近1,可得到GONRs-AM对铀的吸附最符合准二级动力学模型。而准二级动力学模型则是基于假设速控步骤是一个化学吸附过程,表明GONRs-AM对铀的吸附机理属于化学吸附。
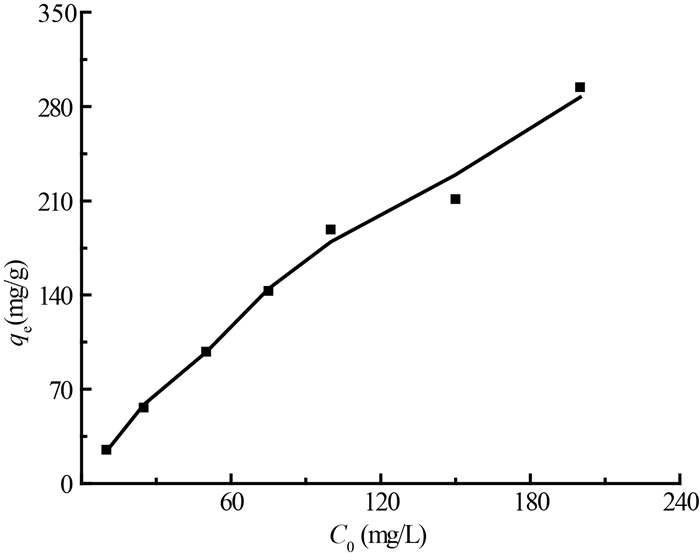
4.铀初始浓度的影响及吸附等温线:在铀初始浓度的影响下GONRs-AM对铀的吸附能力的变化如图 5所示。由图 5可知,GONRs-AM对铀的吸附量随着铀初始浓度的增加而增大,实验条件下测得GONRs-AM对铀的最大吸附量为294.5 mg/g。
|
注:实验条件w=10 mg,V=25 ml,pH=5,T=25℃,t=24 h 图 5 铀初始浓度对GONRs-AM吸附铀的影响 Figure 5 Effect of initial uranium concentration on uranium adsorption on GONRs-AM |
通过Ce/qe与Ce和lnqe与lnCe绘图,根据直线的截距与斜率可计算出式(6)、(7)中的参数具体值,酰胺功能化石墨烯纳米带(GONRs-AM)吸附铀的Freundlich模型参数中,Freundlich吸附常数KF为84.52 mg/g,经验常数n为62.893,相关系数R2为0.681 8。酰胺功能化石墨烯纳米带(GONRs-AM)吸附铀的Langmuir模型参数中,单分层分子吸附能力qm为321.54 mg/g,Langmuir吸附常数KL为0.051 L/mg,相关系数R2为0.899 9。
由此可知,实验测得到的最大吸附量和Langmuir拟合出的理论最大吸附量十分接近,并且其相关系数R2也达到0.899 9,表明该吸附过程更符合Langmuir模型,也说明该吸附主要是GONRs-AM与铀的单层络合吸附过程。
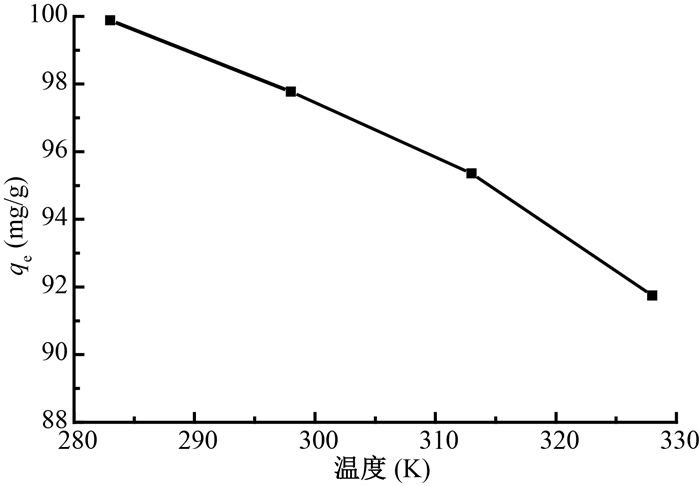
5.温度对吸附的影响及其吸附热力学:温度对GONRs-AM吸附铀的影响如图 6所示。由图可知,GONRs-AM对铀的吸附量随着温度的升高而降低,该吸附过程是一个放热反应。
|
注:实验条件w=10 mg,C0 =50 mg/L,V=25 ml,pH=5,t=24 h 图 6 温度对GONRs-AM吸附铀的影响 Figure 6 Effect of temperature on of uranium adsorption on GONRs-AM |
式(8)、(9)中的热力学参数,经过计算,酰胺功能化石墨烯纳米带(GONRs-AM)吸附铀的热力学参数:焓变ΔH为6.3 kJ/mol、熵变ΔS为54.34 J·mol-1·K-1,吉布斯自由能ΔG在温度为283、298、313和328 K分别为-21.67、-22.48、-23.30和-13.12 kJ/mol。由此可知,GONRs-AM对铀的吸附过程,是一个放热过程,升高温度不利于GONRs-AM对铀吸附的进行。且计算所得为负值的吉布斯自由能随着温度的升高而减小,表明该吸附过程是自发的且不可逆的。
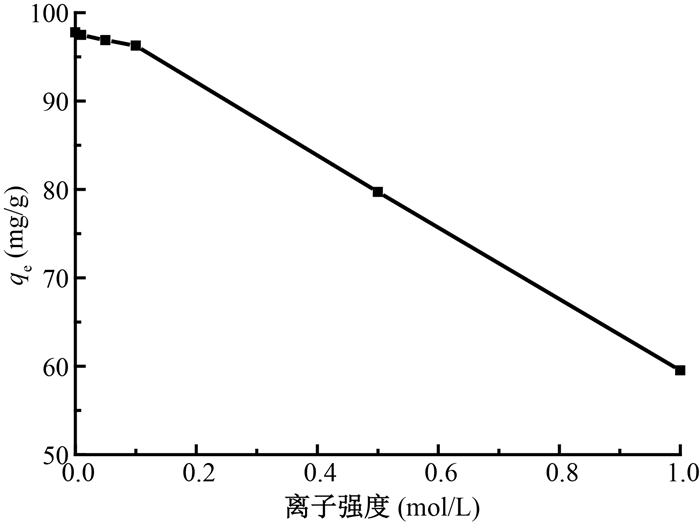
6.离子强度对吸附的影响:离子强度对GONRs-AM吸附铀如图 7所示。从图 7中可以看出,当离子浓度较低时,离子强度对GONRs-AM吸附铀的影响不大,但是当离子强度超过一定值之后,离子强度的增大导致GONRs-AM对铀的吸附量显著减小。这说明GONRs-AM吸附铀的机制主要是外表面络合和离子交换。
|
注:实验条件w=10 mg,C0 =50 mg/L,V=25 ml,pH=5,T=25℃, t=24 h 图 7 离子强度对GONRs-AM吸附铀的影响 Figure 7 Effect of ionic strength on uranium adsorption on GONRs-AM |
讨论
石墨烯纳米带因具有准一维的碳纳米管和二维石墨烯共同特征,日益受到人们的关注,但石墨烯纳米带在实际应用中还存在大规模生产的问题[8]。目前,石墨烯纳米带的主要制备方法有:化学气相沉积法、有机合成法、膨胀石墨带减薄法、刻蚀石墨烯法、切割碳纳米管法等[2-3, 5]。其中,利用氧化剂切割碳纳米管法是一种能够实现大规模生产的简单有效方法,并且该法制备的氧化石墨烯纳米带(GONRs)表面的含氧官能团含量大大增加,亲水性好[2-3, 6]。因此,上述特点使得石墨烯纳米带有望成为一种较为理想的、有极大实用潜力的高吸附容量和高选择性的固相吸附剂的基质材料,这为石墨烯纳米带基吸附剂在乏燃料后处理以及放射性废液的处理处置中的应用提供了坚实的基础。此外,选择石墨烯纳米带作为吸附剂时,多数情况仍需对碳纳米材料进行表面功能化,如表面氧化、化学接枝、辐照接枝、等离子体激发接枝、浸渍或负载等,使之具有对铀有高亲和性和高选择性的官能团,以得到对铀有高吸附量和高选择性的吸附剂。其中,酰胺是一个对铀较快吸附速率、高选择性和亲和性的官能团,在铀浓度很小的情况下仍可对其进行络合作用。而目前用石墨烯纳米带作吸附剂吸附铀的研究较少,有必要对其进一步研究。但用石墨烯纳米带做吸附剂在实际应用中存在分离困难和具有纳米毒性的问题,从而可能限制了石墨烯纳米带在吸附中的应用。
本研究以碳纳米管为原料,利用氧化剂轴向切割碳纳米管法制备氧化石墨烯纳米带,并将酰胺功能团接枝其上,合成了GONRs-AM,以提高其对铀的吸附性能,得到了GONRs-AM对铀的吸附最佳条件:溶液pH为5,吸附剂用量为10 mg,溶液中铀浓度为50 mg/L,溶液体积为25 ml,温度为25℃,振荡时间为1 h。合成产物经过SEM和FT-IR表征,确认氧化石墨烯纳米带成功接枝上酰胺基团。与GONRs相比,经酰胺功能化的GONRs表面粘连现象严重,这可能是酰胺功能基团与GONRs表面强烈的相互作用。吸附实验研究表明,GONRs-AM对铀的吸附是受pH影响的,吸附量随pH值的升高而增加,这与铀在不同pH条件下的离子形态有关,也与GONRs-AM之间的络合作用有关。吸附过程在60 min基本完成,说明GONRs-AM对铀的吸附是一个相对快速过程。GONRs-AM对铀的最大吸附量为294.5 mg/g,与其他无机矿物(海泡石的吸附量为34.61 mg/g)[18]、简单氧化物(TiO2的吸附量为44 mg/g)[19]、有机聚合物(XAD离子交换树脂的吸附量为39.98 mg/g)[20]、碳质材料(有序介孔炭的吸附量为232.6 mg/g)[21]、生物质(凤眼莲的吸附量为142.85 mg/g)[22]以及其他金属有机框架材料(MOF-76的吸附量为298 mg/g)[23]等铀吸附剂相比,该吸附量较高,吸附效果良好,且石墨烯纳米带基吸附剂物理、化学和辐照性能温度,能适应核工业废水高酸度和高辐射的要求。因此,石墨烯纳米带是一种潜在的放射性核素吸附分离剂[11-12]。吸附更加复合准二级动力学模型,推测GONRs-AM对铀的吸附是一个化学吸附过程。Langmuir模型能够很好地描述该吸附过程,也说明GONRs-AM对铀的吸附主要是发生在表面上的单层吸附。离子强度的影响也说明GONRs-AM吸附铀的机制主要是外表面络合和离子交换。这些结果都表明,UO22+在GONRs-AM上的吸附性可能是由于与大量的含O和含N官能团形成了稳定的络合物,但具体的吸附机制值得进一步研究。
综上,本研究证实了GONRs-AM能有效去除废水中的铀,其机制是与酰胺基团络合作用有关。研究成果将为铀的分离富集提供理论依据和科学依据,对石墨烯纳米带基吸附剂用于分离富集放射性核素具有重要的促进作用,为减少铀对环境和人类健康的潜在威胁,具有非常重要的经济、社会和环境意义。
利益冲突 无
作者贡献声明 吴振宇负责吸附性能测试和论文攥写;王仲文负责课题设计和指导修改论文;王云负责材料合成与表征
| [1] |
Wang L, Yang Z, Gao J, et al. A biocompatible method of decorporation:bisphosphonate-modified magnetite nanoparticles to remove uranyl ions from blood[J]. J Am Chem Soc, 2006, 128(41): 13358-13359. DOI:10.1021/ja0651355 |
| [2] |
Li J, Zhang Y. Remediation technology for the uranium contaminated environment:a review[J]. Proc Environ Sci, 2012, 13: 1609-1615. DOI:10.1016/j.proenv.2012.01.153 |
| [3] |
王津, 李红春, 刘娟. 铀矿开采利用过程中的放射性污染研究进展[J]. 环境与健康杂志, 2013, 30(11): 1033-1036. Wang J, Li HC, Liu J. Progress on radioactive pollution and related problems caused by uranium mining[J]. J Environ Health, 2013, 30(11): 1033-1036. DOI:10.16241/j.cnki.1001-5914.2013.11.020 |
| [4] |
Rao TP, Metilda P, Gladis JM. Preconcentration techniques for uranium (Ⅵ) and thorium (Ⅳ) prior to analytical determination-an overview[J]. Talanta, 2006, 68(4): 1047-1064. DOI:10.1016/j.talanta.2005.07.021 |
| [5] |
Li B, Ma L, Tian Y, et al. A catechol-like phenolic ligand-functionalized hydrothermal carbon:one-pot synthesis, characterization and sorption behavior toward uranium[J]. J Hazard Mater, 2014, 271: 41-49. DOI:10.1016/j.jhazmat.2014.01.060 |
| [6] |
Zhao Y, Liu C, Feng M, et al. Solid phase extraction of uranium (Ⅵ) onto benzoylthiourea-anchored activated carbon[J]. J Hazard Mater, 2010, 176(1-3): 119-124. DOI:10.1016/j.jhazmat.2009.11.005 |
| [7] |
Chen F, Tan N, Yan XM, et al. Uranium (Ⅵ) removal from aqueous solution by poly (Amic Acid)-modified marine fungus[J]. Sep Sci Technol, 2014, 49(8): 1251-1258. DOI:10.1080/01496395.2013.877033 |
| [8] |
Hirsch A. Unzipping carbon nanotubes:a peeling method for the formation of graphene nanoribbons[J]. Angew Chem Int Ed Engl, 2009, 48(36): 6594-6596. DOI:10.1002/anie.200902534 |
| [9] |
Liu N, Kim K, Hsu PC, et al. Large-scale production of graphene nanoribbons from electrospun polymers[J]. J Am Chem Soc, 2014, 136(49): 17284-17291. DOI:10.1021/ja509871n |
| [10] |
Sinitskii A, Dimiev A, Kosynkin DV, et al. Graphene nanoribbon devices produced by oxidative unzipping of carbon nanotubes[J]. ACS Nano, 2010, 4(9): 5405-5413. DOI:10.1021/nn101019h |
| [11] |
Wang Y, Wang ZS, Gu ZX, et al. Uranium (Ⅵ) sorption on graphene oxide nanoribbons derived from unzipping of multiwalled carbon nanotubes[J]. J Radioanal Nucl Chem, 2015, 304(3): 1329-1337. DOI:10.1007/s10967-015-3981-0 |
| [12] |
Wang Y, Wang ZS, Ang R, et al. Synthesis of amidoximated graphene oxide nanoribbons from unzipping of multiwalled carbon nanotubes for selective separation of uranium (Ⅵ)[J]. RSC Adv, 2015, 59(108): 89309-89318. DOI:10.1039/C5RA15977F |
| [13] |
吴鹏, 王云, 胡学文, 等. 四氧化三铁/氧化石墨烯纳米带复合材料对铀的吸附性能[J]. 原子能科学技术, 2018, 52(9): 1561-1568. Wu P, Wang Y, Hu XW, et al. Uranium sorption on ferroferric oxide/graphene oxide nanoribbon composite material[J]. Atom Energy Sci Technol, 2018, 52(9): 1561-1568. DOI:10.7538/yzk.2017.youxian.0761 |
| [14] |
王云, 吴鹏, 胡学文, 等. 氧化石墨烯纳米带对Th (Ⅳ)的吸附性能研究[J]. 东华理工大学学报(自然科学版), 2018, 41(1): 71-77. Wang Y, Wu P, Hu XW, et al. Th (Ⅳ) sorption on graphene oxide nanoribbons[J]. J East China Univ Technol, 2018, 41(1): 71-77. DOI:10.3969/j.issn.1674-3504.2018.01.012 |
| [15] |
Ren XM, Shao DD, Zhao GX, et al. Plasma induced multiwalled carbon nanotube grafted with 2-vinylpyridine for preconcentration of Pb (Ⅱ) from aqueous solutions[J]. Plasma Process Polym, 2011, 8(7): 589-598. DOI:10.1002/ppap.201000192 |
| [16] |
Gao BJ, Gao YC, Li YB. Preparation and chelation adsorption property of composite chelating material poly (amidoxime)/SiO2 towards heavy metal ions[J]. Chem Eng J, 2010, 158(3): 542-549. DOI:10.1016/j.cej.2010.01.046 |
| [17] |
Huang F, Xu Y, Liao S, et al. Preparation of amidoxime polyacrylonitrile chelating nanofibers and their application for adsorption of metal ions[J]. Materials, 2013, 6(3): 969-980. DOI:10.3390/ma6030969 |
| [18] |
Donat R. The removal of uranium (Ⅵ) from aqueous solutions onto natural sepiolite[J]. J Chem Thermodynamics, 2009, 41(7): 829-835. DOI:10.1016/j.jct.2009.01.009 |
| [19] |
Wang G, Zhen J, Zhou L, et al. Adsorption and photocatalytic reduction of U (Ⅵ) in aqueous TiO2 suspensions enhanced with sodium formate[J]. J Radioanal Nucl Chem, 2014, 304(2): 579-585. DOI:10.1007/s10967-014-3831-5 |
| [20] |
Karve M, Pandey K. Sorption studies of U (Ⅵ) on amberlite XAD-2 resin impregnated with cyanex272[J]. J Radioanal Nucl Chem, 2012, 293(3): 783-787. DOI:10.1007/s10967-012-1726-x |
| [21] |
Nie B, Zhang Z, Cao X, et al. Sorption study of uranium from aqueous solution on ordered mesoporous carbon CMK-3[J]. J Radioanal Nucl Chem, 2012, 295(1): 663-670. DOI:10.1007/s10967-012-1820-0 |
| [22] |
Yi ZJ, Yao J, Chen HL, et al. Uranium biosorption from aqueous solution onto eichhornia crassipes[J]. J Environ Radioact, 2016, 154: 43-51. DOI:10.1016/j.jenvrad.2016.01.012 |
| [23] |
Yang W, Bai ZQ, Shi WQ, et al. MOF-76:from a luminescent probe to highly efficient U (Ⅵ) sorption material[J]. Chem Commun (Camb), 2013, 49(88): 10415-10417. DOI:10.1039/c3cc44983a |
 2020, Vol. 40
2020, Vol. 40
