早熟衰老或早衰(premature senescence)是指细胞在生长和发育过程中,在非端粒信号刺激下,增殖能力和生理功能下降,提前出现退行性改变[1]。通常细胞早衰发生时伴随以下特征:细胞形态改变[2],增殖能力减弱,糖酵解相关标志物β-半乳糖苷酶(SA-β-gal)活性增高,胞内溶酶体数量增多[3-5],迁移能力降低;早衰相关蛋白P16、P53表达增加。
日光中的中波紫外线(ultraviolet B,UVB)长期或过量照射会对皮肤细胞产生严重损害[6],其中人源角质形成细胞(keratinocytes,KC)是UVB作用于人皮肤的重要靶点细胞[7]。Kim等[8]和Kim[9]发现UVB可诱导HaCaT细胞(永生化KC)发生早衰。现有的研究中涉及的UVB剂量点较少,且仅揭示了UVB诱发的早衰现象,对早衰信号通路并未进一步阐明。本研究以HaCaT细胞为模型,来确定UVB可诱发细胞早衰并探索相关机制。
材料与方法1.仪器与试剂:SH4B-T紫外光疗仪(上海Sigma公司);Thermo Lab systems MK3酶标仪(美国Thermo Fisher Scientific公司);倒置相差显微镜及成像系统(日本Olympus公司)。胎牛血清、MEM/EBSS培养基购自美国HyClone公司;磷酸缓冲盐溶液(PBS)、姬姆萨染色液、甲醛溶液均为本实验室配制;β-半乳糖苷酶细胞染色试剂盒、RIPA细胞裂解液、溶酶体红色荧光探针、青霉素-链霉素溶液均购自江苏碧云天公司;罗氏磷酸酶抑制剂及蛋白酶抑制剂,P53购自美国CST公司,P16抗体购自英国Abgent公司,β-肌动蛋白抗体、二抗山羊抗兔抗体和山羊抗小鼠抗体购自北京中杉金桥生物公司;人永生化角质形成细胞HaCaT购自北京协和医学院细胞库。
2.细胞照射方法:取对数生长期HaCaT细胞,UVB照射采用SH4B-T紫外光疗仪,UVB发射光波长为311~313 nm,照射距离约为40 cm,照射剂量采用本单位TN-2340紫外线强度计校准细胞。实验分为对照组和实验组,对照组UVB照射的吸收剂量为0,实验组剂量分别为20、50、80和100 mJ/cm2。
3.克隆形成实验:取指数生长期的HaCaT细胞,用培养液悬成单细胞,各组细胞分别接种500个于3 ml预温37℃培养液的60 mm培养皿中。对细胞进行照射处理,将培养皿移入37℃、5%CO2恒温培养箱静置培养7 d后终止培养。用PBS洗涤细胞3次,甲醇固定20 min,去甲醇,姬姆萨染色15 min,冲洗晾干后解剖显微镜下计数克隆数,克隆形成率(colony forming efficiency,CFE)计算公式为:CFE(%)=克隆数/接种细胞数×100%。
4. β-半乳糖苷酶染色实验:HaCaT细胞于96孔板中培养72 h后,吸除细胞培养液,用PBS洗涤1次,每孔加入100 μl β-半乳糖苷酶染色固定液,室温固定15 min。吸除固定液,用PBS洗涤细胞3次,每次3 min。吸除PBS,每孔加入100 μl染色工作液,37℃孵育过夜,次日使用倒置相差显微镜及成像系统观察、拍照。
5.溶酶体红色荧光探针Lyso-Tracker Red染色实验:于暗处取少量Lyso-Tracker Red按照1 :20 000的比例加入到细胞培养液中,使最终浓度为50 nmol/L,使用前37℃预温育。照射后分别培养24、48、72 h的细胞,去除细胞培养液,加入配制的Lyso-Tracker Red染色工作液,与细胞37℃共孵育30 min。去除Lyso-Tracker Red染色工作液,加入新鲜细胞培养液。随后用化学发光仪检测红色荧光值,并用荧光显微镜及成像系统进行观察、拍照。
6.细胞划痕实验:取对数期的HaCaT细胞,调节细胞浓度为5×105/ml,使用划痕实验专用培养皿,每孔加入70 μl细胞悬液,于37℃、5%CO2恒温培养箱中培养过夜。次日使用紫外灯对HaCaT细胞进行照射,拔掉插件,细胞之间留有一道标准的划痕,加无血清的培养液,定时使用倒置相差显微镜及成像系统观察、拍摄细胞愈合的情况。
7.蛋白提取及Western blot实验:RIPA细胞裂解液裂解HaCaT细胞,加入磷酸酶抑制剂和蛋白酶抑制剂,冰浴振荡45 min,采用离心半径8.3 cm,12 000 r/min,离心10 min取上清,使用二喹啉甲酸(BCA)蛋白定量试剂盒进行蛋白定量。加入5×上样缓冲液,煮沸10 min,放入-20℃冰箱,备用。
取30 μg上样,制备15%的聚丙烯酰胺凝胶垂直电泳,将蛋白转移至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉封闭,分别用抗P53抗体(工作浓度1 :1 000)、抗P16抗体(工作浓度1 :1 000)及抗β-肌动蛋白多抗(工作浓度1 :2 000)检测P53、P16及β-肌动蛋白的表达,一抗及二抗孵育后,采用增强化学发光(ECL)法显影。电泳条带经Image J软件处理计算,目的条带与内参条带的比值代表目的蛋白的表达水平。
8.统计学处理:采用SPSS 23.0统计软件进行数据处理,数据符合正态分布,计量资料用x±s表示。多组间比较采用单因素方差分析,LSD法进行组间两两比较。P<0.05为差异有统计学意义。
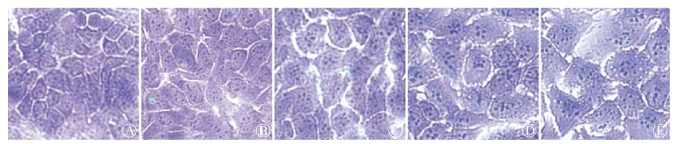
结果1.不同剂量UVB照射后HaCaT细胞形态变化:如图 1和表 1所示,随着UVB照射剂量的增加,HaCaT细胞变大,同时变大的细胞比例增多(F=115.18,P < 0.05)。
|
A.0 mJ/cm2;B.20 mJ/cm2;C.50 mJ/cm2;D. 80 mJ/cm2;E.100 mJ/cm2 图 1 不同剂量UVB照射后72 h HaCaT细胞形态变化姬姆萨染色×100 A. 0 mJ/cm2; B.20 mJ/cm2; C.50 mJ/cm2; D. 80 mJ/cm2; E.100 mJ/cm2 Figure 1 Morphology of HaCaT cells 72 h after UVB exposure with different doses Giemsa staining ×100 |
|
|
表 1 不同剂量UVB照射后72 h HaCaT细胞早衰检测指标(%, x±s) Table 1 Index of premature senescence of HaCaT cells at 72 h after different doses of UVB exposure (%, x±s) |
2.不同剂量UVB照射后HaCaT细胞存活率的变化:结果如表 1所示,UVB照射HaCaT细胞72 h后,20、50、80、和100 mJ/cm2不同剂量间差异均有统计学意义(F=410.32,P < 0.05),克隆形成率降低。
3.不同剂量UVB照射后HaCaT细胞β-半乳糖苷酶活性的变化:如图 2所示,UVB照射HaCaT细胞后72 h,对照组β-半乳糖苷酶染色较浅,且数量较少;而实验组细胞被染成蓝绿色,染色较深,HaCaT细胞体积增大,形状不规则。细胞计数结果显示,与对照组β-半乳糖苷酶活性相比,实验组活性增高,差异有统计学意义(F=16.31,P < 0.05)。
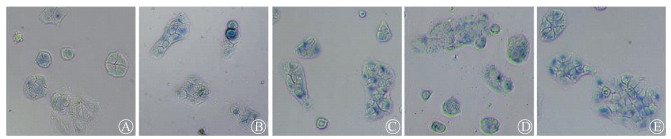
|
A.0 mJ/cm2;B.20 mJ/cm2;C.50 mJ/cm2;D. 80 mJ/cm2;E.100 mJ/cm2
图 2 不同剂量UVB照射后72 h HaCaT细胞β-半乳糖苷酶染色实验结果β-半乳糖苷酶染色×100
β-Galactosidase staining ×10 |
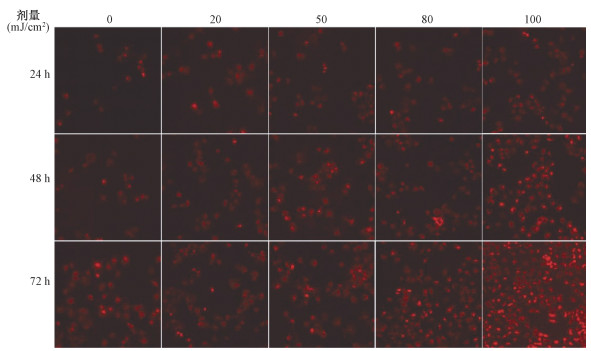
4.不同剂量UVB照射后HaCaT细胞溶酶体数量的变化:如图 3与表 2所示,HaCaT细胞随UVB照射剂量的增加,24、48、72 h后溶酶体荧光信号增强,提示溶酶体数量增多,照射组差异均有统计学意义(F=17.65、38.36、13.66,P < 0.05),早衰细胞数量增加。
|
图 3 不同剂量UVB照射后24、48、72 h HaCaT细胞溶酶体数量的变化溶酶体红色荧光探针×100 Figure 3 Quantitative change of lysosomes in HaCaT cells 24, 48 and 72 h after UVB exposure with different doses Lyso-Tracker Red staining ×100 |
|
|
表 2 不同剂量UVB照射后24、48、72 h HaCaT细胞溶酶体数量的变化(个/孔,x±s) Table 2 Quantitative change of lysosomes in HaCaT cells 24, 48 and 72 h after UVB exposure with different doses(/hole, x±s) |
5.不同剂量UVB照射后HaCaT细胞迁移能力的变化:如表 3与图 4所示,UVB照射后HaCaT细胞愈合能力随照射剂量的增加而减弱,48 h后划痕基本愈合,划痕愈合率差异有统计学意义(F=8.21、11.48,P < 0.05)。
|
|
表 3 不同剂量UVB照射后24、48 h HaCaT细胞划痕愈合率(%,x±s) Table 3 Healing rates of scratched culture 24 and 48 h after UVB exposure with different doses (%, x±s) |
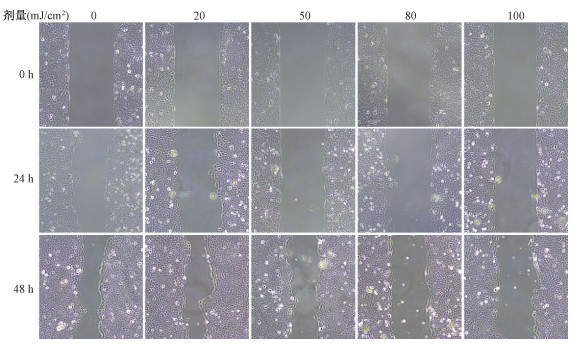
|
图 4 不同剂量UVB照射后0、24、48 h HaCaT细胞划痕实验结果×100 Figure 4 Scratch test of HaCaT cells 0, 24, 48 h after UVB exposure with different doses ×100 |
6.不同剂量UVB照射后HaCaT细胞P53、P16表达的变化:利用蛋白质印迹实验检测P53、P16蛋白表达,P53、P16表达量结果如图 5和表 4所示,经20、50、80和100 mJ/cm2 UVB照射HaCaT细胞后72 h,P16表达量增加,蛋白表达差异有统计学意义(F=250.72,P < 0.05),P53表达量也显著增加(F=68.40,P < 0.05)。

|
图 5 不同剂量UVB照射后72 h HaCaT细胞P53、P16蛋白的表达 Figure 5 The protein expressions of P53 and P16 in HaCaT cells 72 h after UVB exposure with different doses |
|
|
表 4 不同剂量UVB照射后72 h HaCaT细胞P53、P16蛋白表达(x±s) Table 4 The protein expressions of P53 and P16 in HaCaT cells 72 h after UVB exposure with different doses(x±s) |
讨论
不同种类的射线诱发肿瘤细胞及正常细胞发生早衰的研究均有报道。多项研究发现,X、γ射线照射可引起人肺癌细胞H1299、乳腺间质成纤维细胞发生早衰[10-11]。电离辐射可抑制瘢痕疙瘩细胞增殖,使细胞出现早衰表型[12]。同时UVB辐射可诱导正常成纤维细胞中β-半乳糖苷酶的表达,细胞呈现早衰状态[13]。本研究结果显示UVB照射后,HaCaT细胞的形态发生变化,增殖能力降低,溶酶体数量增多,同时细胞糖酵解相关标志物β-半乳糖苷酶活性(SA-β-gal)增高,迁移能力降低,表明UVB照射可致HaCaT细胞发生早衰。
目前,研究发现细胞衰老的信号通路主要有3条,分别为P16、P53和P62介导的信号通路[14-16]。研究发现,人黑素细胞衰老过程中P53/P21信号通路激活,P53表达增加[17]。γ射线可通过P16高表达使人乳腺间质成纤维细胞发生早衰[11]。成纤维细胞受到电离辐射时,衰老信号激活P62,细胞进行选择性自噬降解,发生免疫反应,进入衰老状态[14]。本研究结果发现HaCaT细胞受UVB照射后P53、P16蛋白表达升高,HaCaT细胞发生早衰。
本研究发现选取的4个UVB照射剂量点均可使HaCaT细胞发生早衰,早衰细胞出现多个早衰相关表型和特征,与文献结果一致。同时,研究发现,UVB照射HaCaT细胞后,100 mJ/cm2剂量点P16和P53蛋白表达增加显著,表明UVB可能通过激活P16和P53衰老信号通路引起HaCaT细胞发生早衰。HaCaT细胞作为表皮细胞肩负着合成黑色素的重任,因此,HaCaT细胞发生早衰可能会影响皮肤细胞黑色素的合成。这一发现,可能为揭示夏季白癜风患病率高发提供一定理论支持。
利益冲突 无
作者贡献声明 闫娟负责实验和论文撰写;刘青杰、田梅指导论文修改;陆雪、蔡恬静、李爽、赵骅、田雪蕾参与实验设计;陈德清、高玲提供研究思路和指导论文修改
| [1] |
Luo H, Wang L, Schulte BA, et al. Resveratrol enhances ionizing radiation-induced premature senescence in lung cancer cells[J]. Int J Oncol, 2013, 43(6): 1999-2006. DOI:10.3892/ijo.2013.2141 |
| [2] |
van Rensburg SJ, Daniels WMU, van Zyl JM, et al. A comparative study of the effects of cholesterol, beta-sitosterol, beta-sitosterol glucoside, dehydro-epiandrosterone sulphate and melatonin on in vitro lipid peroxidation[J]. Metab Brain Dis, 2000, 15(4): 257-265. DOI:10.1023/a:1011167023695 |
| [3] |
Dimri GP, Lee X, Basile G, et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J]. Proc Natl Acad Sci USA, 1995, 92(20): 9363-9367. DOI:10.1073/pnas.92.20.9363 |
| [4] |
Lee BY, Han JA, Im JS, et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase[J]. Aging Cell, 2006, 5(2): 187-195. DOI:10.1111/j.1474-9726.2006.00199.x |
| [5] |
López-Otín C, Blasco MA, Partridge L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-1217. DOI:10.1016/j.cell.2013.05.039 |
| [6] |
Liu J, Zhu H, Premnauth G, et al. UV cell stress induces oxidative cyclization of a protective reagent for DNA damage reduction in skin explants[J]. Free Radic Biol Med, 2019, 134: 133-138. DOI:10.1016/j.freeradbiomed.2018.12.037 |
| [7] |
Li L, Huang T, Lan C, et al. Protective effect of polysaccharide from Sophora japonica L. flower buds against UVB radiation in a human keratinocyte cell line (HaCaT cells)[J]. J Photochem Photobiol B, 2019, 191: 135-142. DOI:10.1016/j.jphotobiol.2018.12.001 |
| [8] |
Kim W, Kim E, Yang HJ, et al. Inhibition of hedgehog signalling attenuates UVB-induced skin photoageing[J]. Exp Dermatol, 2015, 24(8): 611-617. DOI:10.1111/exd.12735 |
| [9] |
Kim HK. Protective effect of garlic on cellular senescence in UVB-exposed HaCaT human keratinocytes[J]. Nutrients, 2016, 8(8): 464. DOI:10.3390/nu8080464 |
| [10] |
Suzuki K, Mori I, Nakayama Y, et al. Radiation-induced senescence-like growth arrest requires TP53 function but not telomere shortening[J]. Radiat Res, 2001, 155(1 Pt 2): 248-253. DOI:10.1667/0033-7587(2001)155[0248:rislga]2.0.co;2 |
| [11] |
Liakou E, Mavrogonatou E, Pratsinis H, et al. Ionizing radiation-mediated premature senescence and paracrine interactions with cancer cells enhance the expression of syndecan 1 in human breast stromal fibroblasts:the role of TGF-β[J]. Aging (Albany NY), 2016, 8(8): 1650-1669. DOI:10.18632/aging.100989 |
| [12] |
季江.瘢痕疙瘩成纤维细胞电离辐射效应及诱导细胞早期衰老相关基因表达研究[D].苏州: 苏州大学, 2014. Ji J. The effects of ionizing radiation on Keloid fibroblasts and inducing premature senescence related gene expression[D].Suzhou: Soochow University, 2014. |
| [13] |
Wang YN, Wu W, Chen HC, et al. Genistein protects against UVB-induced senescence-like characteristics in human dermal fibroblast by p66Shc down-regulation[J]. J Dermatol Sci, 2010, 58(1): 19-27. DOI:10.1016/j.jdermsci.2010.02.002 |
| [14] |
Kang C, Xu Q, Martin TD, et al. The DNA damage response induces inflammation and senescence by inhibiting autophagy of GATA4[J]. Science, 2015, 349(6255): aaa5612. DOI:10.1126/science.aaa5612 |
| [15] |
McConnell BB, Starborg M, Brookes S, et al. Inhibitors of cyclin-dependent kinases induce features of replicative senescence in early passage human diploid fibroblasts[J]. Curr Biol, 1998, 8(6): 351-354. DOI:10.1016/s0960-9822(98)70137-x |
| [16] |
Picardo M, Bastonini E. A new view of vitiligo:looking at normal-appearing skin[J]. J Invest Dermatol, 2015, 135(7): 1713-1714. DOI:10.1038/jid.2015.92 |
| [17] |
Haferkamp S, Tran SL, Becker TM, et al. The relative contributions of the p53 and pRb pathways in oncogene-induced melanocyte senescence[J]. Aging (Albany NY), 2009, 1(6): 542-556. DOI:10.18632/aging.100051 |
 2020, Vol. 40
2020, Vol. 40


