2. 上海市质子重离子医院放射物理科 上海质子重离子放射治疗工程技术研究中心, 201315;
3. 上海市质子重离子医院放射物理科 复旦大学附属肿瘤医院质子重离子中心放射物理科 上海质子重离子放射治疗工程技术研究中心, 201315;
4. 上海市质子重离子医院放疗科 复旦大学附属肿瘤医院质子重离子中心放疗科 上海质子重离子放射治疗工程技术研究中心, 201315
2. Department of Medical Physics, Shanghai Proton and Heavy Ion Center; Shanghai Engineering Research Center of Proton and Heavy Ion Radiation Therapy, 201315;
3. Department of Medical Physics, Shanghai Proton and Heavy Ion Center; Department of Medical Physics, Shanghai Proton and Heavy Ion Center, Fudan University Cancer Hospital; Shanghai Engineering Research Center of Proton and Heavy Ion Radiation Therapy, 201315;
4. Department of Radiation Oncology, Shanghai Proton and Heavy Ion Center; Department of Radiation Oncology, Shanghai Proton and Heavy Ion Center, Fudan University Cancer Hospital; Shanghai Engineering Research Center of Proton and Heavy Ion Radiation Therapy, 201315
胸腺恶性肿瘤是一种少见肿瘤,但其发生率在前纵隔肿瘤中占比最高,为(1.5~3.2)×10-6。其常见病理类型为胸腺瘤和胸腺癌。胸腺瘤生长较为缓慢,后者恶性程度较高,有更高的转移倾向。放射治疗是这类患者综合治疗中的重要一环。由于预期生存较长,放疗后患者纵隔可能会出现多种心肺并发症及辐射诱发的继发性恶性肿瘤,部分抵消了放疗控制肿瘤带来的临床获益[1-4]。质子、碳离子(粒子)射线由于其物理和生物学特性,可较光子射线降低正常组织受量、提高肿瘤细胞杀伤力,有望进一步降低放疗不良反应、甚至提高疗效。目前国际上尚未见笔形束扫描技术碳离子+/-质子治疗胸腺恶性肿瘤的临床研究报道。本研究对13例有可见肿瘤的胸腺肿瘤患者进行了光子和粒子放疗计划间的剂量学对比分析,并回顾性总结了本院使用质子碳离子笔形束扫描技术治疗19例胸腺恶性肿瘤患者的临床结果。
资料与方法1.患者一般资料:2015年9月至2018年8月,上海市质子重离子医院共收治19例接受粒子放疗且至少有1次随访的胸腺恶性肿瘤患者。中位年龄55(34~74)岁;分期为Masaoka-Koga Ⅰ~ⅣB期,其中Ⅲ期及以上患者15例(78.9%)。可见肿瘤最大直径中位数5.7(2.7~12.8)cm,肿瘤体积(GTV)中位数88.7(27.5~660.9)cm3。所有患者均获病理学证实,包括10例胸腺瘤,6例胸腺癌和3例胸腺神经内分泌肿瘤。19例患者中,初治患者5例;术后患者14例,其中术后肉眼肿瘤残留(R2切除)7例;术后放疗后复发患者1例(伴纵隔淋巴结和单发肺转移)。3例患者伴副瘤综合征。患者临床特征总结见表 1。
|
|
表 1 19例胸腺肿瘤患者的临床特征 Table 1 The clinical characteristics of 19 patients with thymic malignancies |
2.放疗准备与实施:粒子放疗由德国西门子IONTRIS®系统实施,使用笔形束扫描技术,提供质子(50~250 MeV)和碳离子(85~430 MeV)两种射线。对有可见肿瘤者,根据定位CT、诊断CT及磁共振或正电子发射计算机断层显像等影像学资料决定GTV/iGTV;临床靶区体积(CTV)为GTV/iGTV向各方向外放5~8 mm。对于术后无可见肿瘤的患者,CTV为瘤床范围,根据手术前影像学资料和术中放置的银夹标记(如有)等决定。处方和正常组织限量均采用光子等效生物剂量(equivalent dose to Gy of photon,GyE)。呼吸控制技术的使用、制模、定位、计划靶区体积(PTV)设定、计划要求和放疗实施前验证等详见文献[5]。最终各有7、2和10例患者在自由呼吸、主动呼吸控制技术(active breathing control,ABC)和呼吸门控技术下接受定位和放疗。放疗剂量:根治性放疗(初治或R2切除术后)采用质子44.0~48.4 GyE/20~22次加碳离子推量21.0~23.1 GyE/7次;完整切除(R0切除)术后采用质子45 GyE/25次;术后显微镜下残留(R1切除)采用质子60.0~61.6 GyE/28~30次;术后放疗后复发采用碳离子60 GyE/20次。
3.剂量对比:对13例有可见肿瘤的患者,在第1套定位CT上行3套放疗计划:光子和质子:66 Gy(E)/33次,碳离子66 GyE/22次。光子放疗计划在Pinnacle Planning System®中完成,使用6 MV X射线,调强放疗技术(IMRT),计划要求同质子碳离子放疗计划。比较3套放疗计划中各危及器官(organs at risk,OAR)受量及受照区域积分剂量(integral dose,ID=减去PTV的剂量计算区域的体积×其接受的平均剂量)等指标。
4.随访、评估:随访及事件发生时间均从放疗第1天开始计算。放疗中每周对患者进行1次不良反应评估,放疗后第1年每3个月1次,第2年每4个月1次,2年后每6个月1次随访。随访内容包括肿瘤情况和不良反应评估,使用CT扫描、根据实体瘤疗效评价标准(RECIST 1.1)评估患者疗效,采用常见不良反应事件评价标准(CTCAE 4.0)评估患者的急性及远期不良反应。
5.统计学处理:使用SPSS 21.0统计软件进行分析。光子和粒子放疗剂量的参数符合正态分布,数据用x ± s表示。组间比较使用配对t检验进行分析。P < 0.05为差异有统计学意义。使用Kaplan-Meier方法计算各生存率指标。
结果1.剂量对比:13例有可见肿瘤患者的剂量对比结果(表 2)显示,质子和碳离子计划能较光子计划显著降低胸腔各OAR的剂量,其中,肺(两肺-CTV)平均剂量、V5[接受了≥5 GyE剂量的体积百分比]和V20及食管平均剂量等仅约为光子计划剂量的45%~65%,脊髓最大剂量小于光子的25%;质子、碳离子计划的心脏平均剂量下降近40%;对于GTV/iGTV至少有1层与心脏同时出现在同一CT横截面上的亚组患者,数值下降更为明显;粒子放疗还可明显降低ID达50%以上。与光子计划比较,差异均有统计学意义(t质子=5.14~15.26,t碳离子=5.61~16.63,P<0.05)。
|
|
表 2 13例有可见肿瘤患者的光子、质子和碳离子计划参数比较(x ± s) Table 2 Comparisons of dosimetric parameters among photon, proton and carbon ion radiotherapy in 13 patients with gross tumors(x ± s) |
2.近期疗效:所有患者按计划完成治疗。至2019年5月31日末次随访,中位随访时间为19.0(2.4~42.9)个月。有可见肿瘤的13例患者中,肿块最大径中位数5.7(2.7~12.8)cm。伴有单纯红细胞再生障碍性贫血的患者,放疗后2个月疗效评价达完全缓解(complete response,CR),且贫血症状也完全缓解;放疗前仍有Ⅱ型重症肌无力(myasthenia gravis,MG)的患者至末次随访已无需用药物控制症状;发病时ⅣB型、放疗前症状已控制的MG患者,放疗期间及其后的随访中肌无力症状无显著加重。至末次随访,所有患者均未观察到局部复发。4例患者出现转移:1例Ⅲ期巨大胸腺不典型类癌患者(图 1),放疗前肿瘤横截面最大径>10 cm并与血管关系密切,手术风险大。经质子、碳离子混合射线放疗后肿瘤逐渐缩小,放疗后22.8个月出现单发胸膜转移和可疑单发骨转移,经针对胸膜转移灶的再程粒子放疗和奥曲肽内分泌治疗后疾病稳定,至末次随访时原发灶持续部分缓解42.9个月;1例Ⅳ期(就诊时有骶骨、耻骨转移)不典型类癌患者放疗后19.9个月出现颅底和骨转移,正在接受姑息放疗和内分泌治疗;1例B2型Ⅲ期胸腺瘤患者术前化疗2个疗程后肿瘤增大,在接受术后放疗后6.1个月出现双肺转移,挽救化疗后疾病稳定;第4例为ⅣB期(就诊时有纵隔淋巴结转移)B型胸腺瘤,在治疗后10.5个月出现放疗野外纵隔淋巴结和肝转移。1、1.5和2年局部控制率和总生存率均为100%,无疾病进展生存率和无远处转移生存率分别为86.2%、86.2%、64.6%和86.2%、86.2%、64.6%。另有1例患者在放疗开始后13.7个月发现经病理和免疫组织化学法确认的第二原发肺癌,使用靶向治疗联合免疫治疗后疾病获得良好控制。
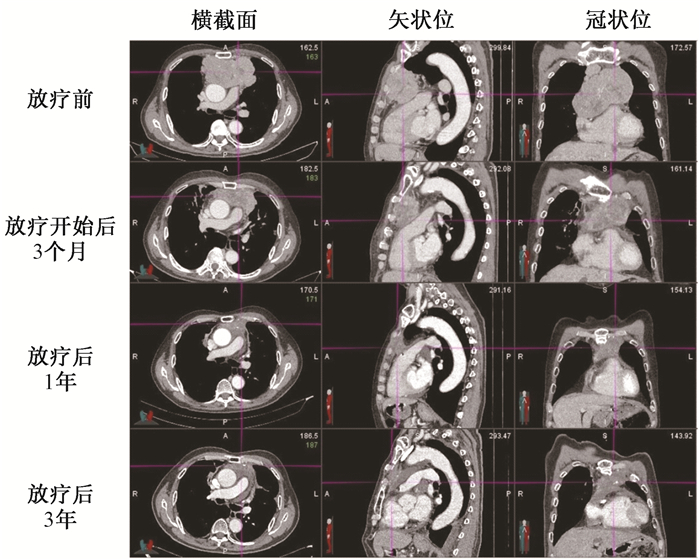
|
图 1 1例胸腺巨大不典型类癌患者CT图像 Figure 1 CT images of one patient with giant atypical thymic carcinoid |
3.不良反应:急性反应中未观察到≥3级者,所有1~2级反应除窦性心动过速外,经对症治疗后均在放疗结束后1个月内缓解。晚期反应中,除1例心肌梗死(晚期反应4级,放疗后27.8个月发生,接受冠状动脉支架置入术后恢复良好)可能与放疗相关外,未发现其他≥3级放疗相关不良反应;该患者与发生急性和晚期2级窦性心动过速者为同一人,接受美托洛尔治疗后窦性心动过速控制良好,见表 3。
|
|
表 3 13例有可见肿瘤患者粒子放疗不良反应 Table 3 Toxicities related to particle therapy |
讨论
胸腺恶性肿瘤早期多无任何症状,可伴有重症肌无力等多种免疫介导的副瘤综合征[6]。胸腺肿瘤生长缓慢,可侵犯胸腔内多个器官(如心包、大血管、肺等),甚至导致不能完整手术切除,最常见的转移形式是胸膜转移。放疗在胸腺肿瘤治疗中占重要地位,包括根治性放疗、辅助放疗和姑息放疗。然而,传统X射线等光子放疗会给胸腔内多个OAR,如心、肺、食管和脊髓等,带来放疗相关不良反应(包括肺炎、心包炎、心肌梗死等),影响患者生存质量甚至生命。
粒子射线相较于光子射线,具有物理剂量分布优势,在入射后的某个部位释放近乎全部能量,随后能量沉积迅速减少,形成布拉格峰,可更好保护正常组织,并有可能较光子放疗进一步提高肿瘤剂量以提高肿瘤局部控制。此外,碳离子射线属高线性能量传递射线,相比光子射线可在肿瘤细胞内产生更多较难修复的脱氧核糖核酸双链断裂,从而提高对光子射线不敏感的肿瘤细胞的杀伤率。
Parikh等[7]在4例术后辅助放疗的患者中进行质子和光子计划对比发现,质子显著降低了肺、食管和心脏的平均剂量(40%~74%),同样也降低了这3个器官受射线照射的百分比。Figura等[8]在单例患者中进行的剂量学对比研究也发现,质子计划可降低肺、心脏和食管平均剂量28%~55%,及靶区外胸腔组织59%的剂量。Haefner等[9]对接受术后放疗的10例胸腺瘤患者进行质子、碳离子与多种光子放疗技术的剂量学研究表明,肺、食管、双侧乳腺和心脏平均剂量及脊髓最大剂量的下降可达35%~70%,脊髓平均剂量更是下降达80%~90%;受照区域ID,相较于Tomo技术,质子和碳离子下降达57%和61%。本研究获得类似结果,碳离子计划和质子计划相似,心脏、肺和食管剂量较光子计划可下降约40%~55%,脊髓最大剂量下降>75%,剂量优势明显。
局部晚期和晚期胸腺恶性肿瘤多采用放化疗结合的综合治疗方式。Wang等[10]报道了光子单纯放疗、序贯放化疗和同步放化疗3种模式治疗42例Ⅲ期和Ⅳ期胸腺恶性肿瘤治疗效果,发现同步放化疗组客观缓解率和5年生存率最高,达87.5%和61.9%,与单纯放疗组的43.8%和30%相比,差异有统计学意义,3~4级中性粒细胞减少、食管炎和肺炎在同步组中分别为43.8%、25%和12.5%,在序贯组中分别为40%、30%和0%。Vogel等[4]使用质子射线治疗27例胸腺恶性肿瘤,中位随访时间2年,取得了2年局部控制率100%的良好结果,未发现≥3级的放疗相关不良反应;该研究中,85%的患者为胸腺瘤患者,且63%为接受了R0/R1手术、进行术后辅助放疗的患者。本研究中,近半数(9/19)的患者为胸腺癌或神经内分泌肿瘤患者,13/19例患者有可见肿瘤,近80%的患者为Ⅲ~Ⅳ期疾病,治疗难度更大,2年局部控制率和总生存率均为100%,3例伴副瘤综合征的患者症状明显缓解或稳定;急、慢性(晚期)不良反应中,仅1例≥3级(4级心肌梗死)反应可能与放疗相关,且与发生急、慢性2级窦性心动过速者为同一人,症状具延续性,发生心肌梗死是个体原因抑或和粒子放疗相关,有待更多病例的观察。总体来说,粒子放疗相关不良反应轻微,耐受性好。本组患者有4例在放疗后发生转移,其中2例为Ⅲ期B型胸腺瘤,是否需要在这类患者中增加化疗值得进一步研究。
在乳腺癌、淋巴瘤等治疗后生存期较长的肿瘤大宗病例研究中发现,后期心脏不良事件发生率随心脏平均剂量的增加而逐年增加[11];除甲状腺癌外,OARs受照剂量的增加与几乎所有晚期不良反应(包括第二原发恶性肿瘤secondary malignancy,SM)风险的升高相关[12-13];Vogel等[14]根据剂量学研究推断,如用质子代替光子进行胸腺瘤术后辅助放疗50.4 Gy,每100位患者中可避免5例射线诱导的SM的发生。本研究显示,粒子射线根治性放疗可降低心脏平均剂量约达8 GyE、几乎所有胸腔内OAR剂量和ID的下降均在40%以上,可大幅降低晚期反应如严重心脏不良反应和SM等的发生风险。生存期越长、上述晚期反应的发生率越高,因此降低OARs及全身剂量在胸腺肿瘤这类预期生存较长的肿瘤患者中意义更大。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)也明确提出对胸腺肿瘤应该采取更保守的OAR剂量限制,并尽可能采取低心脏剂量的放疗手段,质子、碳离子放疗不啻为较优选择。
目前,国际上鲜有关于质子、碳离子治疗胸腺恶性肿瘤的报道。剂量对比分析显示,碳离子射线和质子射线相仿,较光子射线明显降低正常组织受量,对这一预期生存较长的肿瘤而言,剂量优势明显;临床结果提示短期疗效好、不良反应较轻微。值得累积更多病例和开展进一步前瞻性临床研究。
志谢 感谢上海申康医院发展中心临床科技创新项目(SHDC12017114)、苏州大学放射医学与辐射防护国家重点实验室资助项目(GZK1201808)及上海市浦东新区科技发展基金民生科研(医疗卫生)项目(PKJ2017-Y52)对本研究的资助
利益冲突 无
作者贡献声明 陈剑负责临床患者随访和数据采集、文献查找和论文撰写;麻宁一负责临床患者随访和数据采集;卢艳、Kambiz Shahnazi和赵静芳负责放射治疗剂量分析和数据采集、分析;陆嘉德、蒋国梁指导论文写作,参与论文讨论及修改;茅静芳负责研究设计、规划和论文修改
| [1] |
de Jong WK, Blaauwgeers JL, Schaapveld M, et al. Thymic epithelial tumours:a population-based study of the incidence, diagnostic procedures and therapy[J]. Eur J Cancer, 2008, 44(1): 123-130. DOI:10.1016/j.ejca.2007.11.004 |
| [2] |
Pinelopi-Theopisti M, Aikaterini P, Ariadni K, et al. The place and the role of radiation therapy in the treatment of thymic carcinoma[J]. World J Oncol, 2016, 7(5-6): 95-97. DOI:10.14740/wjon972e |
| [3] |
Engels EA. Epidemiology of thymoma and associated malignancies[J]. J Thorac Oncol, 2010, 5: S260-265. DOI:10.1097/JTO.0b013e3181f1f62d |
| [4] |
Vogel J, Berman AT, Lin L, et al. Prospective study of proton beam radiation therapy for adjuvant and definitive treatment of thymoma and thymic carcinoma:Early response and toxicity assessment[J]. Radiother Oncol, 2016, 118(3): 504-509. DOI:10.1016/j.radonc.2016.02.003 |
| [5] |
陈剑, 茅静芳, 麻宁一, 等. 碳离子射线治疗10例气管腺样囊性癌的初步临床观察[J]. 中华放射肿瘤学杂志, 2019, 28(3): 168-172. Chen J, Mao JF, Ma NY, et al. Preliminary observation of carbon ion radiotherapy for tracheal adenoid cystic carcinoma[J]. Chin J Radiat Oncol, 2019, 28(3): 168-172. DOI:10.3760/cma.j.issn.1004-4221.2019.03.002 |
| [6] |
Scorsetti M, Leo F, Trama A, et al. Thymoma and thymic carcinomas[J]. Crit Rev Oncol Hematol, 2016, 99: 332-350. DOI:10.1016/j.critrevonc.2016.01.012 |
| [7] |
Parikh RR, Rhome R, Hug E, et al. Adjuvant proton beam therapy in the management of thymoma:a dosimetric comparison and acute toxicities[J]. Clin Lung Cancer, 2016, 17(5): 362-366. DOI:10.1016/j.cllc.2016.05.019 |
| [8] |
Figura N, Hoppe BS, Flampouri S, et al. Postoperative proton therapy in the management of stage Ⅲ thymoma[J]. J Thorac Oncol, 2013, 8(5): e38-40. DOI:10.1097/JTO.0b013e31827a8911 |
| [9] |
Haefner MF, Verma V, Bougatf N, et al. Dosimetric comparison of advanced radiotherapy approaches using photon techniques and particle therapy in the postoperative management of thymoma[J]. Acta Oncol, 2018, 57(12): 1713-1720. DOI:10.1080/0284186X.2018.1502467 |
| [10] |
Wang CL, Gao LT, Lv CX, et al. Outcome of nonsurgical treatment for locally advanced thymic tumors[J]. J Thorac Dis, 2016, 8(4): 705-710. DOI:10.21037/jtd.2016.01.79 |
| [11] |
Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer[J]. N Engl J Med, 2013, 368(11): 987-998. DOI:10.1056/NEJMoa1209825 |
| [12] |
Tseng YD, Cutter DJ, Plastaras JP, et al. Evidence-based review on the use of proton therapy in lymphoma from the Particle Therapy Cooperative Group (PTCOG) Lymphoma Subcommittee[J]. Int J Radiat Oncol Biol Phys, 2017, 99(4): 825-842. DOI:10.1016/j.ijrobp.2017.05.004 |
| [13] |
Inskip PD, Sigurdson AJ, Veiga L, et al. Radiation-related new primary solid cancers in the childhood cancer survivor study:comparative radiation dose response and modification of treatment effects[J]. Int J Radiat Oncol Biol Phys, 2016, 94(4): 800-807. DOI:10.1016/j.ijrobp.2015.11.046 |
| [14] |
Vogel J, Lin L, Litzky LA, et al. Predicted rate of secondary malignancies following adjuvant proton versus photon radiation therapy for thymoma[J]. Int J Radiat Oncol Biol Phys, 2017, 99(2): 427-433. DOI:10.1016/j.ijrobp.2017.04.022 |
 2020, Vol. 40
2020, Vol. 40


