2. 德国亥姆霍兹慕尼黑研究中心-德国环境健康研究中心放射医学所, 纽贺堡 185764
2. Institute of Radiation Medicine, Helmholtz Zentrum München-German Research Center for Environmental Health(GmbH), Ingolstädter Landstr. Neuherberg 185764, Germany
放疗传统手动计划优化的试错过程存在效率低下、质量不一致等问题。放疗计划自动设计不仅可以提高效率[1-2],还可以减小人为因素导致的质量波动[3-5],从而为临床带来便捷并使患者获益。RapidPlan (Varian Medical Systems,Palo Alto,CA,美国瓦里安公司)作为一款集成于Eclipse放疗计划系统的商用自动优化模块,其在各部位肿瘤的应用效果与人工计划类似或更优[6-10],具有良好的应用前景。
现有关于RapidPlan的文献报道大都涉及新建剂量体积直方图(DVH)预测模型,但基于历史计划训练和验证模型需要对优化参数生成规则反复试错,过程繁琐复杂、费时费力[6-7, 11-12],一定程度上阻碍了该技术的临床推广。尤其对于技术团队与病例资源相对缺乏的基层医院,建立自己的模型难度更大,但这样的医院却更需要通过该技术带来计划效率、质量、一致性的提升。共享已有RapidPlan模型逐渐成为临床趋势,但模型改造和验证方法、改造前后模型的应用效果等少见文献报道。
Eclipse内置的数个RapidPlan商用模型中,亨利福特医院健康系统肺癌立体定向放疗(Lung SBRT,Henry Ford Health System)模型(以下简称HFHS模型)是美国亨利福特医院利用本地病例和实践经验建立的单靶区、单剂量肺癌立体定向放疗模型。应用此类模型面临的主要挑战包括:按照说明书要求,此类模型必须基于本地病例验证并符合本院标准才可用于临床。但由于存在体型[13]、临床证据指南和人群差异等,可能导致基于某地区患者数据建立的模型在处方剂量、危及器官限值等方面与本地患者存在不同,导致模型无法直接应用。此外已有模型不包含训练集原始计划数据,导致模型无法被编辑或进一步优化以适应本地临床实践和实际需求特点。
本研究探索了利用本单位患者计划和临床标准改造HFHS Lung SBRT商用模型的可行性,并对改造前后两个模型的优化效果进行独立验证和比较,为共享已有RapidPlan模型探索方法和积累经验。
材料与方法1. HFHS Lung SBRT模型:本工作基于Eclipse15.5.12系统中的HFHS模型进行本地化改造和验证测试。该模型训练集计划来自美国亨利福特医院健康系统(H F H S),全部为中央型或周围型早期肺癌[14]病例,使用容积调强放疗(volume modulated intensity radiotherapy, VMAT)或固定野调强(intensity-modulated radiation therapy, IMRT)完成立体定向放疗(stereotactic body radiation therapy, SBRT)计划设计,设计标准参考RTOG0915要求[14]。模型靶区结构仅有计划靶区体积(PTV),处方为36 Gy/3次或48 Gy/4次。可预测剂量体积直方图(DVH)的危及器官为食管、心脏、肋骨、脊髓、肺-PTV等。
2.改造后的本地模型(Mlocal):本单位采用SBRT治疗的中央型或周围型[14]早期肺癌患者全部使用VMAT技术,靶区结构包括内在肿瘤靶区体积(IGTV)[15](4D CT最大密度投影图下肿瘤原发灶范围)和PTV(IGTV外扩0.5 cm)[14]。在保留原HFHS模型绝大部分优化参数生成条件等基础上,结合本单位实际情况做出如下适应性改造:①增加靶区结构IGTV、危及器官结构肺,并设置相应参数。②根据文献[16]提示靶区内高剂量有利于控制耐辐射乏氧细胞,以及欧洲癌症研究和治疗组织(EORTC)221133-08113 LungTech推荐靶区高剂量为处方剂量的110%~130%[17],Mlocal模型的优化目标为靶区高剂量为处方剂量的120%~130%,因此,将上限(Upper)剂量值由109%调整至125%。③使用本单位73例历史同步推量计划替换原训练集(表 1)。IGTV处方为100%体积满足50~60 Gy/4~8次(周围型肺癌)或60~64 Gy/8次(中央型肺癌),对应PTV处方剂量为95%体积满足40~56 Gy/4~8次或60 Gy/8次[17]。模型参数具体变化情况:PTV Upper剂量值由109%改为125%;IGTV增加两个下限(Lower)参数,它们分别对应的体积、剂量、权重为:100%、103%、100和98%、100%、100;增加结构肺的4个参数,它们分别对应的参数类型、体积、剂量、权重为:Upper、模型自动生成(Generated, G)、20 Gy、G,Upper、G、5 Gy、G,平均值(Mean)、无、G、G,以及目标(Line)、G、G、G。其中Line参数在Eclipse 15.5.12之后的版本有分类变化:靶区优先(target preferring),与旧版本Line参数一致,即靶区与危及器官重叠时优先满足靶区,或危及器官(OAR preferring)优先,即靶区与危及器官重叠时优先满足危及器官。Mlocal模型的Line参数均为靶区优先,从而与HFHS模型一致。Mlocal模型可预测食管、心脏、肋骨、脊髓、肺、气管、大血管等危及器官。对初步训练的Mlocal模型进行模型分析(Model Analytics)软件辅助的统计学确认,以妥善处置离群值等问题[18]。
|
|
表 1 Mlocal模型不同计划肿瘤位置与体积大小 Table 1 Targets′ location and volume size of Mlocal model differentsets of cases |
3.模型独立验证:如表 1所示,选取10例肺癌患者IGTV处方为100%体积55~60 Gy/5~8次(3例周围型)与60 Gy/8次(7例中央型),对应PTV处方分别为95%体积48~50 Gy/5~8次与60 Gy/8次[17]的未参与建模的肺癌SBRT病例,用于验证和比较模型改造前后在相同射野设置、光子能量、优化和剂量算法、计算网格等设置下的优化结果。在应用原HFHS模型时,将验证病例PTV与模型的PTV进行匹配以保证最低处方覆盖要求;应用改造后的Mlocal模型时,则直接按靶区结构名称对应匹配。整个优化过程避免任何人工干预。
4.剂量学参数比较:将两个模型优化的结果均按照临床要求归一至PTV和IGTV同时满足各自的处方要求。比较以下剂量学参数:①靶区:适形指数(conformity index, CI)(V100%RX /VPTV),CI>1表示处方剂量包绕体积包含靶区,CI < 1表示处方剂量体积位于靶区内部,该数值偏离1的程度代表两者不适形的程度[19]。②危及器官:Vx Gy, 即最小接受剂量为xGy的体积; Dxcm3, xcm3体积接受的最小剂量; Dmean, 平均剂量; Dmax, 最大剂量。结合临床经验,各剂量学参数限值根据中央型肺癌与周围型肺癌辨别标准[14]制定,近端支气管树2 cm以内的器官参考EORTC 221133-08113 LungTech[17],近端支气管树2 cm以外的器官参考RTOG 0915[14]。
5.统计学处理:鉴于SBRT计划分次不同导致处方剂量不尽相同的特点,本工作以相对剂量方式导出DVH数据以便于比较,其中所有OAR以IGTV的处方剂量为参照,PTV则以自身处方剂量为参照。利用自编Python程序提取并计算平均DVH数据,并利用画图软件SigmaPlot绘制平均DVH。利用SPSS24.0统计软件对两种计划的剂量学参数进行Wilcoxon符号秩和检验,P < 0.05为差异有统计学意义。
结果1. DVH图比较:10例验证计划分别应用HFHS与Mlocal模型进行RapidPlan优化的结果分别以HFHS_P和Mlocal_P表示,见图 1。两者靶区均满足各自处方剂量覆盖要求,但Mlocal_P的剂量分布更符合本单位临床实践和医生要求。
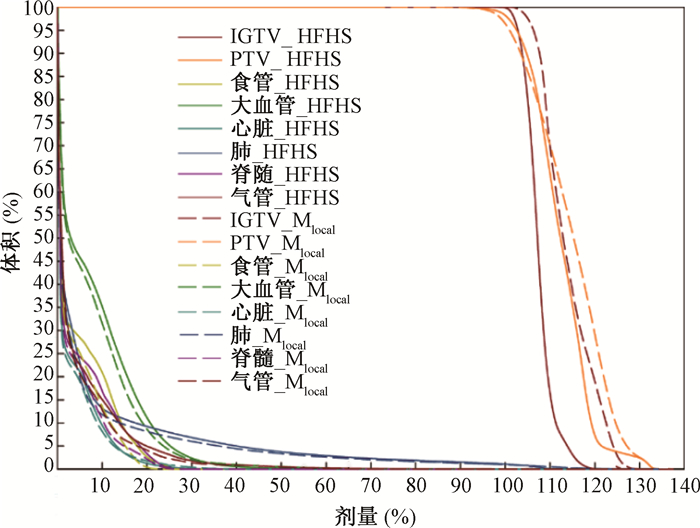
|
注:PTV.计划靶区体积;IGTV.内在肿瘤体积;Mlocal.本地模型;HFHS.亨利福特医院健康系统; 图 1 10例肺癌患者验证计划应用HFHS模型与改造后的M(local)模型分别优化的平均剂量体积直方图 Figure 1 Average DVHs of 10 validation plans optimized by HFHS model and Mlocalmodel |
2.靶区和危及器官剂量学参数比较:结合EORTC221133-08113 LungTech[17]、RTOG 0915[14]与本单位的危及器官剂量限值要求对两种模型自动优化结果的靶区与危及器官的剂量学参数进行统计分析。如表 2所示,在靶区剂量覆盖都满足要求的情况下,Mlocal_P的PTV_CI平均值明显小于HFHS_P(Z=-2.497, P < 0.05), 且前者的标准差更小;前者有两个临床未通过例数,分别为1.31和1.30,后者有6个未通过例数,分别为1.28, 1.30, 1.52, 1.24, 1.74和1.28。肺的V5 Gy、V10 Gy、V20 Gy和D1 000 cm3,Mlocal_P明显均低于HFHS_P(Z=-2.803, -2.803, -2.803, -2.201, P < 0.05);肺的D1 500 cm3, Mlocal_P低于HFHS_P, 但差异无统计学意义(P>0.05); HFHS_P的肺_V20 Gy有1个未通过例数为10.99%。脊髓的Dmax、D0.35 cm3、D1.2 cm3,Mlocal_P均明显低于HFHS_P(Z=-1.988, -2.040, -2.803, P < 0.05); HFHS_P的D1.2 cm3有1个未通过例数为13.62 Gy。
|
|
表 2 10例肺SBRT验证两种模型计划靶区及危及器官各剂量学参数平均值比较(%,x ± s) Table 2 Comparison of average dosimetric parameters for target volumes and OARs for 10 validation plans(%, x ± s) |
讨论
改造后的Mlocal模型增加了本单位需要的靶区结构、处方水平和危及器官剂量限值,除原HFHS模型可预测的危及器官外,还增加了肺、气管及大血管等DVH的预测能力。这些改进使得Mlocal模型更贴合本单位的临床要求,进一步提高其可用性。值得注意的是,无论使用IMRT和VMAT混合计划训练的HFHS模型,还是仅使用VMAT计划训练的Mlocal模型,都能够成功应用于VMAT验证计划,与文献报道的RapidPlan对于治疗技术的兼容性一致[20]。
本研究结果显示,PTV平均DVH表现出改造后模型在“肩部”较原模型更低,系HFHS模型优化后平均DVH归一时为满足IGTV剂量导致PTV剂量同时增加所致;在PTVDVH的“尾部”及IGTVDVH的“肩部”及“尾部”表现出Mlocal_P较高,而HFHS_P最大剂量不超过120%,表明Mlocal模型更符合本单位对靶区剂量高量的临床需求。
本研究结果显示,模型改造前后IGTV和PTV均满足上文提到的处方覆盖率要求,在此前提下,Mlocal_P PTV的平均CI值(1.07±0.13)显著小于HFHS_P(1.25±0.24),且前者标准差更小,表明Mlocal计划的适形性和一致性均好于HFHS计划,有利于危及器官保护;依照临床要求标准,除心脏_D15 cm3、心脏_Dmax外,Mlocal_P绝大部分危及器官剂量学参数均表现更优,与本研究结果危及器官平均DVH总体趋势一致,且Mlocal_P大部分剂量学参数的标准差小于HFHS_P,表明改造后模型优化结果的一致性更好。对于参数心脏_D15 cm3和心脏_Dmax,虽然HFHS_P略优于Mlocal_P,但差异不超过3.06%。总体表现为改造后模型在靶区适形性与危及器官保护方面更优,也更符合本单位临床要求。
HFHS_P不满足临床要求的剂量学参数较多,分别表现在PTV_CI、肺_V20 Gy,脊髓_D1.2 cm3,但大部分不合格参数值接近可接受标准。值得注意的是,HFHS_P有两例PTV_CI值达到1.52与1.74,远超临床可接受范围,进一步提示了改造前模型的局限性和本地化改造的必要性。
本研究表明,Eclipse内置HFHS Lung SBRT模型具有本地化改造的可行性,且改造后模型更符合实际临床需求。本工作的局限在于只测试了一个商用模型,但其过程可为改造和验证其他RapidPlan商业模型或共享外单位已有成熟模型提供方法借鉴。相比新建模型,改造和共享RapidPlan模型可以用更低的人力和时间成本获得计划效率、质量和一致性的提升。
综上所述,相较于原HFHS模型,改造后Mlocal模型的优化结果不但在靶区适形性、剂量高量等方面更满足本单位临床要求,而且在危及器官保护和结果一致性等方面也表现更优。本研究初步证明了对RapidPlan商用模型进行本地化改造的可行性,有利于基层医院借鉴此方法,以更低实践成本和技术门槛,通过共享改造RapidPlan模型,在满足本地需求的同时,提高临床效率、计划质量和一致性。
致谢 本研究得到了中央高校基本科研业务费/北京大学临床医学+X青年专项(PKU2020LCXQ019)的资助
利益冲突 本研究得到了美国瓦里安科研基金(Strategies for RapidPlan Model Adaptation)
作者贡献声明 王海洋进行实验、收集分析数据与论文撰写;吴昊提供实验平台与实验指导;项小羽协助实验与数据收集;黄宇亮、李晨光协助数据处理;胡俏俏、杜伊筱、弓健、李玮博协助数据收集;张艺宝指导方法建立、研究过程和论文修改
| [1] |
Chanyavanich V, Das S K, Lee W R, et al. Knowledge-based IMRT treatment planning for prostate cancer[J]. Med Phys, 2011, 38(5): 2515-2522. DOI:10.1118/1.3574874 |
| [2] |
Yang Y, Ford EC, Wu B, et al. An overlap-volume-histogram based method for rectal dose prediction and automated treatment planning in the external beam prostate radiotherapy following hydrogel injection[J]. Med Phys, 2013, 40(1): 011709. DOI:10.1118/1.4769424 |
| [3] |
Good D, Lo J, Lee W R, et al. A knowledge-based approach to improving and homogenizing intensity modulated radiation therapy planning quality among treatment centers:an example application to prostate cancer planning[J]. Int J Radiat Oncol Biol Phys, 2013, 87(1): 176-181. DOI:10.1016/j.ijrobp.2013.03.015 |
| [4] |
Zhu X, Ge Y, Li T, et al. A planning quality evaluation tool for prostate adaptive IMRT based on machine learning[J]. Med Phys, 2011, 38(2): 719-726. DOI:10.1118/1.3539749 |
| [5] |
Wu B, Pang D, Simari P, et al. Using overlap volume histogram and IMRT plan data to guide and automate VMAT planning:a head-and-neck case study[J]. Med Phys, 2013, 40(2): 021714. DOI:10.1118/1.4788671 |
| [6] |
Tol JP, Delaney AR, Dahele M, et al. Evaluation of aknowledge-based planning solution for head and neck cancer[J]. Int J Radiat Oncol Biol Phys, 2015, 91(3): 612-620. DOI:10.1016/j.ijrobp.2014.11.014 |
| [7] |
Fogliata A, Belosi F, Clivio A, et al. On the pre-clinical validation of a commercial model-based optimisation engine:application to volumetric modulated arc therapy for patients with lung orprostate cancer[J]. Radiother Oncol, 2014, 113(3): 385-391. DOI:10.1016/j.radonc.2014.11.009 |
| [8] |
Fogliata A, Nicolini G, Clivio A, et al. A broad scope knowledge based model for optimization of VMAT in esophageal cancer:validation and assessment of plan quality among different treatment centers[J]. Radiat Oncol, 2015, 10(1): 220. DOI:10.1186/s13014-015-0530-5 |
| [9] |
Fogliata A, Wang P M, Belosi F, et al. Assessment of a model based optimization engine for volumetric modulated arc therapy for patients with advanced hepatocellular cancer[J]. Radiat Oncol, 2014, 9(1): 236-249. DOI:10.1186/s13014-014-0236-0 |
| [10] |
Nwankwo O, Mekdash H, Sihono DSK, et al. Knowledge-based radiation therapy (KBRT) treatment planning versus planning by experts:validation of a KBRT algorithm for prostate cancer treatment planning[J]. Radiat Oncol, 2015, 10(1): 111. DOI:10.1186/s13014-015-0416-6 |
| [11] |
Hussein M, South CP, Barry MA, et al. Clinical validation and benchmarking of knowledge-based IMRT and VMAT treatment planning in pelvic anatomy[J]. Radiother Oncol, 2016, 120(3): 473-479. DOI:10.1016/j.radonc.2016.06.022 |
| [12] |
Varian Medical Systems. DVH estimation models for RapidPlan//Eclipse photon and electron instructions for use[Z].Palo Alto CA: Varan, 2014: 183-204.
|
| [13] |
Yates A, Edman J, Aruguete M. Ethnic differences in BMI and body/self-dissatisfaction among Whites, Asian subgroups, Pacific Islanders, and African-Americans[J]. J Adolesc Health, 2004, 34(4): 300-307. DOI:10.1016/j.jadohealth.2003.07.014 |
| [14] |
Videtic G M, Hu C, Singh A K, et al. A randomized phase 2 study comparing 2 stereotactic body radiation therapy schedules for medically inoperable patients with stage I peripheral non-small cell lung cancer:NRG Oncology RTOG 0915(NCCTG N0927)[J]. Int J Radiat Oncol Biol Phys, 2015, 93(4): 757-764. DOI:10.1016/j.ijrobp.2015.07.2260 |
| [15] |
朱广迎, 石安辉, 吴昊, 等. 肺癌调强放疗中靶区规划新概念——IGTV和ICTV[J]. 中华放射肿瘤学杂志, 2006, 15(1): 72-72. Zhu GY, Shi AH, Wu H, et al. IGTV and ICTV are new concepts in target planning of intensity modulated radiotherapy for lung cancer[J]. Chin J Radiat Oncol, 2006, 15(1): 72-72. DOI:10.3760/j.issn.1004-4221.2006.01.023 |
| [16] |
Fowler JF, Tomé WA, Fenwick JD, et al. A challenge to traditional radiation oncology[J]. Int J Radiat Oncol Biol Phys, 2004, 60(4): 1241-1256. DOI:10.1016/j.ijrobp.2004.07.691 |
| [17] |
Adebahr S, Collette S, Shash E, et al. Lung Tech, an EORTC Phase II trial of stereotactic body radiotherapy for centrally located lung tumours:a clinical perspective[J]. Br J Radiol, 2015, 88(1051): 20150036. DOI:10.1259/bjr.20150036 |
| [18] |
王美娇, 李莎, 岳海振, 等. Model Analytics辅助的智能放疗计划建模[J]. 中国医学物理学杂志, 2017, 34(9): 870-873. Wang MJ, Li S, Yue HZ, et al. Modeling for knowledge-based plan assisted with model analytics[J]. Chin J Med Phys, 2017, 34(9): 870-873. DOI:10.3969/j.issn.1005-202X.2017.09.002 |
| [19] |
Shaw E, Kline R, Gillin M, et al. Radiation Therapy Oncology Group:radiosurgery quality assurance guidelines[J]. Int J Radiat Oncol Biol Phys, 1993, 27(5): 1231-1239. DOI:10.1016/0360-3016(93)90548-a |
| [20] |
Wu H, Jiang F, Yue H, et al. Applying a RapidPlan model trained on a technique and orientation to another:a feasibility and dosimetric evaluation[J]. Radiat Oncol, 2016, 11(1): 108. DOI:10.1186/s13014-016-0684-9 |
 2020, Vol. 40
2020, Vol. 40


