2. 石家庄市第三医院肾内科, 050011
2. Department of Nephrology, Third hospital of Shijiazhuang, Shijiazhuang 050011, China
机体在肿瘤发生后便启动一系列针对肿瘤抗原的免疫应答,包括体液免疫和细胞免疫,其中细胞免疫是抗肿瘤免疫的主力,而体液免疫发挥协同作用。细胞免疫中的T细胞亚群及自然杀伤(NK)细胞在抗肿瘤免疫中起主导作用[1-2]。临床上检测肿瘤患者的免疫功能主要是检测T淋巴细胞及其亚群,包括CD3、CD4、CD8的百分比及CD4/CD8,其中CD4/CD8是反应机体的免疫状况的重要指标。另外,NK细胞(CD56)主要介导非特异性免疫,作为机体的第一道防线清除癌变细胞,在机体抗肿瘤免疫中发挥重要作用[3]。研究表明肿瘤相关炎证细胞为肿瘤微环境的重要组成部分,与肿瘤细胞的增殖、侵袭及转移密切相关,可影响肿瘤患者的预后[4]。近年来,相关研究报道了外周血炎症标记物如中性粒细胞淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)与多种恶性肿瘤预后相关[5-7]。相对于单一指标,NLR为外周血两两指标比值,更具稳定性,可作为提示恶性肿瘤预后的生物标记物。临床中发现化疗对外周血中性粒细胞、淋巴细胞等影响明显,同时研究证实T分期、N分期及TNM分期为食管癌预后的重要影响因素[8]。因此,为减少分析偏倚,本研究在设计时去除了这些因素,对84例临床分期为Ⅲ期的食管癌患者放疗前后免疫功能指标及外周血炎症指标NLR的变化及预后相关因素进行分析。
资料与方法1.临床资料:回顾性分析2010年5月至2012年4月于河北医科大学第四医院接受根治性放疗的食管鳞癌患者84例,临床分期为Ⅲ期(T4N1M0)(按照2009年全国非手术治疗食管癌临床分期标准草案进行分期)。其中食管胸上段癌10例,胸中段癌50例,胸下段癌24例;女性27例,男性57例;中位年龄65岁(40~86岁)。
2.入组标准:①经病理学证实的首程治疗食管鳞癌患者。②肿瘤临床分期为Ⅲ期(T4N1M0)。③患者卡氏(KPS)评分≥80分,能进流食或半流食。④放疗前未接受对免疫功能有确切影响的治疗。⑤按期完成放疗,放疗期间均未接受同期化疗。
3.放疗靶区及计划:根据CT图像结合X射线钡餐造影、纤维食管镜检查勾画食管肿瘤靶区(GTV),其标准为食管壁厚度>0.5 cm或不含气管腔直径>1.0 cm;临床靶区(CTV)为GTV上下外扩1.5~2.0 cm,轴向外扩0.5~1.0 cm;计划靶区(PTV)为CTV外扩0.5~0.8 cm范围。纵隔转移淋巴结(GTV-nd)的勾画标准为淋巴结短径≥1.0 cm,食管旁、气管食管旁沟、心膈角、腹腔淋巴结的勾画标准为长径≥0.5 cm。转移淋巴结PTV-nd为GTV-nd均匀外扩1.0 cm。全组PTV/PTV-nd处方剂量56~66 Gy,中位剂量60 Gy,1次/d,5次/周。
4.化疗:根据患者一般状况及个人意愿决定是否化疗。化疗均采用放疗后序贯化疗,化疗于放疗后3~4周进行,中位化疗疗程4个周期(1~8个周期)。化疗方案:LFP方案(亚叶酸钙200 mg/次+替加氟1.0 g/次+顺铂20 mg/次,d1~5),或TP方案(紫杉醇135 mg/m2 +顺铂75 mg/m2,d1)。入组患者中接受序贯化疗者31例,未接受化疗者53例。
5.血液采集及免疫功能测定:患者于放疗前及放疗结束1周内各采取外周静脉血1次,测定患者免疫功能及血常规指标。取CD4-FITC/CD8-PE抗体和CD3-FITC/CD56-PE抗体各10 μl分别加入到100 μl抗凝静脉血中,室温下避光放置30 min,裂解红细胞后用Epics-XL-Ⅱ型流式细胞仪(美国贝克曼库尔特公司)分析CD4、CD8、CD3、CD56占淋巴细胞的百分比。根据血常规结果计算患者放疗前后的NLR。根据患者放疗前NLR中位数2.33分为NLR≤2.33组和>2.33组;放疗后NLR中位数5.75分为NLR≤5.75组和>5.75组。统计分析各组患者的近期疗效、生存预后及不良反应。
6.不良反应、近期疗效及随访:依据美国肿瘤放射治疗协作组织(RTOG)急性放射损伤分级标准,进行不良反应评价。评价时间为放疗开始至放疗结束后3个月内。放射治疗结束及结束后1个月分别复查胸和上腹部CT及上消化道造影评价近期疗效,评价依据实体瘤疗效评价标准(RECIST) 1.1实体瘤疗效评价标准,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD),客观缓解率=CR率+PR率。放疗后前2年每3个月常规复查1次,2年后每6个月复查1次。随访以电话随访及门诊复查为主。
7.统计学处理:采用SPSS13.0统计软件进行数据处理,经正态性检验,符合正态分布,采用配对t检验分析放疗前后免疫指标变化,Kaplan-Meier法计算总生存率、无进展生存率及Logrank法行单因素预后分析,Cox回归模型多因素预后分析。logistic法行单因素及多因素分析评估免疫功能及外周血炎症指标与放疗近期疗效及不良反应间关系。P<0.05为差异有统计学意义。
结果1.放疗前后患者免疫功能指标的变化:全组患者CD3在放疗前后差异无统计学意义(P>0.05)。CD4、CD56、CD4/CD8放疗后较放疗前明显下降,而CD8明显上升,差异均有统计学意义(t=8.05、6.01、7.96、4.91,P < 0.05),见表 1。所有患者放疗前和放疗后的CD3分布情况差异无统计学意义(P>0.05),而放疗后CD4、CD4/CD8、CD56低于正常水平的人数较放疗前明显增多,其差异均有统计学意义(χ2=30.017、13.722、7.550,P < 0.05),见表 2。
|
|
表 1 84例临床Ⅲ期食管鳞癌患者放疗前后免疫功能指标变化(%,x ± s) Table 1 The changes of immunity index pre- and post-radiotherapy of 84 esophageal cancer patients with clinical stage Ⅲ (%, x ± s) |
|
|
表 2 84例临床Ⅲ期食管鳞癌患者放疗前后免疫功能指标低于正常范围情况 Table 2 The distribution of immunity index pre- and post-radiotherapy of 84 esophageal cancer patients with clinical stage Ⅲ |
2.生存状况:全组患者随访至2017年6月31日,随访率100%。全组患者1年、3年、5年总生存率分别为78.57%、34.52%、19.59%,中位总生存时间(OS)22.60个月;1年、3年、5年无进展生存率分别为69.05%、27.38%、12.09%,中位无进展生存时间(PFS)21.20个月。
3.放疗前后免疫功能指标与年龄的关系:以中位年龄65岁将患者分为<65岁组(41例)和≥65岁组(43例)。这两个年龄组,免疫指标数值CD4、CD4/CD8、CD56放疗后较放疗前均明显下降,而CD8均明显上升,差异均有统计学意义(<65岁组:t=7.988、6.323、3.593、3.715,P<0.05;≥65岁组:t=4.010、5.034、4.867、3.258,P<0.05),CD3在放疗前后变化差异均无统计学意义(P>0.05)。进一步分层分析免疫指标低于正常范围的人数在不同年龄组及放疗前后的分布情况:放疗前<65岁组的CD4、CD4/CD8、CD56低于正常水平的人数为13、12、13例,明显少于放疗后37、25、24例(χ2=29.522、8.323、5.959,P < 0.05);≥65岁组的CD4、CD4/CD8低于正常水平的人数为28、17例,明显少于放疗后37、28例(χ2=5.103、5.640,P < 0.05),其余指标分布差异均无统计学意义(P>0.05)。放疗前≥65岁组的CD4低于正常水平的人数28例明显多于<65岁组的人数13例,差异有统计学意义(χ2=9.376,P < 0.05),放疗后≥65岁组的CD56低于正常水平的人数14例明显少于<65岁组的人数24例,差异有统计学意义(χ2=5.718,P < 0.05),其余指标分布差异均无统计学意义(P>0.05)。
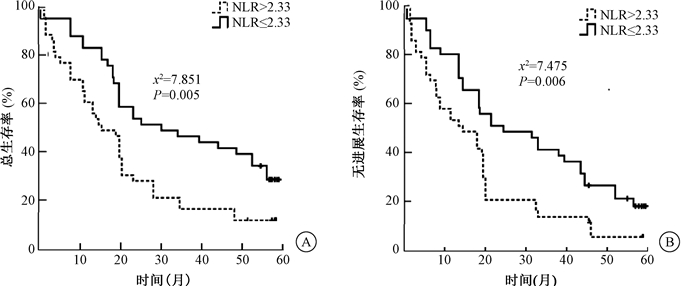
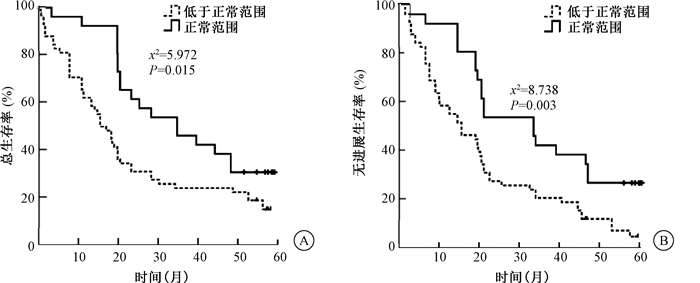
4.临床参数、放疗前后免疫功能指标及外周血炎症指标与预后关系:单因素预后分析显示,性别、年龄、肿瘤部位、放疗后是否化疗、放疗前CD3、CD4、CD4/CD8、CD56和放疗后CD56、NLR与患者的OS及PFS均无明显相关性(P>0.05)。放疗前NLR水平、免疫指标放疗后CD3、CD4和CD4/CD8水平均与OS预后显著相关(χ2=7.851、4.443、8.381、5.972,P < 0.05);放疗前NLR水平、免疫指标放疗后CD3、CD4和CD4/CD8水平均与PFS预后显著相关(χ2=7.475、6.290、9.659、8.738,P < 0.05),见表 3。放疗前NLR≤2.33组患者预后明显优于NLR>2.33组,放疗后免疫指标水平正常者预后明显优于水平低下者,见图 1、2。
|
|
表 3 84例临床Ⅲ期食管鳞癌患者的单因素预后分析 Table 3 The univariate analysis of 84 esophageal cancer patients at clinical stage Ⅲ |
|
注:NLR.中性粒细胞与淋巴细胞比值 图 1 84例临床Ⅲ期食管癌患者放疗前不同NLR分组的1年、3年、5年总生存时间(A)与无进展生存时间(B)曲线 Figure 1 The 1-, 3- and 5-year OS(A) and PFS(B) curves of 84 patients at clinical stage Ⅲ at different level of NLR pre-radiotherapy |
|
图 2 84例临床Ⅲ期食管癌患者放疗后不同CD4/CD8水平的1年、3年、5年总生存时间(A)与无进展生存时间(B)曲线 Figure 2 The 1-, 3- and 5-year OS(A) and PFS(B) curves of 84 patients at clinical stage Ⅲ at different levels of CD4/CD8 post-radiotherapy |
5.多因素预后分析显示:放疗前NLR水平、放疗后CD4、CD4/CD8水平为影响患者OS预后的独立影响因素(P < 0.05);放疗前NLR水平、放疗后CD4/CD8水平为影响患者PFS预后的独立影响因素(P < 0.05),放疗前NLR≤2.33和(或)免疫功能正常者预后较佳,见表 4。
|
|
表 4 84例临床Ⅲ期食管癌患免疫功能及外周血炎症指标与总生存及无进展生存时间关系的Cox回归分析 Table 4 The Cox regression analysis of the correlation between the immunity index and blood inflammatory markers and OS, PFS in 84 esophageal cancer patients at clinical stage Ⅲ |
6.放疗前后免疫功能指标及外周血炎症指标与近期疗效关系:所有患者近期疗效CR 11例,PR 41例,SD 24例,PD 8例,客观缓解率为61.90%(52/84),对免疫功能指标及外周血炎症指标与近期疗效相关性行单因素分析示放疗前NLR水平、放疗后CD4/CD8水平与患者近期疗效相关(χ2=6.158、5.656,P < 0.05),余指标与近期疗效未见明显相关性(P>0.05)。将单因素分析中P<0.1的指标纳入多因素分析,结果示放疗前NLR水平、放疗后CD4/CD8水平为影响患者近期疗效的独立相关因素(χ2=8.224、4.287,P < 0.05),放疗前NLR≤2.33及放疗后CD4/CD8正常水平组患者具有更好的近期疗效。
7.放疗前后免疫功能指标及外周血炎症指标与放疗不良反应的关系:全组患者急性放射性食管炎发生率为52.38%(44/84),1、2、3级分别为23例、18例、3例;急性放射性肺炎发生率为21.43%(18/84),其中1、2、3级分别为10例、6例、2例。≥2级急性放射性损伤的发生率为33.33%(28/84),其中≥2级急性放射性食管炎20例,≥2级急性放射性肺炎7例,同时合并者1例。对免疫功能及外周血炎症指标与≥2级急性放射性损伤发生的相关性行单因素分析示放疗后NLR>5.75组与放射性损伤的发生显著相关(χ2=3.925,P < 0.05),其余指标未见明显相关性(P>0.05)。
讨论癌症的发生不仅仅是基因突变导致机体正常细胞转变成癌细胞的过程, 而是在这些癌细胞成功逃脱了机体的免疫监视后逐步形成的[9]。有文献报道恶性肿瘤患者在接受治疗前免疫功能就已经处于抑制状态,且高龄肿瘤患者更加明显[2, 10-11]。本研究结果同样显示放疗前食管癌患者即在不同程度上处于免疫抑制状态,其中≥65岁患者免疫功能低下情况更加严重,可能是由于肿瘤细胞诱导抑制性细胞因子的产生,使机体免疫细胞的数量和功能异常,进而导致机体免疫功能处于抑制状态。在放疗实施过程中,放射线对免疫细胞的非特异性杀伤也可造成机体免疫功能的下降。本研究结果显示放疗后患者的免疫功能指标进一步明显下降,其原因可能为放射线杀死肿瘤细胞、降低瘤负荷的同时,对T淋巴细胞也有杀伤作用。放射治疗可减弱机体细胞膜功能,引起表面抗原大量丢失,进而导致机体免疫抑制加重,另外,肿瘤抗原因肿瘤细胞大量死亡而释放也可导致免疫抑制[12]。
食管癌患者的预后与免疫功能的关系报道不多且结论也不一致。Kuwana等[13]研究认为食管恶性肿瘤组织中CD8浸润密度增高者生存预后较好。而Vacchelli等[14]研究发现FOXP3+调节性T淋巴细胞的浸润密度和食管癌患者的临床疗效及生存预后明显相关,临床疗效越好,放化疗后残留肿瘤组织中FOXP3+调节性T淋巴细胞浸润密度越低。Menges等[15]报道恶性肿瘤患者预后与细胞免疫状态明显相关,机体免疫状态正常则提示好的生存预后,而体液免疫水平则与生存预后未见相关性。本研究对84例临床Ⅲ期的食管鳞癌患者的免疫指标进行生存预后分析,单因素预后分析显示放疗后CD3水平、CD4水平、CD4/CD8水平正常者较水平低下者预后佳,多因素生存预后分析显示放疗后CD4/CD8水平正常者较低下者预后好,均提示放疗后细胞免疫功能正常的食管癌患者预后较好。分析其原因可能由于放疗对食管癌患者的免疫功能存在着双重作用。一方面,放射线对机体免疫细胞的杀伤效应导致患者免疫抑制,另一方面,放射线大量杀伤肿瘤细胞而解除肿瘤细胞对机体的免疫抑制。若放疗后免疫功能正常,则放疗解除的免疫抑制超过或抵消放疗本身的免疫抑制,也从侧面反映出放疗的效果较佳,故提示较好的预后;反之若放疗导致的免疫抑制超出对机体免疫功能的改善,则预后较差。本研究同样显示放疗后CD4/CD8水平正常者较水平低下者具有更好的近期疗效,而近期疗效往往与良好预后相关。
近期有研究认为肿瘤微环境中的炎性因子可明显影响肿瘤的发生、发展及转归[4]。肿瘤微环境内的肿瘤坏死因子-α、白细胞介素-1、白细胞介素-6等炎性因子浓度明显升高,从而诱导外周血中性粒细胞计数及组成改变,尤其是肿瘤相关性中性粒细胞计数增加,抑制机体免疫反应,导致细胞免疫为主体的淋巴细胞计数减少,进而促进肿瘤细胞增殖,最终影响预后[16]。Koh等[6]通过分析1 435例乳腺癌患者接受治疗前的外周血NLR水平与预后的关系发现该两项指标为影响预后的独立因素,NLR指标较高水平组的患者预后较差。Suzuki等[17]的研究团队发现治疗前NLR处于高水平的广泛期小细胞肺癌患者预后较差。Duan等[18]通过研究371例可手术食管癌患者外周血NLR及相关临床病理因素与预后关系发现术前NLR低水平患者可获得更好生存预后。但Rashid等[19]通过分析294例可手术食管癌患者术前外周血NLR水平与相关临床病理因素及生存预后的关系,发现外周血NLR水平与总生存及无进展生存预后未见明显相关(P=0.49),分析其原因可能入组患者中腺癌占总人数81%,鳞癌17%,且未提供术后病理分期情况,这些因素均易造成统计学偏倚。本研究中入组临床Ⅲ期(T4N1M0)食管鳞癌患者,病理及分期特征相对单一,可减少统计分析中的混杂因素。本研究分析显示患者放疗前NLR≤2.33可获得更好的近期疗效及生存获益。既往大量研究已证实TNM分期为影响食管鳞癌患者的独立预后因素,但同一分期的患者也会出现不同的生存预后。由此,外周血NLR水平作为新的标志物可有效弥补TNM分期评测预后的不足。
在治疗不良反应方面,本研究因高龄患者比例较大且均接受根治性放疗,故放射性损伤发生率也相应增加,≥2级急性放射性损伤的发生率为33.33%。分析显示放疗后NLR处于高水平与放射性损伤显著相关。考虑可能放疗后NLR水平增高代表着机体肿瘤相关性中性粒细胞增多,抑制细胞免疫,导致淋巴细胞减少,进而抑制机体的放射性损伤修复[16]。因此,临床上改善患者的免疫状态可以一定程度上降低放射性损伤的发生。
综上,放射治疗是食管癌的主要治疗手段之一,其可影响食管癌患者的免疫功能。放疗前NLR水平、放疗后CD4/CD8水平在评估食管癌患者预后方面具有重要价值。而要得到令人信服的结论,仍需要前瞻性、多中心随机对照研究来证实。
利益冲突 无
作者贡献声明 宋春洋负责整理数据和统计分析,撰写论文;祝淑钗负责研究设计和论文修改;沈文斌协助修改论文;高丝娜、杜星语负责统计分析;赵彦、许金蕊负责收集整理病历资料
| [1] |
Vachani A, Moon E, Wakeam E, et al. Gene therapy for mesothelioma and lung cancer[J]. Am J Respir Cell Mol Biol, 2010, 42(4): 385-393. DOI:10.1165/rcmb.2010-0026RT |
| [2] |
Deepak P, Acharya A. Anti-tumor immunity and mechanism of immunosuppression mediated by tumor cells:role of tumor-derived soluble factors and cytokines[J]. Int Rev Immunol, 2010, 29(4): 421-458. DOI:10.3109/08830185.2010.483027 |
| [3] |
Caligiuri MA. Human natural killer cells[J]. Blood, 2008, 112(3): 461-469. DOI:10.1182/blood-2007-09-077438 |
| [4] |
Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [5] |
Yodying H, Matsuda A, Miyashita M, et al. Prognostic significance of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio in oncologic outcomes of esophageal cancer:a systematic review and meta-analysis[J]. Ann Surg Oncol, 2016, 23(2): 646-654. DOI:10.1245/s10434-015-4869-5 |
| [6] |
Koh CH, Bhoo-Pathy N, Ng KL, et al. Utility of pre-treatment neutrophil-lymphocyte ratio and platelet-lymphocyte ratio as prognostic factors in breast cancer[J]. Br J Cancer, 2015, 113(1): 150-158. DOI:10.1038/bjc.2015.183 |
| [7] |
Cannon NA, Meyer J, Iyengar P, et al. Neutrophil-lymphocyte andplatelet-lymphocyte ratios as prognostic factors after stereotactic radiation therapy for early-stage non-small-cell lung cancer[J]. J Thorac Oncol, 2015, 10(2): 280-285. DOI:10.1097/JTO.0000000000000399 |
| [8] |
宋春洋, 李腾, 赵彦, 等. ⅡB~Ⅲ期食管癌根治术后预防性放疗疗效分析[J]. 肿瘤防治研究, 2018, 45(6): 404-409. Song CY, Li T, Zhao Y, et al. Prognosis of stage ⅡB-Ⅲ thoracic esophageal carcinoma patients treated with prophylactic after radical esophagectomy[J]. Cancer Res Prev Treat, 2018, 45(6): 404-409. DOI:10.3971/j.issn.1000-8578.2018.17.1207 |
| [9] |
Ward PS, Thompson CB. Metabolic reprogramming:acancer hallmark even Warburg did not anticipate[J]. Cancercell, 2012, 21(3): 297-308. DOI:10.1016/j.ccr.2012.02.014 |
| [10] |
Tisch M, Heimlich F, Daniel V, et al. Cellular immune defect caused by postsurgical radiation therapy in patients with head and neck cancer[J]. Otolaryngol Head Neck Surg, 1998, 119(4): 412-417. DOI:10.1016/S0194-5998(98)70092-0 |
| [11] |
魏熙胤, 张翠翠, 臧凤琳, 等. 肺癌患者外周血淋巴细胞亚群与预后的关系[J]. 中国肿瘤临床, 2015, 41(6): 390-393. Wei XY, Zhang CC, Zang FL, et al. The correlation of peripheral blood lymphocyte subsets with prognosis in lung cancer patients[J]. Chin J Clin Oncol, 2015, 41(6): 390-393. DOI:10.3969/j.issn.1000-8179.20131278 |
| [12] |
Nowak AK, Robinson BW, Lake RA. Synergy between chemotherapy and immunotherapy in the treatment of established murine solid tumors[J]. Cancer Res, 2003, 63(15): 4490-4496. DOI:10.1097/00002820-200308000-00012 |
| [13] |
Kuwana T, Mackey MR, Perkins G, et al. Bid, Bax, and lipids cooperate to form supramolecular openings in the outer mitochondrial membrane[J]. Cell, 2002, 111(3): 331-342. DOI:10.1016/s0092-8674(02)01036-x |
| [14] |
Vacchelli E, Semeraro M, Enot D, et al. Negative prognostic impact of regulatory T cell infiltration insurgically resected esophageal cancer post-radiochemotherapy[J]. Oncotarget, 2015, 6(25): 20840-20850. DOI:10.18632/oncotarget.4428 |
| [15] |
Menges T, Engel J, Welters I, et al. Changes in blood lymphocyte populations after multiple trauma:association with post traumatic complications[J]. Crit Care Med, 1999, 27(4): 733-740. DOI:10.1097/00003246-199904000-00026 |
| [16] |
Nowarski R, Gagliani N, Huber S, et al. Innate immune cells in inflammation and cancer[J]. Cancer Immunol Res, 2013, 1(2): 77-84. DOI:10.1158/2326-6066.CIR-13-0081 |
| [17] |
Suzuki R, Lin SH, Wei X, et al. Prognostic significance of pretreatment total lymphocytecount and neutrophil-to-lymphocyte ratio in extensive-stage small-cell lung cancer[J]. Radiother Oncol, 2018, 126(3): 499-505. DOI:10.1016/j.radonc.2017.12.030 |
| [18] |
Duan H, Zhang X, Wang FX, et al. Prognostic role of neutrophil-lymphocyte ratio in operable esophageal squamous cell carcinoma[J]. World J Gastroenterol, 2015, 21(18): 5591-5597. DOI:10.3748/wjg.v21.i18.5591 |
| [19] |
Rashid F, Waraich N, Bhatti I, et al. A pre-operative elevated neutrophil:lymphocyte ratio does not predict survival from oesophagealcaneor resection[J]. World J Surg Oncol, 2010, 8(1): 1-10. DOI:10.1186/1477-7819-8-1 |
 2020, Vol. 40
2020, Vol. 40


