近年来,辐射旁效应(RIBE)和远端效应(RIAE)引起了人们的广泛兴趣[1-2]。研究表明,辐射诱导RIBE的信号因子主要通过细胞间隙连接、细胞介质等进程传播[3-4]。辐射旁效应细胞因子还可引起机体免疫反应,介导T细胞活化与抑制,活化抗原呈递细胞和自然杀伤(NK)细胞,诱发远端组织损伤[5]。随着放疗技术与免疫治疗的不断革新,电离辐射对免疫系统,尤其是对淋巴系统的影响也越来越受到关注[6]。
西咪替丁(CMTD)是一种临床治疗胃及十二指肠溃疡、上消化道出血等疾病的药物,是一种H2拮抗剂。近来,其抗辐射方面的作用正逐渐被大家认识,研究发现CMTD可使低剂量中子照射后的细胞微核率降低,延长致死剂量γ射线照射后小鼠的生存率,对大剂量X射线诱导的淋巴细胞微核发生和细胞凋亡有保护作用[7-8]。本研究探讨小鼠胸部照射后对未照射部位脾脏的损伤,并观察CMTD是否可以降低局部照射后小鼠未照射部位的损伤,为临床防治辐射远端损伤效应提供实验依据。
材料与方法1.动物分组与给药:选用C57BL/6雄性小鼠(上海市杰思捷实验动物有限公司,合格证号:2013001821869),体重(18 ± 2)g,6~8周龄,小鼠饲养于日夜交替采光、23℃恒温动物房中。共30只,随机单位组设计分为对照组、单纯照射组和照射给药组(CMTD,武汉东康源生物生产科技有限公司,100 mg/kg),每组10只。照后连续7 d给予照射给药组CMTD灌胃,对照组和单纯照射组给予生理盐水。最后一次照射后第7天,解剖小鼠进行后续检测。
2.动物照射:利用X射线辐照仪(X-RAD 320,美国PXI公司)对小鼠右胸进行分割照射,每天8 Gy,连续3 d,剂量率为0.883 Gy/min,照射野为1 cm×1 cm,源皮距(SSD)为60 cm;假照射处理为对照组。
3.小鼠体重:照射后,每天称量小鼠体重,并记录。
4.小鼠脏器指数:照射后第7天解剖小鼠,取出脾脏,计算脾脏指数(spleen index),脾脏指数=脾脏重量/体重。
5.T淋巴细胞亚群检测:采用小鼠淋巴细胞分离液(上海达科为生物技术有限公司)分离脾淋巴细胞[9]。加4 ml分离液至35 cm平皿中,在尼龙网上研磨脾脏,转移至新15 ml离心管,上层覆盖无血清培养基(美国Thermo Fisher公司),800×g离心30 min,取中间层的白色絮状物(即淋巴细胞层)至新的15 ml离心管;加5 ml RPMI 1640培养液(美国Thermo Fisher公司)于无血清离心管,颠倒混匀;250×g离心10 min,弃上清;加1 ml磷酸盐缓冲液(PBS)调细胞至1×107/ml;取100 μl加入单克隆抗体(美国BioLegend公司) 1 μl CD3+、0.5 μl CD4+、0.5 μl CD8+,荧光抗体进行细胞荧光染色40 min,设置单染对照管以及空白管;加入1.5 ml PBS缓冲液,振荡混匀悬浮细胞。380×g离心5 min,去上清液;加入1 ml PBS缓冲液,振荡悬浮细胞,流式细胞仪上机检测。
6.B淋巴细胞亚群检测:按上述方法获得淋巴细胞悬液,取100 μl加入单克隆抗体1 μl CD3+、1 μl CD19+(美国BioLegengd公司)荧光抗体进行细胞荧光染色40 min,设置单染对照管以及空白管;加入1.5 ml PBS缓冲液,振荡混匀悬浮细胞。380×g离心5 min,去上清液;加入1 ml PBS缓冲液,振荡悬浮细胞,流式上机检测。
7.NK淋巴细胞亚群检测:方法与B淋巴细胞亚群检测相同,单克隆抗体为1 μl CD3+、1 μl CD49+(美国BioLegengd公司)荧光抗体。
8.脾脏组织病理学检测:将脾脏立即固定于10%甲醛溶液(北京百奥森泰有限公司)中,固定后的组织经修块取材,逐级乙醇脱水,石蜡包埋,3~5 μm切片,,经苏木精-伊红(HE)染色,光学显微镜下进行检查。
9.统计学处理:采用Origin Pro 8 SR1软件进行分析,计量资料符合正态分布,以x ± s表示,不同处理组间采用Student′s t检验进行分析。P<0.05为差异有统计学意义。
结果1.8 Gy分割照射后小鼠体重变化:照射后不同时间点,单纯照射组小鼠体重低于对照组,但差异无统计学意义(P>0.05),而照射给药组小鼠体重略高于单纯照射组,但仍低于对照组,差异无统计学意义(P>0.05),见图 1。

|
图 1 胸部8 Gy分割照射后小鼠体重随时间的变化 Figure 1 Time response of mice weight after fractionated |
2.分割照射对小鼠脾脏指数的影响:雄鼠右胸分割照射后第7天,与对照组(0.396±0.022)相比,单纯照射组小鼠脾脏指数显著降低(0.369±0.011),两组比较差异有统计学意义(t=2.978,P < 0.05)。照射给药组与单纯照射组比较,小鼠脾脏指数恢复到对照水平(0.400±0.027),差异有统计学意义(t=1.015,P < 0.05)。
3.脾脏T淋巴细胞的变化:雄鼠右胸分割照射后第7天,与对照组相比,单纯照射组中小鼠脾脏内CD3+、CD4+、CD8+、CD3+CD4+、CD3+CD8+淋巴细胞降低(t=5.754、3.570、4.442、5.281、4.570,P < 0.05)。而CMTD处理后,可显著升高CD3+、CD3+CD4+与CD3+CD8+细胞的百分比(t=3.523、2.706、2.520,P < 0.05)。单纯照射组与对照组比较CD4+/CD8+显著降低(t=3.024,P < 0.05),照射给药组CD4+/CD8+比值较单纯照射组显著升高(t=2.874,P < 0.05),比值趋近于对照组,可见CMTD可显著改善分割照射后小鼠体内T淋巴细胞免疫功能(表 1)。
|
|
表 1 8 Gy分割照射后第7天小鼠脾T淋巴细胞比例(%,x ± s) Table 1 Percentage of T lymphocytes in mice spleen at 7 days after IR (%, x ± s) |
4.脾脏B淋巴细胞的变化:雄鼠右胸分割照射后第7天,与对照组比较,单纯照射组中小鼠脾脏B淋巴细胞减少(88.5±1.50)% vs.(87.8±1.57)%,但差异无统计学意义(P>0.05)。而照射给药组B淋巴细胞比例升高(89.3±0.53)%,恢复至正常水平,与单纯照射组比较差异有统计学意义(t=3.079,P < 0.05),见图 2。
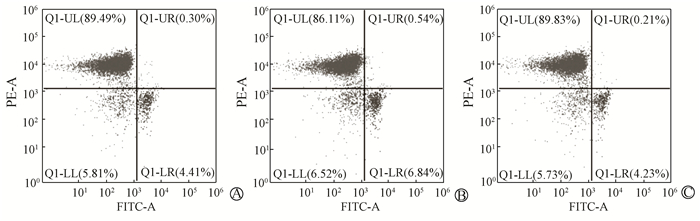
|
A.对照组;B.单纯照射组;C.照射给药组 图 2 8 Gy分割照射后第7天小鼠脾脏B淋巴细胞变化 A. Control group; B. Irradiated group; C. Irradiated + cimetidine group Figure 2 Percentage of B lymphocyte in mice spleen at 7 days after IR |
5.脾脏NK淋巴细胞的变化:雄鼠右胸分割照射后7 d,与对照组相比,单纯照射组中小鼠脾脏NK淋巴细胞减少(1.358±0.029)% vs.(1.193±0.096)%,但差异无统计学意义(P>0.05)。而照射给药物组与单纯照射组比较,NK淋巴细胞比例升高(1.514±0.136)%,恢复至正常水平,两组比较差异有统计学意义(t=3.542,P < 0.05),见图 3。

|
A.对照组;B.单纯照射组;C.照射给药组 图 3 8 Gy分割照射后第7天小鼠脾脏NK淋巴细胞变化 A. Control group; B. Irradiated group; C. Irradiated + cimetidine group Figure 3 Percentage of NK lymphocyte in mice spleen at 7 d after IR |
6.分割照射对小鼠脾脏结构的影响:右胸部分割照射后第7天,对照组小鼠脾脏肉眼观察可见边缘光滑清晰,有光泽,经HE染色后可见脾脏内无充血,脾脏中的白髓和红髓分界清晰。单纯照射组小鼠脾脏肉眼观察发现脾脏体积变小,颜色发黑,无明显光泽,镜下观察发现脾脏内各细胞之间间隙增大、质松,白髓和红髓间隙不清楚,小鼠脾小体数量减少。而照射给药组小鼠经过CMTD处理可有效改善脾脏结构,白髓和红髓分界可见,脾小体增多(图 4)。
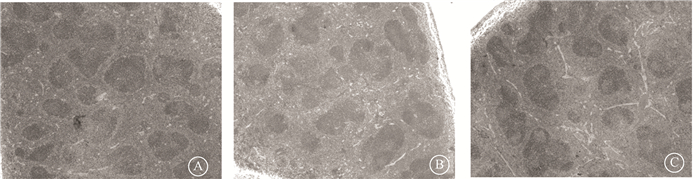
|
A.对照组;B.单纯照射组;C.照射给药组 图 4 8 Gy分割照射后第7天小鼠脾脏 HE染色×50 A. Control group; B. Irradiated group; C. Irradiated + cimetidine group Figure 4 HE staining of mice spleen tissue at 7 d after IR ×50 |
讨论
2006年联合国关于切尔诺贝利核事故的一份报告中指出,辐射暴露可引起机体免疫学变化,包括外周淋巴细胞数量和功能的变化以及血清免疫球蛋白水平的变化[10]。成熟的T淋巴细胞是一群具有免疫活性的小细胞群,经过在胸腺内发育并分化为成熟的T淋巴细胞,成熟的T淋巴细胞移居至外周免疫器官及外周血,从而发挥其免疫应答、免疫调节作用。机体的抗肿瘤免疫主要以细胞免疫为主,尤以T淋巴细胞及其亚群为主,免疫功能下降或受抑制均可导致肿瘤发生。
中等以上的照射剂量可降低机体免疫功能,是辐射致癌的基础之一。动物实验证实,小鼠胸部照射后会诱导成熟的T淋巴细胞在肺部募集,T淋巴细胞缺陷的小鼠发生放射性肺纤维化的时间较正常小鼠并发时间早[11]。通过对小鼠放射性肺损伤模型的研究发现,T细胞在急性放射性肺炎的发生、发展过程中发挥重要的免疫调节功能[12]。本研究发现,小鼠胸腔经8 Gy×3分割照射后,脾脏T细胞亚群受到影响,其中CD3+、CD4+、CD8+、CD3+CD4+以及CD3+CD8+淋巴细胞亚群均显著降低,且与时间呈依赖关系。这些淋巴细胞亚群受损,可以导致小鼠免疫功能下降。
脾脏是体内最大的免疫器官,脾脏内含有多种淋巴细胞,其中以B淋巴细胞比例最多,主要分布在脾小体边缘区和红髓中,B淋巴细胞的增殖与分化功能是衡量机体免疫功能的一个重要的指标。NK细胞是先天性免疫系统的重要组成部分, 是机体防止感染和细胞发生恶性转化的重要免疫调节细胞。本研究发现,分割照射后小鼠脾脏B淋巴细胞与NK细胞减少,而CMTD处理受照射小鼠,可恢复脾脏B淋巴细胞以及NK细胞的水平。
CMTD是由美国食品药品监督管理局(FDA)批准用于减少胃酸分泌的药物,它可以有效地缓解消化性溃疡、糜烂性胃食管反流和分泌过多的症状,包括Zollinger-Ellison综合征和多发性内分泌腺瘤引起的症状[13]。CMTD的免疫调节和抗癌作用逐渐得到认识,这拓宽了其在临床中应用。CMTD被吸收后可存在于除脑组织以外的全身各组织中[14-15],因此,其药理作用也很广泛。本研究发现,辐射后给予小鼠喂食CMTD可有效降低脾脏淋巴细胞损伤,改善脾脏辐射病理损伤,表明CMTD是可作为一种潜在的辐射损伤治疗药物。
总之,本研究发现局部分割照射可引起小鼠未照射器官脾脏结构与功能的改变,免疫淋巴细胞减少,免疫功能减弱,而CMTD有效改善分割照射所致的小鼠免疫淋巴细胞减少, 减弱脾脏结构损伤,有助于治疗辐照所致机体损伤。
利益冲突 所有作者均于投稿前阅读并认可研究内容,不存在任何潜在利益冲突,排名无争议;本人与本人家属、其他研究者,未接受任何不正当的职务或财务利益,对研究的独性和科学性予以保证
作者贡献声明 白杨负责实验操作、数据整理、结果分析、论文撰写;张俊玲负责流式与动物相关实验;姚丹与张江虹负责动物实验;邵春林负责研究设计、论文修改、指导论文写作
| [1] |
Burdak-Rothkamm S, Rothkamm K. Radiation-induced bystander and systemic effects serve as a unifying model system for genotoxic stress responses[J]. Mutat Res, 2018, 778: 13-22. DOI:10.1016/j.mrrev.2018.08.001 |
| [2] |
Zhang J, Yao D, Zhang J, et al. TGF-β mediates thoracic radiation-induced abscopal effects of testis injury in rat[J]. Biochem Biophys Res Commun, 2019, 514(3): 678-683. DOI:10.1016/j.bbrc.2019.05.016 |
| [3] |
Yang X, Xu S, Su Y, et al. Autophagy-src regulates connexin43-mediated gap junction intercellular communication in irradiated HepG2 cells[J]. Radiat Res, 2018, 190(5): 494-503. DOI:10.1667/RR15073.1 |
| [4] |
Chaudhry MA, Omaruddin RA. Differential regulation of microRNA expression in irradiated and bystander cells[J]. Mol Biol (Mosk), 2012, 46(4): 634-643. |
| [5] |
Hekim N, Cetin Z, Nikitaki Z, et al. Radiation triggering immune response and inflammation[J]. Cancer Lett, 2015, 368(2): 156-163. DOI:10.1016/j.canlet.2015.04.016 |
| [6] |
Brodin P, Davis MM. Human immune system variation[J]. Nat Rev Immunol, 2017, 17(1): 21-29. DOI:10.1038/nri.2016.125 |
| [7] |
Kojima Y, Kondo T, Zhao QL, et al. Protective effects of cimetidine on radiation-induced micronuclei and apoptosis in human peripheral blood lymphocytes[J]. Free Radic Res, 2002, 36(3): 255-263. DOI:10.1080/10715760290019264 |
| [8] |
Mozdarani H, Khoshbin-Khoshnazar AR. In vivo protection by cimetidine against fast neutron-induced micronuclei in mouse bone marrow cells[J]. Cancer Lett, 1998, 124(1): 65-71. DOI:10.1016/s0304-3835(97)00451-5 |
| [9] |
何颖, 张俊玲, 赵忆宁, 等. 西咪替丁对伽马射线辐照小鼠免疫功能的保护作用[J]. 辐射研究与辐射工艺学报, 2018, 36(2): 22-28. He Y, Zhang JL, Zhao YN, et al. Protective effect of cimetidine on immune function of mice irradiated by gamma-rays[J]. J Radiat Res Radiat Proc, 2018, 36(2): 22-28. DOI:10.11889/j.1000-3436.2018.rrj.36.020203 |
| [10] |
Bennett B, Repacholi M, Carr Z. Health effects of the chernobyl accident and special health care programmes[J]. Geneva:WHO Press, 2006. |
| [11] |
Cappuccini F, Eldh T, Bruder D, et al. New insights into the molecular pathology of radiation-induced pneumopathy[J]. Radiother Oncol, 2011, 101(1): 86-92. DOI:10.1016/j.radonc.2011.05.064 |
| [12] |
Xiong H, Liao Z, Liu Z, et al. ATM polymorphisms predict severe radiation pneumonitis in patients with non-small cell lung cancer treated with definitive radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2013, 85(4): 1066-1073. DOI:10.1016/j.ijrobp.2012.09.024 |
| [13] |
Scheinfeld N. Cimetidine:a review of the recent developments and reports in cutaneous medicine[J]. Dermatol Online J, 2003, 9(2): 4. |
| [14] |
Kubecova M, Kolostova K, Pinterova D, et al. Cimetidine:an anticancer drug?[J]. Eur J Pharm Sci, 2011, 42(5): 439-444. DOI:10.1016/j.ejps.2011.02.004 |
| [15] |
Kokhaei P, Barough MS, Hassan ZM. Cimetidine effects on the immunosuppression induced by burn injury[J]. Int Immunopharmacol, 2014, 22(1): 273-276. DOI:10.1016/j.intimp.2014.07.003 |
 2020, Vol. 40
2020, Vol. 40


