2. 荆门市第二人民医院放疗科 448000
2. Department of Radiation Oncology, Jingmen NO. 2 People's Hospital, Jingmen 448000, China
美国临床肿瘤协会(ASCO)一项统计数据表明,乳腺癌仍然是威胁女性健康第一位的肿瘤[1]。有研究结果显示,对于根治术后腋窝淋巴结呈阳性的患者,胸壁和区域淋巴结的放疗,可以提升局部控制率和总体生存率[2-4]。调强放疗(IMRT)技术由于其剂量学优势,而被广泛地应用于乳腺癌的术后辅助治疗[5-6]。在确保靶区适形度和均匀性的前提下,减少正常组织的受照剂量尤其是肺部和心脏剂量是乳腺癌IMRT中重点关注的问题。研究表明,乳腺癌放疗后放射性肺纤维化、晚期缺血性心脏疾病与所受照体积和剂量呈正相关关系[7]。而乳腺癌改良根治术后胸壁、内乳区等靶区与心脏、患侧肺紧贴,致使乳腺癌根治术后,尤其是左乳癌患者放疗计划设计难度加大。目前,针对乳腺癌改良根治术后放疗,国内外IMRT计划的射野数量多为5~7野,但是大多数靶区仅包含胸壁和锁骨上区。对于包含了内乳区靶区的计划,多采用额外加0°射野,部分方法采用固定二级准直器方式[8-10]。本研究在总结国内外布野方式优缺点的基础上,根据武汉大学中南医院就诊患者解剖结构和靶区的实际情况,摸索一种一体化的射野设计及准直器调制方法,并探讨新方法和常规调强技术在设计乳腺癌改良根治术后动态调强放疗(dynamic intensity modulated radiation therapy,dIMRT)计划时,靶区和危及器官(OAR)的剂量学差异,为临床应用提供支持。
1、资料与方法1.患者资料:选取武汉大学中南医院从2017年10月至2019年2月收治的41例左侧乳腺癌根治术后患者,存在高危因素,如术后淋巴结阳性、腋窝未完全清扫、肿瘤位置在内象限等,需接受术后胸壁区、内乳区、腋窝区及锁骨上区放疗。其中,T1N1M0期8例,T2N1M0期13例,T2N2M0期15例,T3N1M0期5例。年龄38~58岁,中位年龄46岁。所有患者均未植入乳房假体,放疗前患者或其直系亲属均签署知情同意书。
2.定位方法:41例患者均取仰卧位,一体化定位板固定于碳纤维床上,患者平躺在固定板上,下颌上仰,右手握固定板右侧体柱,左胳膊外展上举,手握头顶手柱。用铅丝标记胸壁放疗范围和手术疤痕,在胸壁上放置1 cm厚补偿膜覆盖胸壁放疗范围(补偿膜内界过体中线5~7 cm),并由热塑体膜固定体位,以减小呼吸幅度。平静呼吸状态下,通过德国西门子16排大孔径定位CT获取患者影像,扫描层厚为0.3 cm,扫描范围为下颌骨下缘至横膈下缘5 cm,影像资料以DICOM格式传输至Eclipse 13.5计划系统。
3.靶区和危及器官勾画:参考美国国立综合癌症网络(NCCN)指南和欧洲癌症治疗研究组织(EORTC)指南,由同一位临床经验丰富的肿瘤医师在CT图像上完成靶区和OAR勾画。临床靶区(CTV)包括患侧胸壁、内乳淋巴结区域及锁骨上、下淋巴结区域。胸壁、内乳淋巴结区域合并命名为CTVp,锁骨上、下淋巴结区域命名为CTVn,CTVp及CTVn外扩0.5 cm为计划靶区(PCTVp及PCTVn),PCTVp除内乳区附近外,不包括肺组织,且包含部分补偿膜区域。经统计,选取的患者靶区总体积范围750~847 cm3, 平均784 cm3。同时勾画OAR,健侧乳腺、两侧肺组织、心脏、脊髓、喉、食管、甲状腺、肱骨头等。
4.常规计划设计方法:基于美国瓦里安直线加速器Varian IX和Eclipse 13.5计划系统,选用6 MV X射线。对每例患者的定位CT分别制作一体化调强射野设计的计划和常规的调强计划,剂量率为400 MU/min,计算网格0.25 cm,所有靶区处方剂量均为50 Gy,25次。传统的乳腺癌改良根治术后放疗射野设计以Ma等[10]等讨论的方法最为流行,其中采取10个分割式射野数目的计划(即部分角度射野照射锁骨上区域,其余角度射野照射胸壁和内乳区)相对于7个整体性射野(即锁骨上区与胸壁内乳区共用同一角度的射野)数目的计划更优,按照其讨论的分割式布野原理,参考其射野角度,常规的计划布野角度大致为锁骨上区0°、30°、145°和325°,胸壁及内乳区共用角度115°、125°、140°、305°、315°和325°,具体的射野角度根据患者轮廓而灵活微调整。
5.一体化射野调强计划设计方法:经过大量的临床实践,探索出的一体化调强射野布野方式,同样采用了分割式布野方法,共设置7至8个机架角度,10个射野。锁骨上区,采用3个角度设计,角度分别为160°、30°和310°,射野的下缘至锁骨下区。胸壁区角度为290°、300°、310°、160°、145°、125°,射野上缘在锁骨下区,内乳区另外添加内乳射野30°,具体的射野角度根据患者轮廓而灵活微调。新计划的射野在胸壁区采用了3对半野设计方案,射野宽度以少穿患侧肺为原则进行调整,且相对常规方案胸壁靶区起始角度更大(为290°和160°),30°内乳野大小只包含内乳淋巴区域,且以尽可能减少照射心脏为原则,对于锁骨上区,相比于常规计划的4野设计,3野方案基本保证了锁骨上靶区的覆盖率和适形度。所有计划射野均在靶区外缘基础上外放0.5~1 cm,所有射野二级准直器开口位置确定后锁定,再优化。
6.计划评估:参考国际辐射防护单位与测量委员会(ICRU)83号报告[11]进行计划评价,靶区剂量学参数评价包括:最大剂量D2%(2%PTV的体积受到的照射剂量)、平均剂量Dmean、最小剂量D98%,V95%(接受95%处方剂量的PTV相对体积)、V100%、V107%,靶区适形指数CI=(VTref/VT)× (VTref/Vref),式中,VTref为参考等剂量面所包绕的靶体积,VT为靶体积,Vref为参考等剂量面所包绕的体积。CI值介于0~1,CI值越接近于1,说明靶区适形度越好;靶区均匀性指数HI=(D2%-D98%)/ D50%,HI值越小,说明靶区均匀性越好。为了统一评价,所有计划靶区剂量体积直方图(DVH)归一到靶区V100%=95%。OAR剂量学参数评价标准:健侧乳腺Dmean<5 Gy、患侧肺V5<60%(V5为5 Gy剂量所包绕的体积)、V20<30%,心脏V30<10%、Dmean<8 Gy,脊髓Dmax<35 Gy。其他常规器官的平均剂量以及两类计划的机器跳数及出束时间比较。
7.统计学处理:计量资料以x±s表示,采用SPSS 23.0软件对数据进行统计学分析。组间数据比较前,行正态性检验,若服从正态分布,则采用配对t检验,反之则采用Wilcoxon符号秩检验。P<0.05为差异具有统计学意义。
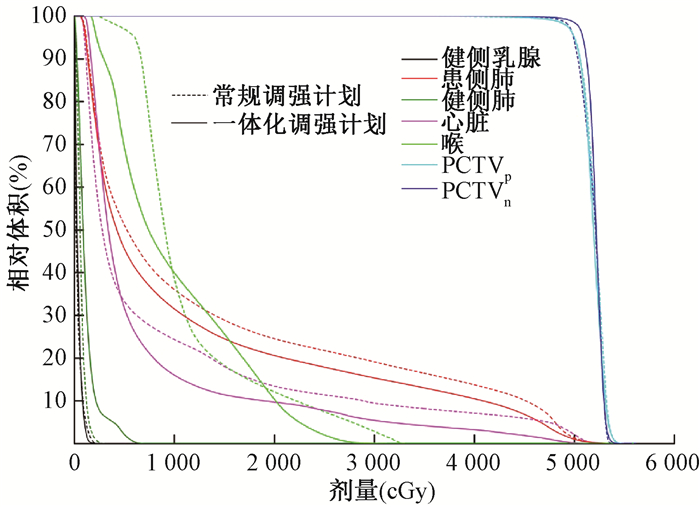
2、结果1.靶区剂量分布:两种计划靶区剂量分布均满足临床要求,新计划靶区最大剂量 < 108%处方剂量,平均剂量 < 52 Gy,靶区处方剂量覆盖95%的靶区体积。两种计划靶区的D2%、Dmean、D98%、V95%、V100%、V107%、CI和HI均相当,差异无统计学意义(P>0.05),相关剂量学参数列于表 1,选取1例两种方式均最佳的患者计划,进行DVH比较,如图 1所示。
|
|
表 1 两种计划靶区剂量学比较(x±s) Table 1 Dosimetry comparison of the two methods for targets(x±s) |
|
图 1 两种计划DVH比较 Figure 1 DVH comparison of the two methods |
2. OAR剂量学参数比较:将两种计划OAR的剂量学参数列于表 2。由表 2可知,OAR剂量学参数虽均满足临床要求,但是采用一体化调强计划的患者患侧肺和心脏的受照体积与受照剂量明显比常规计划显著降低,患侧肺V5降低9.7%(t=2.407,P<0.05)、V10降低11.2%(t=2.160,P<0.05)、V20降低17.3%(t=2.465,P<0.05)、V30降低13.4%(t=2.119,P<0.05)、Dmean降低13.8%(t=2.258,P<0.05);心脏V30下降28.4%(t=2.589,P<0.05)、Dmean下降23.2%(t=2.409,P<0.05);其他OAR剂量学参数差异无统计学意义(P>0.05)。
|
|
表 2 两种计划危及器官剂量学参数比较(x±s) Table 2 Dosimetry comparison of the two methods for OARs(x±s) |
3.机器跳数和出束时间比较:两种计划机器跳数分别为1 901和1 823 MU(P>0.05),出束时间分别为6.8和6.5 min(P>0.05),虽然新型计划有一定的时间节约,但差异均无统计学意义。
3、讨论大量研究表明,乳腺癌术后放疗可显著降低局部复发率,从而有效降低远处转移率,达到改善总生存率的目的[12-13]。乳腺癌根治术后腋窝淋巴结存在部分清扫,故放疗靶区一般应包含胸壁及锁骨上、下淋巴结区域、部分腋窝区,内乳淋巴结区域是否包含在靶区中存在争议,目前达成的共识是以下情况需特殊考虑:①临床或病理证实有内乳淋巴结区域转移的必须放疗。②腋淋巴结转移≥4个、T3或T4、原发灶位于内象限、合并广泛淋巴管血管癌栓等影响内乳淋巴结区域转移的主要因素需综合考虑[14]。本研究所选取的病例,放疗靶区均包含内乳淋巴结区域,靶区增大将导致暴露于射野内的肺和心脏的体积较不包含时显著增大,进而可能显著增加发生放射性肺炎和缺血性心脏疾病的概率。如何降低肺和心脏的受照体积与受照剂量,是左侧乳腺癌根治术后放疗的研究重点。
卜路懿等[15]研究左侧乳腺癌保乳术后调强计划发现,布野后固定二级准直器可以提高靶区适形度并减少肺和心脏的受照体积。张桂芳等[8]发现,在乳腺癌根治术后调强计划中,保证靶区剂量分布不受影响的前提下,适当固定二级准直器位置,能明显降低危及器官低剂量区受照体积,更好地保护危及器官。贺先桃等[9]和Ma等[10]也进行了类似研究,研究结果均证实了优化前固定二级准直器能够降低肺和心脏的受照剂量。本研究比较了常规射野布置和固定准直器方法与摸索出的一体化射野设计的固定二级准直器方法在乳腺癌根治术后调强放疗中靶区剂量分布和危及器官受照剂量的差异,同时也对其他文献报道的剂量学结果进行了横向比较。结果显示,两种计划靶区剂量适形度和均匀性相当;机器跳数和出束时间亦无明显差异;新型射野设计的计划患侧肺V5、V10、V20、V30和Dmean分别比常规计划下降9.7%、11.2%、17.3%、13.4%和13.8%,心脏V30和Dmean分别比常规计划下降28.4%和23.2%。乳腺癌患者根治术后生存期较长,减轻患者根治术后放射性肺炎、远期心脏疾病等不良反应的发生,对于提高患者长期的生活质量具有重要意义。王澜等[16]和Willner等[17]报道肺的受照体积、受照剂量与放射性肺损伤的程度密切相关,Clark等[18]和Cuzick等[19]的长期随访认为,缺血性心脏病的发生风险与受照的剂量正相关。本研究一体化射野设计方案在保证靶区剂量分布的前提下,可以显著降低患侧肺和心脏的受照体积与受照剂量,有望降低晚期心肺不良反应的发生。
基于武汉大学中南医院的Eclipse 13.5计划系统提出的新型照射计划方案中,肺的受照体积与受照剂量也低于诸多文献报道的结果[8-10, 20],心脏受照剂量也与赵培峰等[21]报道的结果相当,考虑到所选病例暴露于射野内的肺和心脏的体积较大(靶区均包含内乳淋巴结区域),且靶区的总体积相对传统仅胸壁靶区亦很大(750~847 cm3),因此,在保证靶区较好的剂量分布的情况下,显著降低心肺的剂量亦表明新型射野设计方案的有效性和优越性。分析有如下原因:①仅对于胸壁靶区,新计划的其中2对从内、外侧给的近似对穿切线野仅包含对应内、外侧的部分胸壁靶区,从而尽可能降低了暴露于射野内患侧肺和心脏的体积。②对于胸壁靶区,第3对近似对穿切线野包含了整个胸壁靶区,由于其对靶区的剂量贡献被另外两对切线野削弱,因而进一步降低了其对患侧肺和心脏的剂量贡献。③对于内乳淋巴结靶区,没有采用0°射野照射内乳区,而是30°射野的二级准直器范围局限于内乳淋巴结区域照射,是因为其削弱了3对近似对穿切线野对内乳区的剂量贡献,既保证了内乳靶区较好的处方剂量适形度,又尽可能降低了患侧肺和心脏的受照体积。④所有射野二级准直器位置均固定,降低了射野穿过患侧肺和心脏的体积,并且减少了多叶光栅(MLC)之间的漏射线。主流的常规计划方案,采用10野,是经过研究和剂量对比后得到的最佳计划设计方式,能使靶区和OAR剂量学参数较优[10]。而一体化计划设计思路同样采用了相同的射野数量,出束时间甚至少于其他较少射野的计划[9],这可能与本研究中射野间的间隔较小、且所有二级准直器位置均固定有关。另外,一体化调强计划虽有10个射野,却仅有7~8个出束角度,因此,设计包含8个机架角度的10个射野,在不降低治疗效率的同时,能实现很好的靶区覆盖,并拥有OAR剂量学优势。
综上,本研究所选取的左侧乳腺癌根治术后的CT图像,靶区包含胸壁、内乳淋巴结区、部分腋窝区、锁骨上区,通过采用一体化调强射野设计的思路,在得到较好靶区剂量覆盖的同时,有效降低了患侧肺和心脏的受照体积与受照剂量。由于所选病例包含不同分期的左乳癌根治术患者,对乳腺癌根治术后调强放疗临床应用具有普遍性,可以作为一种新的照射技术推广。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未因进行该研究接受任何不正当的利益,在此对研究的独立性和科学性予以保证
作者贡献声明 赵洪利负责研究方案设计、部分计划设计、论文写作、修改;陈颖负责部分计划设计和数据统计,并负责部分文章内容撰写;王骁踊、刘晖对本研究给予了技术指导和修改意见;张红艳、钟亚华负责患者靶区、危及器官勾画及审核
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Overgaard M, Hansen PS, Overgaard J, et al. Postoperative radiotherapy in high-risk premenopausal women with breast cancer who receive adjuvant chemotherapy. Danish Breast Cancer Cooperative Group 82b Trial[J]. N Engl J Med, 1997, 337(14): 949-955. DOI:10.1056/NEJM199710023371401 |
| [3] |
Recht A, Gray R, Davidson NE, et al. Locoregional failure 10 years after mastectomy and adjuvant chemotherapy with or without tamoxifen without irradiation:experience of the Eastern Cooperative Oncology Group[J]. J Clin Oncol, 1999, 17(6): 1689-1700. DOI:10.1200/JCO.1999.17.6.1689 |
| [4] |
Kunkler I. Re:Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy:20-year results of the British Columbia randomized trial[J]. J Natl Cancer Inst, 2005, 97(15): 1162-1164. DOI:10.1093/jnci/dji216 |
| [5] |
Kestin LL, Sharpe MB, Frazier RC, et al. Intensity modulation to improve dose uniformity with tangential breast radiotherapy:initial clinical experience[J]. Int J Radiat Oncol Biol Phys, 2000, 48(5): 1559-1568. DOI:10.1016/s0360-3016(00)01396-1 |
| [6] |
徐晓娜, 吴昊, 韩树奎, 等. 左侧乳腺癌调强放疗的剂量学研究[J]. 中华放射肿瘤学杂志, 2006, 15(3): 192-195. Xu XN, Wu H, Han SK, et al. Dosimetry study of intensity modulated radiation therapy for left side breast cancer[J]. Chin J Radiat Oncol, 2006, 15(3): 192-195. DOI:10.3760/j.issn.1004-4221.2006.03.009 |
| [7] |
Correa CR, Litt HI, Hwang WT, et al. Coronary artery findings after left-sided compared with right-sided radiation treatment for early-stage breast cancer[J]. J Clin Oncol, 2007, 25(21): 3031-3037. DOI:10.1200/JCO.2006.08.6595 |
| [8] |
张桂芳, 卢洁, 马长升, 等. 直线加速器二级准直器在乳腺癌根治术后调强放疗计划中的应用[J]. 中华放射医学和防护杂志, 2017, 37(8): 594-598. Zhang GF, Lu J, Ma CS, et al. Application of liner-accelerator two-degrade collimator in the treatment of breast cancer after radical mastectomy with intensity-modulated radiotherapy[J]. Chin J Radiol Med Prot, 2017, 37(8): 594-598. DOI:10.3760/cma.j.issn.0254-5098.2017.08.006 |
| [9] |
贺先桃, 王占宇, 谭军文, 等. 固定铅门模式下容积旋转调强放疗和动态调强放疗在乳腺癌根治术后放疗中的比较[J]. 中国医学物理学杂志, 2018, 181(8): 27-32. He XT, Wang ZY, Tan JW, et al. Comparison of VMAT vs. dIMRT with fixed-jaw technique for postoperative radiotherapy of breast cancer[J]. Chin J Med Phys, 2018, 181(8): 27-32. |
| [10] |
Ma J, Li J, Xie J, et al. Post mastectomy linac IMRT irradiation of chest wall and regional nodes:dosimetry data and acute toxicities[J]. Radiat Oncol, 2013, 8: 81. DOI:10.1186/1748-717X-8-81 |
| [11] |
Hodapp N. The ICRU Report 83:prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188(1): 97-99. DOI:10.1007/s00066-011-0015-x |
| [12] |
Buchholz TA. Radiotherapy and survival in breast cancer[J]. The Lancet, 2011, 378(9804): 1680-1682. DOI:10.1016/S0140-6736(11)61296-8 |
| [13] |
Van de Steene J, Soete G, Storme G. Adjuvant radiotherapy for breast cancer significantly improves overall survival:the missing link[J]. Radiother Oncol, 2000, 55(3): 263-272. DOI:10.1016/s0167-8140(00)00204-8 |
| [14] |
王若峥, 尹勇. 肿瘤精确放射治疗计划设计学[M]. 北京: 科学出版社, 2014. Wang RZ, Yin Y. Plan design of precise radiation therapy for tumors[M]. Beijing: Science Press, 2014. |
| [15] |
卜路懿, 严森祥, 陆中杰, 等. 固定准直器技术在左侧乳腺调强计划中的应用[J]. 中华放射医学与防护杂志, 2011, 31(3): 333-335. Bu LY, Yan SX, Lu ZJ, et al. Application of fixed collimator technique in the treatment of breast cancer with intensity-modulated radiotherapy[J]. Chin J Radiol Med Prot, 2011, 31(3): 333-335. DOI:10.3760/cma.j.issn.0254-5098.2011.03.021 |
| [16] |
王澜, 吕冬婕, 韩春, 等. 胸部肿瘤同期放化疗患者肺功能及剂量学参数对急性肺损伤的预测价值[J]. 中华放射肿瘤学杂志, 2011, 20(1): 40-44. Wang L, Lyu DJ, Han C, et al. The predictive value of basic lung function and dosimetric parameters of acute radiation pneumonitis during the treatment of concurrent chemoradio-therapy[J]. Chin J Radiat Oncol, 2011, 20(1): 40-44. DOI:10.3760/cma.j.issn.1004-4221.2011.01.014 |
| [17] |
Willner J, Jost A, Baier K, et al. A little to a lot or a lot to a little? An analysis of pneumonitis risk from dose-volume histogram parameters of the lung in patients with lung cancer treated with 3-D conformal radiotherapy[J]. Strahlenther Onkol, 2003, 179(8): 548-556. DOI:10.1007/s00066-003-1078-0 |
| [18] |
Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival:an overview of the randomised trials[J]. Lancet, 2005, 366(9503): 2087-2106. DOI:10.1016/S0140-6736(05)67887-7 |
| [19] |
Cuzick J, Stewart H, Rutqvist L, et al. Cause-specific mortality in long-term survivors of breast cancer who participated in trials of radiotherapy[J]. J Clin Oncol, 1994, 12(3): 447-453. DOI:10.1200/JCO.1994.12.3.447 |
| [20] |
洪卫, 冉立, 卢冰, 等. 乳腺癌改良根治术后放疗降低患侧肺受量的剂量学研究[J]. 中华放射医学与防护杂志, 2011, 31(6): 684-687. Hong W, Ran L, Lu B, et al. Dosimetry of different techniques in postmastectomy radiation therapy on the ipsilateral lung[J]. Chin J Radiol Med Prot, 2011, 31(6): 684-687. DOI:10.3760/cma.j.issn.0254-5098.2011.06.016 |
| [21] |
赵培峰, 周钢, 孙彦泽, 等. 左乳癌保乳术后混合调强放疗中利用多叶准直器遮挡技术减少心脏受照剂量的研究[J]. 中华放射医学与防护杂志, 2019, 39(2): 107-112. Zhao PF, Zhou G, Sun YZ, et al. Multileaf collimator shielding technique to reduce cardiac dose in hybrid intensity modulated radiotherapy after breast conserving surgery for left-sided breast cancer[J]. Chin J Radiol Med Prot, 2019, 39(2): 107-112. DOI:10.3760/cma.j.issn.0254-5098.2019.02.005 |
 2020, Vol. 40
2020, Vol. 40


