2. 宁波市第一医院放化疗中心 315010
2. Department of Radiotherapy and Chemotherapy, Ningbo First Hospital, Ningbo 315000, China
鼻咽癌是常见的头颈部恶性肿瘤,尤以东南亚、东亚和地中海等地区高发。调强放疗是鼻咽癌治疗的主要手段,与二维放射治疗相比,无瘤生存率提高12.4%,5年生存率达80%[1]。近年来容积旋转调强放疗(volumetric modulated arc therapy,VMAT)技术因其具有剂量分布优、治疗时间更快等优势被临床广泛应用。鼻咽癌放疗计划多采用2~3个同步加量(simultaneous integrated boost,SIB)靶区剂量梯度,需要保护的正常组织数量大,结构复杂,计划难度大,对低年资物理师人工设计计划提出了很高要求。因此,对计划进行质量控制,判断计划是否达到最优化是十分必要的。在实际临床工作中,鼻咽癌多采用同步加量的照射方式,靶区轮廓复杂且危及器官众多,剂量约束相互影响,医生和物理师难以客观地评估计划质量。本研究提供了一种计算机辅助的自动方法,基于鼻咽癌同步加量VMAT计划,提取其几何特征并使用人工神经网络,建立个体化3D剂量预测模型,并使用该模型建立计划质量控制方法,可以初步实现个体化地评估计划质量。
1、资料与方法1.入组患者情况和参考计划:回顾性分析2013年9月至2018年9月在中国医学科学院北京协和医学院肿瘤医院放疗科接受放射治疗的99例早期鼻咽癌患者,均采用同步加量VMAT方案。由高年资放疗医生对所有病例进行靶区和危及器官(organs at risk,OARs)的勾画。鼻咽部原发肿瘤(GTVnx),定义为电子鼻咽镜、MRI及CT上可见的肿瘤区域;GTVnd定义为影像学判定的阳性淋巴结;临床靶区(clinical target volume,CTV)包括CTV1和CTV2,CTV1包括整个鼻咽、咽后淋巴结、咽旁间隙、斜坡、颅底、翼腭窝及高危淋巴引流区,根据原发灶范围、咽后淋巴结及颈部淋巴结情况,包括阳性淋巴结所在区域及其邻近区域;CTV2包括无淋巴结转移的颈部低危淋巴引流区。将GTVnx和CTV分别外扩3 mm,生成以计划原发肿瘤靶区(PGTVnx)和计划靶区(planning target volume,PTV)。
放射治疗方案常规采用了两阶段SIB治疗方案,在本研究中,仅纳入了第一疗程的计划设计数据。Boost_all包括PGTVnx和GTVnd,其处方为69.96 Gy/33次(2.12 Gy/次),PTV的处方为60.06 Gy/33次(1.82 Gy/次)。OARs剂量限值标准分别为:脑干的危及器官计划体积(planning organ at risk volume, PRV)D2%≤54 Gy,脑干PRV由脑干外扩0.3 cm生成;脊髓PRV D2%≤40 Gy,脊髓PRV由脊髓外扩0.5 cm生成;左右眼晶状体Dmax≤9 Gy;左右腮腺D50%≤30 Gy;喉、垂体、甲状腺、气管、左右颞叶、左右下颌骨和左右颞颌关节要求平均剂量尽可能低,同时避免最大剂量点落在危及器官上。
所有的计划使用Pinnacle 8.0-9.10版本放疗计划系统(美国Philips Radiation Oncology Systems)完成计划设计。患者的靶区和危及器官勾画的准确性及调强计划的质量,均由本科专家医师和物理师团队查房审核通过后,才可进行治疗。专家计划用于模型训练,并作为模型验证的金标准。99例专家计划通过生成随机数,被随机分为训练集(89例)和测试集(10例)进行模型训练,及测试模型预测的准确性。
2.几何特征提取及模型建立:由于SIB计划有两个不同处方剂量靶区PTV和boost_all,OARs中每个体素的剂量与两个靶区的几何位置均有关系,且当OARs中的体素较靠近皮肤的时候,剂量跌落明显,因此提取的距离特征包括危及器官体素到PTV和boost_all的最小距离diPTV和diboost,以及到外轮廓body的最小距离dibody。
每个体素点的位置特征亦可能与剂量相关,因此本研究引入层号水平参数Zi,标记了OARs中每个体素在射野内和射野外的位置[2]:
| $ {Z_i} = \min \left| {Z_i^{{\rm{OAR}}} - \left\{ {{Z^{{\rm{PTV}}}}} \right\}} \right| \times T $ | (1) |
式中,ZiOAR为每个危及器官体素i的Z坐标;ZPTV为PTV的Z坐标数据集;T为CT扫描层厚。
同时计算3个方向的相对坐标[xi,yi,zi]。将脑干和脊髓分界的枢椎尖上层,即脑干的起始层,定义为SI方向的标准坐标,该层脑干的中心点,定义为[x,y,z]的标准坐标。
使用有监督的前馈人工神经网络(artificial neural network,ANN),设置一个隐含层和9个节点,对数据进行训练。双曲正切Sigmoid函数作为激活函数,采用Levenberg-Marquardt误差反向传播梯度训练网络进行优化。
使用测试集病例,评估危及器官3D剂量预测模型的准确性,将预测的剂量与专家计划剂量进行对比。分别计算每个器官预测的和专家计划的D2%、D25%、D50%、D75%和平均剂量(mean dose,MD),并计算ΔD=Dpred-Dref。采用SPSS 19.0进行配对t检验,P<0.05为差异有统计学意义。
3.计划质量控制:基于上述剂量预测模型建立放疗计划质量控制方法,以各危及器官剂量学参数D2%、D25%、D50%、D75%和MD作为质量控制指标, 计算人工计划和预测剂量相对差别,计划通过标准为Δ%≤10%。
| $ \Delta \% = \left( {{D_{{\rm{trate }}}} - {D_{{\rm{prod }}}}} \right)/{D_{{\rm{perseription }}}} \times 100\% $ | (2) |
式中,Dtest和Dpred分别为人工计划的剂量学参数和模型预测的剂量学参数,Dpresciption代表VMAT计划的靶区处方剂量。为便于快速直观分析,绘制计划质量控制图,勾画±5%及±10%的剂量误差控制线。将人工设计的计划剂量与模型预测的剂量进行比较,当剂量指标位于10%右误差线的上方,表明计划通过。当剂量指标位于10%右误差线的下方,表明人工计划剂量劣于预测剂量,且差别>10%,该病例被认为是未达标计划,需要根据预测结果,进行计划条件设置调整和再优化。若剂量指标位于10%左误差线的上方,表明人工计划优于预测剂量,且差别>10%。
由低年资物理师对测试集10例计划进行计划设计练习,练习时只提供给该物理师DICOM CT图像、医生勾画的危及器官和靶区及其剂量要求。根据练习计划和预测的剂量参数指标,生成计划质量控制图,对练习计划进行检查。当发现有剂量指标位于10%右误差线的下方,即Δ%>10%,该计划需要进行计划条件设置调整和再优化,并比较剂量指标在计划调整前后的变化。
2、结果1.验证剂量预测模型准确性:如表 1所示,对各危及器官剂量学指标D2%、D25%、D50%、D75%和MD进行比较,剂量预测结果与专家计划差别总体平均值分别为(-0.27±1.19)、(-0.47±1.29)、(0.93±0.98)、(1.20±1.12)和(0.44±1.02)Gy。左右腮腺D75%和右颞叶D50%,预测结果高于专家计划,说明使用其对计划进行评估时可能低估最优计划达到的程度。其余器官的D2%、D25%、D50%、D75%和MD,预测剂量与专家计划结果几乎相当,差异无统计学意义,说明预测模型具有较好的准确性。图 1所示为1例患者腮腺预测剂量和专家计划剂量的比较结果,剂量分布比较、体积直方图(dose volume histogram,DVH)比较及逐点预测比较均显示,该例患者在低量区出现预测精度下降的情况,与统计学分析相一致。
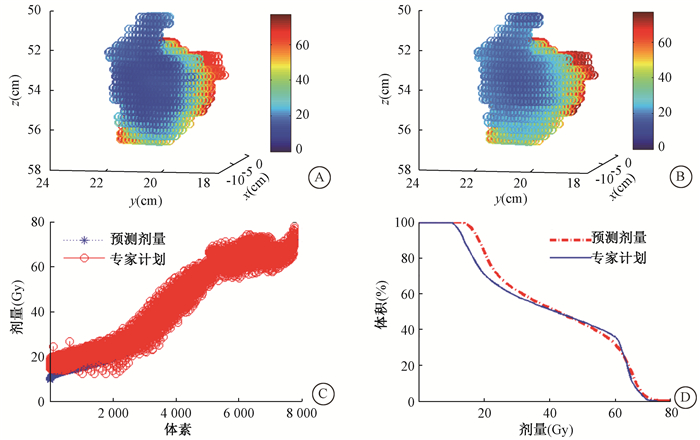
|
图 1 右腮腺剂量专家计划和预测剂量比较A.专家计划剂量分布;B.预测剂量分布;C.专家计划和预测剂量逐点比较;D.专家计划和预测剂量DVH比较 Figure 1 Dose comparison of right parotid gland between expert plan and model prediction A. Expert plan dose distribution; B. Model predicted dose distribution; C. Voxel dose comparison between expert plan and model prediction; D. DVH comparison between expert plan and model prediction |
|
|
表 1 危及器官专家计划和预测剂量学参数比较(Gy,x±s) Table 1 Dosimetric parameter comparison of OARs between expert plan and model prediction(Gy, x±s) |
2.验证计划质量控制的可行性和有效性:由低年资物理师设计的10例练习计划,均达到临床剂量限值的要求。使用建立的放疗计划质量控制方法,计算Δ%并绘制练习计划与预测剂量的质量控制图(图 2)。10例计划中有9例的剂量指标D2%~D75%及MD均可控制在10%的右误差线上方,Δ%≤10%,表明练习计划不劣于预测剂量, 图 2显示其中一例达标练习计划的质量控制结果和一例质量控制中发现未达标的练习计划。脊髓和脊髓PRV的D2%和D25%, 以及脑干和/或脑干PRV的D2%、D25%、和D50%的Δ%值>10%,位于质量控制图 10%右误差线的下方。根据模型预测值进行计划修改后,脊髓和脊髓PRV的D2%分别从36.1和36.9 Gy下降到27.7和30.0 Gy,脑干和脑干PRV的D2%分别从36.1和40.3 Gy下降到30.3和32.6 Gy。亦可从剂量分布观察到明显改善(图 3)。其余危及器官各剂量参数指标及PTV和PGTV的均匀性指数和适形性指数变化控制均在±1%之内(使用PTV减去PGTV外扩0.5 cm计算PTV的均匀性指数)。此外,该计划部分剂量指标如左颞颌关节等,位于左误差线的上方,表明练习计划优于预测剂量。
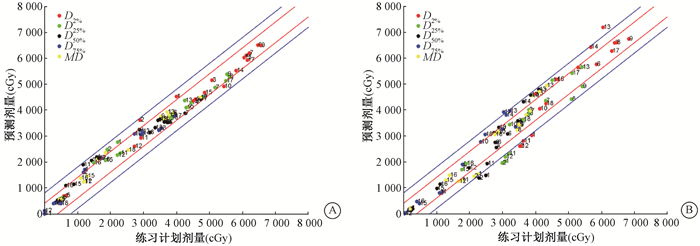
|
注:红线为5%的误差线,蓝线为10%的标记线;1.脑干的危及器官计划体积;2.脑干;3.喉;4.左晶体;5.右晶体;6.左下颌骨;7.右下颌骨;8.左腮腺;9.右腮腺;10.垂体;11.脊髓的危及器官计划体积;12.脊髓;13.左颞颌关节;14.右颞颌关节;15.左颞叶;16.右颞叶;17.甲状腺;18.气管 图 2 2例练习计划各危及器官计划质量控制图 Figure 2 Plan quality control chart of OARs for two cases |
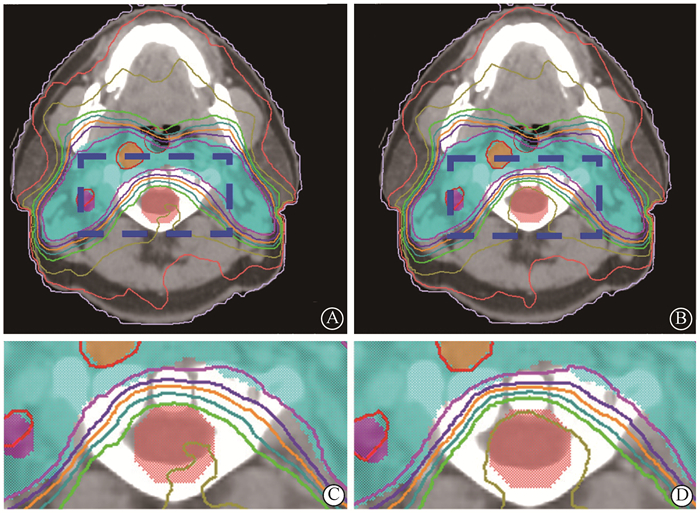
|
注:C和D分别为A和B蓝色虚线框放大图 图 3 1例练习计划剂量分布图A、C.未达标;B、D.修改后 Figure 3 Dose distribution of a practice plan A, C. Not met the QA criteria; B, D. After the re-optimizing |
3、讨论
目前在治疗计划设计环节,计划质量控制是放疗医生和物理师参考统一的临床处方剂量要求和危及器官限值而完成的,如肿瘤放射治疗协作组(RTOG)等。但实际上即使同一临床分期的患者,由于其个体间的差异也将导致每个患者最优计划结果不相同。因此这种基于人群统计的临床处方剂量要求的质量控制方法,很难客观地评价放疗计划对于个体病例是否达到最优。不仅如此,国外已有多项研究表明对于同一病例在不同地区的医院由不同物理师进行计划设计,计划质量差异很大[3-8]。近几年,已有学者对放疗计划质量控制方法进行相关研究,其最重要的核心就是预测剂量学信息[9-10]。
本研究采用人工神经网络算法,提取7个几何特征,实现了对于同步加量鼻咽癌VMAT计划三维剂量分布的预测,为临床提供了较准确的个体化剂量学指标质量控制工具。基于剂量预测模型建立质量控制方法,绘制D2%、D25%、D50%、D75%和MD的计划质量控制图,以对放疗计划进行检查。危及器官内的体素剂量不但与距整个靶区的最小距离有关,还与距加量靶区的最小距离和外轮廓的最小距离有关,同时亦与相对位置坐标和是否在射野范围内有关。因此,本研究提取了3个距离特征和4个位置特征,进行建模。
本研究使用测试集专家计划对模型进行了验证,预测剂量与专家计划结果接近,说明训练模型有较好的准确性。所有器官各指标中仅左右腮腺D75%和右颞叶D50%的预测值高于参考剂量,说明测试集专家计划对这些指标的限制严格,亦说明训练集部分计划尚有改进的空间。
目前,对于专家库经验知识的挖掘、建模及应用问题[11-12],不同学者提出了不同的解决方案。有学者通过搜寻与既往病例数据库中相似的OARs)和PTV重叠体积直方图(overlap volume histogram,OVH),来确定剂量DVH相关的目标优化条件,完成放疗计划设计及计划的质量控制[9, 13-14]。此类方法不建立剂量预测模型,仅通过寻找相似的DVH曲线或优化参数设置给出对应的近似参考结果,其个体化治疗效果有待商榷。且此方法不能脱离庞大的数据库,不便于实际应用。另有学者提出可使用距离靶区直方图(distance-to-target histogram,DTH)及DVH数据,通过主成分分析和回归等方法建立DVH预测模型,实现放疗计划质量保证,并应用于新病例计划设计[10, 15-16]。上述研究仅是基于对DVH曲线或DVH目标优化条件的预测,不能全面预测计划的剂量信息,无法提供3D剂量分布预测结果。
3D剂量分布预测较DVH和剂量参数预测提供了更多的信息,为更加广泛和准确地将专家计划的先验知识应用于临床精准放疗提供了可能。Nwankwo等[2, 17]报道了基于危及器官内体素点到PTV的最小距离和相应体素剂量的关系建立算法,对单一处方前列腺癌病例进行点对点3D剂量分布预测,并用于指导低年资物理师进行计划设计。该算法理论基础是危及器官内,离PTV近的点接受到较高剂量,而离PTV远的点接受较低剂量,建立危及器官-计划靶区的关系模型。亦有学者提取距离相关特征,采用人工神经网络,进行三维剂量预测的研究[18-19]。同步加量的调强放射治疗广泛应用于鼻咽癌的放疗,本科收治的T\-1和T2期患者多采用2个剂量梯度SIB放疗,较单处方的治疗模式更为复杂,这对基于先验知识的放射治疗计划建模造成了特殊的困难。有学者指出,同步加量计划对于分析解剖和剂量关系,建立模型预测DVH或三维剂量分布带来了较大的挑战[20-21]。本研究纳入了各OARs到PTV和boost_all的最小距离,以提高SIB计划预测模型的精度。
在本研究中,10例测试集计划被以新接收计划的形式派发给1名低年资物理师, 重新设计计划的数据结果与预测剂量进行对比。模型有效地发现了1例患者脑干和脊髓的剂量超过模型预测值的10%,未达标计划的脊髓和脊髓PRV的D2%分别为36.1和36.9 Gy,脑干和脑干PRV的D2%分别为36.1和40.3 Gy。该计划可满足常规临床剂量限值要求标准,导致物理师无法判断是否需要继续优化,而通过预测模型能够及时和客观检出尚未达到最优的剂量学指标,将进一步指导物理师设计计划以达到个体化最优。通过预测结果的指导,对该计划的脑干和脊髓的限制条件进行重新设置及计划再优化,脊髓和脑干D2%分别降低了8.4和5.8 Gy, 脊髓PRV和脑干PRV的D2%分别下降了6.9和7.7 Gy;与此同时,其他器官和靶区的剂量改变均在±1%以内。在计划设计的过程中,设计者可能因经验不足或惯性思维等因素主观认为计划已经达到最优,无需进一步优化,而本文所述的模型对计划质量有较高敏感性和检出能力。通过本研究建立的基于ANN模型的计划质量控制方法能够发现常规临床剂量限值无法发现的问题,更加客观地评价放疗计划对于个体病例是否达到最优, 有效避免了因计划设计者个人经验偏差或主观偏见造成的计划质量不稳定性,佐证了基于剂量预测的计划质量控制方法的可行性和有效性。此外,预测结果对计划设计有一定指导意义,该方法亦可进一步应用于基于知识的自动计划设计中。
综上所述,本研究提出了一种基于人工神经网络剂量预测模型的放疗计划质量控制方法,能克服统一性剂量限值未考虑患者特异性的缺陷。该方法简单易行,可作为常规计划质量控制的工具,以提高计划质量和稳定性,亦可降低对计划设计者个人经验和能力的依赖。本文仅基于鼻咽癌同步加量计划建立了基于ANN模型的计划质量控制方法,但其方法学和原理可被应用于其他部位肿瘤放疗计划质量控制的研究。
利益冲突 所有研究者未因进行该研究而接受任何不正当的职务或财务利益, 在此对研究的独立性和科学性予以保证
作者贡献声明 陈辛元负责收集数据、建立模型算法及相关分析算法、分析结果,并撰写论文;杨继明负责练习计划设计、结果统计和论文修改;易俊林和戴建荣指导论文设计和修改
| [1] |
易俊林, 高黎, 黄晓东, 等. 416例鼻咽癌调强放疗远期生存与影响因素分析[J]. 中华放射肿瘤学杂志, 2012, 21(3): 196-200. Yi JL, Gao L, Huang XD, et al. Nasopharyngeal carcinoma treated by intensity-modulated radiotherapy:long-term results of 416 patients[J]. Chin J Radiat Oncol, 2012, 21(3): 196-200. DOI:10.3760/cma.j.issn.1004-4221.2012.03.002 |
| [2] |
Nwankwo O, Sihono DS, Schneider F, et al. A global quality assurance system for personalized radiation therapy treatment planning for the prostate (or other sites)[J]. Phys Med Biol, 2014, 59(18): 5575-5591. DOI:10.1088/0031-9155/59/18/5575 |
| [3] |
Chung HT, Lee B, Park E, et al. Can all centers plan intensity-modulated radiotherapy (IMRT) effectively? An external audit of dosimetric comparisons between three-dimensional conformal radiotherapy and IMRT for adjuvant chemoradiation for gastric cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 71(4): 1167-1174. DOI:10.1016/j.ijrobp.2007.11.040 |
| [4] |
Bohsung J, Gillis S, Arrans R, et al. IMRT treatment planning:a comparative inter-system and inter-centre planning exercise of the ESTRO QUASIMODO group[J]. Radiother Oncol, 2005, 76(3): 354-361. DOI:10.1016/j.radonc.2005.08.003 |
| [5] |
Das IJ, Cheng CW, Chopra KL, et al. Intensity-modulated radiation therapy dose prescription, recording, and delivery:patterns of variability among institutions and treatment planning systems[J]. J Natl Cancer Inst, 2008, 100(5): 300-307. DOI:10.1093/jnci/djn020 |
| [6] |
Nelms BE, Tomé WA, Robinson G, et al. Variations in the contouring of organs at risk:test case from a patient with oropharyngeal cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 368-378. DOI:10.1016/j.ijrobp.2010.10.019 |
| [7] |
Williams MJ, Bailey M, Forstner D, et al. Multicentre quality assurance of intensity-modulated radiation therapy plans:a precursor to clinical trials[J]. Australas Radiol, 2007, 51(5): 472-479. DOI:10.1111/j.1440-1673.2007.01873.x |
| [8] |
Bahm J, Montgomery L. Treatment planning protocols:a method to improve consistency in IMRT planning[J]. Med Dosim, 2011, 36(2): 117-118. DOI:10.1016/j.meddos.2010.02.001 |
| [9] |
Wu B, Ricchetti F, Sanguineti G, et al. Patient geometry-driven information retrieval for IMRT treatment plan quality control[J]. Med Phys, 2009, 36(12): 5497-5505. DOI:10.1118/1.3253464 |
| [10] |
Zhu X, Ge Y, Li T, et al. A planning quality evaluation tool for prostate adaptive IMRT based on machine learning[J]. Med Phys, 2011, 38(2): 719-726. DOI:10.1118/1.3539749 |
| [11] |
Chanyavanich V, Das SK, Lee WR, et al. Knowledge-based IMRT treatment planning for prostate cancer[J]. Med Phys, 2011, 38(5): 2515-2522. DOI:10.1118/1.3574874 |
| [12] |
Sharpe MB, Moore KL, Orton CG. Point/Counterpoint:Within the next ten years treatment planning will become fully automated without the need for human intervention[J]. Med Phys, 2014, 41(12): 120601. DOI:10.1118/1.4894496 |
| [13] |
Petit SF, Wu B, Kazhdan M, et al. Increased organ sparing using shape-based treatment plan optimization for intensity modulated radiation therapy of pancreatic adenocarcinoma[J]. Radiother Oncol, 2012, 102(1): 38-44. DOI:10.1016/j.radonc.2011.05.025 |
| [14] |
Wu B, Ricchetti F, Sanguineti G, et al. Data-driven approach to generating achievable dose-volume histogram objectives in intensity-modulated radiotherapy planning[J]. Int J Radiat Oncol Biol Phys, 2011, 79(4): 1241-1247. DOI:10.1016/j.ijrobp.2010.05.026 |
| [15] |
Yuan L, Ge Y, Lee WR, et al. Quantitative analysis of the factors which affect the interpatient organ-at-risk dose sparing variation in IMRT plans[J]. Med Phys, 2012, 39(11): 6868-6878. DOI:10.1118/1.4757927 |
| [16] |
Yuan L, Wu QJ, Yin FF, et al. Incorporating single-side sparing in models for predicting parotid dose sparing in head and neck IMRT[J]. Med Phys, 2014, 41(2): 021728. DOI:10.1118/1.4862075 |
| [17] |
Nwankwo O, Mekdash H, Sihono DS, et al. Knowledge-based radiation therapy (KBRT) treatment planning versus planning by experts:validation of a KBRT algorithm for prostate cancer treatment planning[J]. Radiat Oncol, 2015, 10: 111. DOI:10.1186/s13014-015-0416-6 |
| [18] |
Shiraishi S, Moore KL. Knowledge-based prediction of three-dimensional dose distributions for external beam radiotherapy[J]. Med Phys, 2016, 43(1): 378. DOI:10.1118/1.4938583 |
| [19] |
Campbell WG, Miften M, Olsen L, et al. Neural network dose models for knowledge-based planning in pancreatic SBRT[J]. Med Phys, 2017, 44(12): 6148-6158. DOI:10.1002/mp.12621 |
| [20] |
Lian J, Yuan L, Ge Y, et al. Modeling the dosimetry of organ-at-risk in head and neck IMRT planning:an intertechnique and interinstitutional study[J]. Med Phys, 2013, 40(12): 121704. DOI:10.1118/1.4828788 |
| [21] |
Appenzoller LM, Michalski JM, Thorstad WL, et al. Predicting dose-volume histograms for organs-at-risk in IMRT planning[J]. Med Phys, 2012, 39(12): 7446-7461. DOI:10.1118/1.4761864 |
 2020, Vol. 40
2020, Vol. 40


