宫颈癌是女性最常见的恶性肿瘤之一[1],手术和放化疗为主要治疗手段[2]。然而,放射抗性严重影响了宫颈癌患者的预后,探究放疗抗性的分子机制对改善患者预后尤为重要[3]。
Ki-67、表皮生长因子受体(EGFR)、血管内皮生长因子(VEGF)等已被证明为肿瘤敏感性标志物[4],也有研究发现UCP2在癌细胞中广泛表达[5],并能抑制活性氧(ROS)的产生[6],从而减轻氧化应激,UCP2功能的丧失会增加ROS的产生[7]。解耦联蛋白(uncoupling protein, UCPs)是线粒体阴离子转运体[8-9],已知的5种UCP(UCP1-5)分布于人体的不同组织,UCP1分布于棕色脂肪中,诱导组织产热,UCP2分布于肝脏、胰腺、脾脏、肾脏和脑中[10],UCP2和UCP3可以减少活性氧的产生[11],UCP4和UCP5定位于大脑,可降低线粒体膜电位[12]。放疗使细胞产生ROS,压倒抗氧化防御,导致细胞损伤、死亡[13-15]。UCP2参与化疗耐药[16-18],但在放疗中的作用机制并不明确。本研究揭示了沉默UCP2对Siha细胞辐射敏感性的影响,因此UCP2可能会成为宫颈癌放疗的新靶点。
1、材料与方法1.细胞株与试剂:宫颈癌Siha细胞株购于北京协和细胞库,UCP2 siRNA和NC siRNA,MEM培养基、胎牛血清购于以色列BI公司;总RNA提取试剂(TRIzol)和反转录试剂盒购于日本TaKaRa公司,二甲基亚砜(DMSO)购于北京索莱宝公司,RFect siRNA转染试剂购于常州百代生物科技股份有限公司,活性氧检测试剂盒购于大连美仑生物技术公司,Rhodamine123购于美国Sigma公司,Anti-β-肌动蛋白、Anti-UCP2、Anti-γ-H2AX购于美国Bioworld公司,Annexin V/PI双染试剂盒购于美国BD公司。
2.细胞培养:在直径为100 mm培养皿以及96孔板用常规MEM培养基含有10%胎牛血清和1%双抗(抗青霉素和链霉素抗生素)。在设定条件为5% CO2、37℃二氧化碳恒温培养箱中培养细胞,待细胞长到80%左右进行传代。
3.细胞照射:采用X射线生物辐照仪(美国Precision X-ray股份有限公司),照射时电压为180 kV,电流为12.0 mA,源靶距为70 cm,剂量率为1.02 Gy/min。
4.siUCP2转染:利用生物信息学软件根据UCP2基因的编码序列设计了针对UCP2的1组siRNA靶点,具体序列:si1UCP2的为GGUGGUCGGAGAUACCAAA,si2UCP2为CCCCGAAGCCGCGACAAGA。培养Siha细胞待细胞密度达到50%,使用RFect转染试剂进行转染。最终将细胞分为3组:UCP2低表达的沉默组、阴性对照组和Siha细胞不做任何处理的空白对照组。
5.RT-PCR和Q-PCR:提取各组细胞RNA,反转录后,进行程序为94℃ 90 s,94℃ 20 s,57℃ 20 s,72℃ 60 s(33循环),72℃ 5 min普通PCR,以β-肌动蛋白为内参,分别通过凝胶成像仪拍照和实时定量PCR仪检测UCP2在Siha细胞中的表达情况。
6.Western blot分析:电泳条件为电压80 V,约15 min;电泳后转膜(90 V,90 min),使用5%脱脂奶粉,封闭1 h,洗涤缓冲液洗5 min 2次,一抗4℃过夜;洗膜10 min×3次;二抗室温孵育1.5 h,洗涤缓冲液洗膜10 min×3次。
7.集落形成试验:将空白对照组、转染siUCP2和siNC组的Siha细胞按2 000/孔接种于6孔板上,在接种24 h后分别进行剂量0、2、4、6、8、10 Gy照射,照射后放于孵箱培养2周,用多聚甲醛固定,结晶紫染色后进行克隆数计数,计算细胞存活分数(SF)。公式为:克隆形成率(PE)=克隆形成数/接种数,SF=克隆数/(接种数×PE)×100%。
8.CCK-8试验:在小皿中种入Siha细胞后,待细胞长到60%~70%,转入siNC和siUCP2,24 h后将转染后的细胞以4 000/孔种于96孔板,24 h后加入CCK-8试剂,置于37℃孵箱孵育3 h,于酶标仪进行吸光度检测。
9.流式细胞术:待细胞生长到60%~70%时,分别接受0、4 Gy照射,照后24 h,用不含乙二胺四乙酸(EDTA)的胰酶消化后,分别收集3组细胞,用PBS洗两遍后,取106细胞,分别向细胞中加入5 μl AnnexinV-FITC和5 μl碘化丙啶(PI),室温避光孵育20 min,再向流式管中入400 μl 1×结合缓冲液(Buffer)重悬细胞,用于流式细胞仪检测。
10.ROS检测:2, 7-二氯二氢氟醚(DCFH-DA)探针本身无荧光,进入细胞后可水解形成2′,7′-二氯二氢荧光素(DCFH)。DCFH可被活性氧氧化成高荧光的二氯荧光素(DCF),可检测细胞内活性氧的生成。转染细胞和未转染细胞24 h后分别置于96孔板(6×103/孔)中,于次日进行4 Gy照射细胞。并且在照射后4 h用8 μmol/L DCFH-DA探针孵育15 min,37℃、PBS洗涤2次后进行ROS检测。
11.线粒体膜电位检测实验:Rhodamine123的荧光进入线粒体后会减弱或消失。当发生凋亡时,线粒体膜的完整性遭到破坏,会导致线粒体膜通透性增加,从而导致线粒体跨膜电位的崩溃(ΔΨm),Rhodamine由此转入线粒体外,从而发出强烈的荧光。因此,Rhodamine的荧光强度与膜电位成反比。转染细胞或未转染细胞24 h后分别置于24孔板(8×104/孔)中,并且在24 h后给予4 Gy照射,然后于照射后24 h用罗丹明检测辐照前后细胞膜电位改变。
12.统计学处理:采用SPSS 24.0软件进行统计学分析,数据符合正态分布,用x±s表示。两两比较使用两独立样本t检验。P<0.05为差异具有统计学意义。
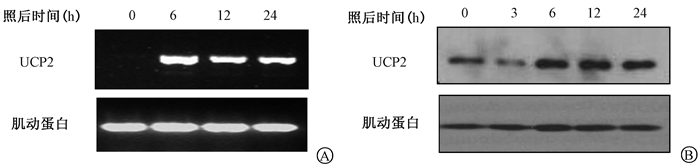
2、结果1.RT-PCR和Western blot检测辐照前后UCP2的表达:结果如图 1所示,UCP2 mRNA在照射后6、12、24 h表达相较于0 h分别增加了2.90、2.04、2.88倍;UCP2蛋白在辐照后6、12、24 h相较于0 h分别升高了10%,27%,15%。提示辐照可能会诱导UCP2的表达增加,UCP2可能为辐射诱导基因。
|
图 1 Siha细胞4 Gy照射前后不同时间UCP2表达变化A. RT-PCR检测UCP2 mRNA表达变化;B. Western blot检测UCP2蛋白表达变化 Figure 1 UCP2 expression levels in Siha cells at different times after 4 Gy irradiation A. UCP2 mRNA expression detected by RT-PCR; B. UCP2 protein expression detected by Western blot |
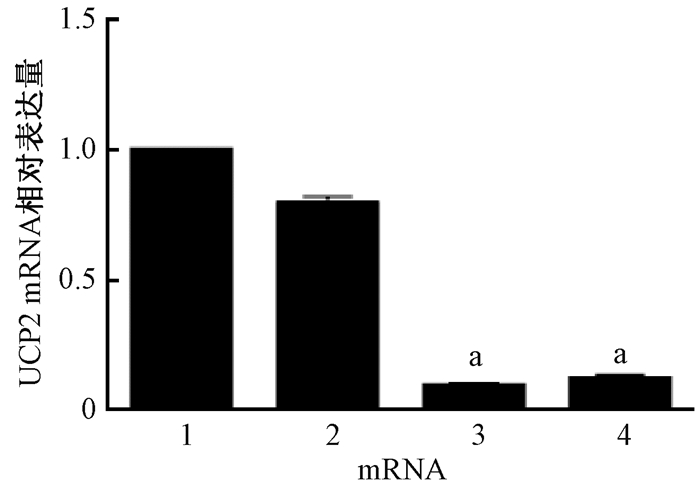
2.Q-PCR检测UCP2 mRNA水平沉默效率:结果见图 2。与空白对照组和阴性对照组相比,沉默组Siha细胞中的UCP2表达量明显下降,沉默效率分别为98%和97.5%,差异有统计学意义(t=157.62、76.21,P < 0.01),后续实验均使用UCP2 siRNA#1。
|
注:1.空白对照组;2.阴性对照组;3.沉默组1;4.沉默组2 a与阴性对照组比较,t=157.62、76.21,P < 0.01 图 2 UCP2 mRNA在Siha细胞沉默组和对照组表达的变化 Figure 2 Expression of UCP2 mRNA in UCP2 siRNA group and control group |
3.集落形成检测细胞的辐射敏感性:设4组平行组在转染后24 h分别给予0、2、4、6、8、10 Gy辐照,以未照射组细胞数为100%,计算存活分数,单击多靶模型拟合生存曲线,结果如图 3,表 1。沉默组相对于空白对照组的放射增敏比为0.62,相对于阴性对照组的放射增敏比为0.46,即沉默组的细胞辐射敏感性明显高于空白对照组与阴性对照组。

|
图 3 抑制UCP2对于Siha细胞生存分数的影响 Figure 3 Effect of UCP2 siRNA on the survival of Siha cells after irradaition |
|
|
表 1 Siha生存曲线相关参数 Table 1 The fitting parameters of cell survival curves |
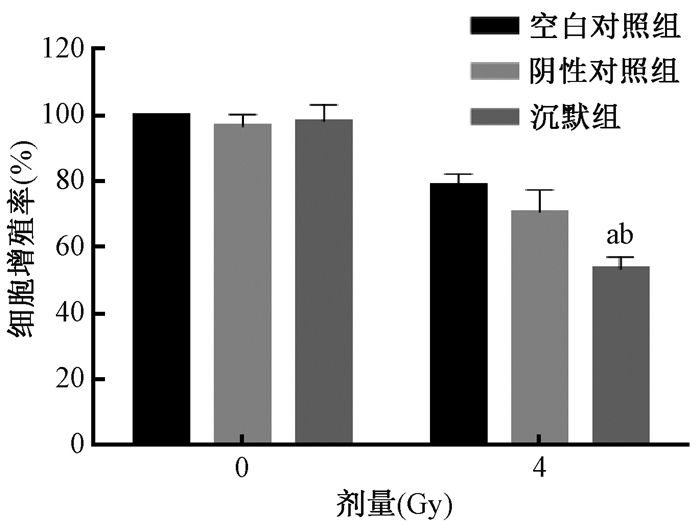
4.CCK-8检测辐照前后细胞活性变化:将siUCP2转染入宫颈癌细胞,于次日进行4 Gy照射,并在24 h时间点使用CCK-8进行细胞活性测定。结果如图 4所示,相比于未照射沉默组,照射沉默组细胞活性明显降低,且差异有统计学意义(t=3.7,P<0.05);相较于照射阴性对照组,照射沉默组细胞活性明显降低,且差异有统计学意义(t=13.2,P<0.05)。
|
注:a与0 Gy沉默组比较,t=3.7,P < 0.05;b与4 Gy阴性对照组比较,t=13.2,P < 0.05 图 4 沉默UCP2对受照前后Siha细胞活性的影响 Figure 4 Effect of UCP2 siRNA on the viability of Siha cells with or without irradiation |
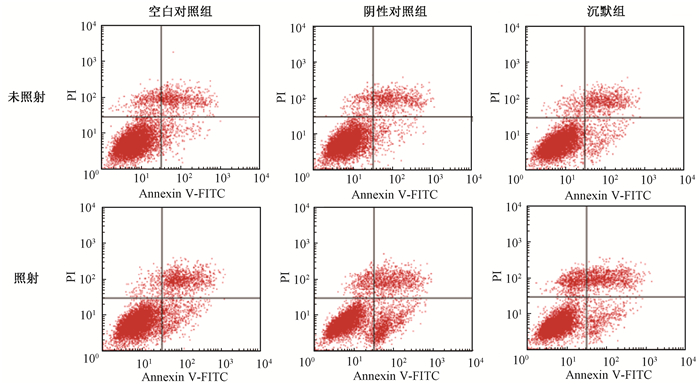
5.流式细胞术检测照射前后细胞凋亡水平:将siUCP2转染入宫颈癌细胞,次日进行4 Gy照射,并在24 h时间点使用流式细胞术进行凋亡测定。结果图 5所示,未照射时,空白对照组、阴性对照组、沉默组的凋亡率分别为(11.07±2.02)%、(11.05±1.29)%、(11.87±1.55)%;照射时,3组细胞凋亡率分别为(16.20±2.37)%、(17.99±2.11)%、(22.39±1.20)%,与未照射时空白对照组相比明显升高(t=2.85、4.10、9.08,P < 0.05)。并且照射沉默组相较于照射阴性对照组凋亡率也明显升高,差异有统计学意义(t=3.85,P < 0.05),即UCP2沉默后增强了辐射诱导的Siha细胞的凋亡。
|
图 5 沉默UCP2对辐射诱导的Siha细胞凋亡水平的影响 Figure 5 Effect of UCP2 siRNA on radiation-induced apoptosis of Siha cells |
6.DCFH-DA检测不同组间辐照前后ROS的产生情况:UCP2作为解耦联蛋白,在质子渗漏过程中可以会影响活性氧产生,本实验通过DCFH-DA来检测辐照后12 h各组细胞中ROS的产生情况,以未照射空白对照组为1,未照射阴性对照和沉默组ROS的相对表达量为0.23±0.12、1.50±0.43;照射组中空白对照组,阴性对照组和沉默组的ROS相对表达量分别为2.15±0.27、2.52±0.51、44.59±3.84。与未照射空白对照组相比,照射后ROS生成量有一定程度的增加,差异具有统计学意义(t=7.38、5.16、19.66,P < 0.05),即电离辐射增强了Siha细胞内ROS的生成;并且照射沉默组相较于照射阴性对照组ROS明显增加,差异有统计学意义(t=19.10,P < 0.05),即UCP2沉默后增强了辐射诱导的Siha细胞内ROS生成增多,进而使细胞辐射敏感性增加。
7. Rhodamine123检测不同组间辐照前后膜电位的变化情况:将siUCP2转染入Siha细胞,次日进行4 Gy照射,并在24 h时间点使用罗丹明进行膜电位测定。以未照射空白对照组为1,未照射阴性对照和沉默组相对荧光强度为1.18±0.04、1.15±0.01;辐照后空白对照组,阴性对照组和沉默组的相对荧光强度为1.94±0.02、1.67±0.06、2.07±0.05。线粒体膜电位与罗丹明荧光强度成反比,即与未照射空白对照组相比,照射后的线粒体膜电位均有所下降,且差异具有统计学意义(t=81.41、19.34、37.07,P < 0.05);并且照射沉默组相较于照射阴性对照组线粒体膜电位也有较大程度的降低,并且差异有统计学意义(t=8.87,P < 0.05)。即UCP2沉默增强了辐射诱导的Siha细胞的线粒体膜电位降低。此现象的发生可能与上述ROS产量增加有关。
3、讨论产生辐射抗性的原因很多,其内源性因素主要是乏氧。ROS在癌症中的作用仍是具有争议,ROS的产生可诱发一系列细胞损伤而导致细胞死亡,同时轻度的氧化应激又可促进细胞存活。线粒体通过复杂的调节反馈降低ROS生成促进癌细胞存活,UCP2可能在此过程中起到一定作用[19-21]。Derdak等[10]发现了UCP2缺失型的大鼠比野生型有UCP2表达的大鼠氧化应激水平更高,并且结肠肿瘤数目也更多。有研究表明,电离辐射处理的LoVo人结肠癌细胞蛋白质微阵列谱显示,UCP2水平与未处理对照组相比略有升高[22]。Oleksiewicz等[23]发现UCP2在非小细胞肺癌中的表达呈上升趋势。Pons等[18]发现抑制UCP2表达会增强乳腺癌细胞对于某些化疗药物的敏感性。Jiang等[24]研究表明,UCP2基因多态性与结直肠癌患者的预后密切相关。当使用siRNA方法使UCP2下调时,细胞癌变被抑制,表明UCP2可能作为早期肿瘤发生的促癌因子来起作用[25]。有研究证明抑制UCP2联合化疗药物后,会激活PI3K/AKT/mTOR信号通路,从而起到药物增敏的作用[26]。UCP2抑制后,会使得ROS生成增加,线粒体膜通透性转换通透性增加,线粒体内促凋亡因子释放入细胞质,从而启动线粒体凋亡通路,促进细胞凋亡[27]。
本研究通过集落形成试验发现,沉默UCP2后宫颈癌细胞在照射之后的增殖活性明显降低,即表明抑制UCP2之后宫颈癌细胞的辐射敏感性增强;并且流式细胞术检测细胞凋亡结果显示辐照后沉默UCP2的宫颈癌细胞在照射之后的凋亡水平相较于对照组明显升高;并且在辐照后4 h, UCP2沉默组ROS生成量相较于阴性对照组明显增加;在辐照后24 h,UCP2沉默组膜电位有较大程度的降低。这些结果表明,UCP2与宫颈癌辐射敏感性有关,但具体机制尚不明确,若将其作为辐射敏感性标志物应用于临床,还需进行体内实验进一步验证。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突
作者贡献声明 刘翠花负责辐照后生物学实验并撰写论文初稿;董新宇、李远航负责细胞转染和照射;张新强参与培养细胞;王志成、赵刚提供实验内容相关建议;申延男负责实验设计与经费提供,并在论文写作过程中给予指导
| [1] |
Dutta S, Nguyen NP, Vock J, et al. Image-guided radiotherapy and -brachytherapy for cervical cancer[J]. Front Oncol, 2015, 5: 64. DOI:10.3389/fonc.2015.00064 |
| [2] |
Kim HJ, Chang JS, Koom WS, et al. Radiotherapy is a safe and effective salvage treatment for recurrent cervical cancer[J]. Gynecol Oncol, 2018, 151(2): 208-214. DOI:10.1016/j.ygyno.2018.08.029 |
| [3] |
Torre LA, Siegel RL, Ward EM, et al. Global cancer incidence and mortality rates and trends-an update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(1): 16-27. DOI:10.1158/1055-9965.EPI-15-0578 |
| [4] |
Petera J, Sirak I, Beranek M, et al. Molecular predictive factors of outcome of radiotherapy in cervical cancer[J]. Neoplasma, 2011, 58(6): 469-475. DOI:10.4149/neo_2011_06_469 |
| [5] |
Horimoto M, Resnick MB, Konkin TA, et al. Expression of uncoupling protein-2 in human colon cancer[J]. Clin Cancer Res, 2004, 10(18 Pt 1): 6203-6207. DOI:10.1158/1078-0432.CCR-04-0419 |
| [6] |
Duval C, Nègre-Salvayre A, Dogilo A, et al. Increased reactive oxygen species production with antisense oligonucleotides directed against uncoupling protein 2 in murine endothelial cells[J]. Biochem Cell Biol, 2002, 80(6): 757-764. DOI:10.1139/o02-158 |
| [7] |
Teshima Y, Akao M, Jones SP, et al. Uncoupling protein-2 overexpression inhibits mitochondrial death pathway in cardiomyocytes[J]. Circ Res, 2003, 93(3): 192-200. DOI:10.1161/01.RES.0000085581.60197.4D |
| [8] |
Fleury C, Sanchis D. The mitochondrial uncoupling protein-2:current status[J]. Int J Biochem Cell Biol, 1999, 31(11): 1261-1278. DOI:10.1016/s1357-2725(99)00049-7 |
| [9] |
Boss O, Muzzin P, Giacobino JP. The uncoupling proteins, a review[J]. Eur J Endocrinol, 1998, 139(1): 1-9. DOI:10.1530/eje.0.1390001 |
| [10] |
Derdak Z, Fulop P, Sabo E, et al. Enhanced colon tumor induction in uncoupling protein-2 deficient mice is associated with NF-kappaB activation and oxidative stress[J]. Carcinogenesis, 2006, 27(5): 956-961. DOI:10.1093/carcin/bgi335 |
| [11] |
Echtay KS, Murphy MP, Smith RA, et al. Superoxide activates mitochondrial uncoupling protein 2 from the matrix side[J]. J Biol Chem, 2002, 277(49): 47129-47135. DOI:10.1074/jbc.M208262200 |
| [12] |
Hoang T, Smith MD, Jelokhani-Niaraki M. Toward understanding the mechanism of ion transport activity of neuronal uncoupling proteins UCP2, UCP4, and UCP5[J]. Biochemistry, 2012, 51(19): 4004-4014. DOI:10.1021/bi3003378 |
| [13] |
Alexandre J, Batteux F, Nicco C, et al. Accumulation of hydrogen peroxide is an early and crucial step for paclitaxel-induced cancer cell death both in vitro and in vivo[J]. Int J Cancer, 2006, 119(1): 41-48. DOI:10.1002/ijc.21685 |
| [14] |
Fruehauf JP, Meyskens FL. Reactive oxygen species:a breath of life or death?[J]. Clin Cancer Res, 2007, 13(3): 789-794. DOI:10.1158/1078-0432.CCR-06-2082 |
| [15] |
Pelicano H, Carney D, Huang P. ROS stress in cancer cells and therapeutic implications[J]. Drug Resist Updat, 2004, 7(2): 97-110. DOI:10.1016/j.drup.2004.01.004 |
| [16] |
Dalla PE, Fiorini C, Dando I, et al. Role of mitochondrial uncoupling protein 2 in cancer cell resistance to gemcitabine[J]. Biochim Biophys Acta, 2012, 1823(10): 1856-1863. DOI:10.1016/j.bbamcr.2012.06.007 |
| [17] |
Mailloux RJ, Adjeitey CN, Harper ME. Genipin-induced inhibition of uncoupling protein-2 sensitizes drug-resistant cancer cells to cytotoxic agents[J]. PLoS One, 2010, 5(10): e13289. DOI:10.1371/journal.pone.0013289 |
| [18] |
Pons DG, Nadal-Serrano M, Torrens-Mas M, et al. UCP2 inhibition sensitizes breast cancer cells to therapeutic agents by increasing oxidative stress[J]. Free Radic Biol Med, 2015, 86: 67-77. DOI:10.1016/j.freeradbiomed.2015.04.032 |
| [19] |
Baffy G, Derdak Z, Robson SC. Mitochondrial recoupling:a novel therapeutic strategy for cancer?[J]. Br J Cancer, 2011, 105(4): 469-474. DOI:10.1038/bjc.2011.245 |
| [20] |
Echtay KS. Mitochondrial uncoupling proteins--what is their physiological role?[J]. Free Radic Biol Med, 2007, 43(10): 1351-1371. DOI:10.1016/j.freeradbiomed.2007.08.011 |
| [21] |
Valle A, Oliver J, Roca P. Role of uncoupling proteins in cancer[J]. Cancers (Basel), 2010, 2(2): 567-591. DOI:10.3390/cancers2020567 |
| [22] |
Sreekumar A, Nyati MK, Varambally S, et al. Profiling of cancer cells using protein microarrays:discovery of novel radiation-regulated proteins[J]. Cancer Res, 2001, 61(20): 7585-7593. |
| [23] |
Oleksiewicz U, Liloglou T, Tasopoulou KM, et al. COL1A1, PRPF40A, and UCP2 correlate with hypoxia markers in non-small cell lung cancer[J]. J Cancer Res Clin Oncol, 2017, 143(7): 1133-1141. DOI:10.1007/s00432-017-2381-y |
| [24] |
Jiang Y, Yang Y, Yang T, et al. Association of UCP2 rs659366 polymorphisms with the outcomes of patients after surgery for colorectal cancer[J]. J Zhejiang Univers(Med Sci), 2018, 47(2): 143-149. |
| [25] |
Robbins D, Zhao Y. New aspects of mitochondrial uncoupling proteins (UCPs) and their roles in tumorigenesis[J]. Int J Mol Sci, 2011, 12(8): 5285-5293. DOI:10.3390/ijms12085285 |
| [26] |
Dando I, Pacchiana R, Pozza ED, et al. UCP2 inhibition induces ROS/Akt/mTOR axis:Role of GAPDH nuclear translocation in genipin/everolimus anticancer synergism[J]. Free Radic Biol Med, 2017, 113: 176-189. DOI:10.1016/j.freeradbiomed.2017.09.022 |
| [27] |
Qiao C, Wei L, Dai Q, et al. UCP2-related mitochondrial pathway participates in oroxylin A-induced apoptosis in human colon cancer cells[J]. J Cell Physiol, 2015, 230(5): 1054-1063. DOI:10.1002/jcp.24833 |
 2020, Vol. 40
2020, Vol. 40


