肝癌是全球第6大癌症病因、第4大癌症死因[1]。我国肝癌发病率尤其高,每年新发病例约占55%[2]。随着放疗技术的发展,放疗已成为中晚期肝癌患者的重要治疗手段之一[3]。放疗在杀伤肿瘤细胞的同时,不可避免会损伤机体正常组织和细胞,也会引起远隔器官的损伤,使患者难以进行下一步治疗[4]。目前,辐射远隔效应(radiation-induced abscopal effect,RIAE)已成为一个研究热点,但无论是临床现象,还是分子机制,仍有待研究,肝癌患者接受放疗后是否引起远端未照射正常组织器官的损伤,尚少见报道。脾脏在免疫应答中发挥独特作用[5],大量文献报道,全身照射引起脾脏体积和质量减小,伴随免疫细胞下降[6],但关于辐射免疫损伤的成果多基于直接照射组织器官的研究。本研究通过建立小鼠皮下移植瘤肝癌模型,观察远端未受照器官脾脏结构与功能的变化,为临床肿瘤放疗引起的免疫系统变化提供新的实验基础。
1、材料与方法1.细胞培养:小鼠肝癌Hepa 1-6细胞株由上海交通大学附属仁济医院中心实验室赠予,培养于含10%胎牛血清(复旦大学IBS细胞资源中心)、100 U/ml青霉素、100 mg/ml链霉素(上海翊圣生物科技有限公司)的DMEM培养基(美国GIBCO公司)中,37℃、5%CO2培养。
2.动物来源及分组处理:C57BL/6 J雄性小黑鼠,体重为(22±2)g,6~8周龄,购于上海斯莱克实验动物有限责任公司(合格证号:20170005000979)。小鼠饲养在光照和温度适宜的环境下,所有动物实验操作均依照复旦大学实验动物伦理要求进行。
取对数生长期的小鼠肝癌细胞Hepa 1-6,消化后800×g离心5 min,稀释成1×108/ml,接种于小鼠右侧腹右前侧皮下,0.1 ml/只。待小鼠皮下瘤长至约100 mm3,剔除肿瘤体积差异较大的小鼠,进行后续实验。将荷瘤小鼠按随机数表法分为照射组和荷瘤对照组,照射组麻醉后将皮下肿瘤完全暴露于照射野,肿瘤以外部位以铅板完全遮挡屏蔽,使用X射线细胞辐照仪(X-RAD 320,美国PXI公司)对小鼠皮下肿瘤进行分割照射,每天8 Gy,连续3 d,剂量率为0.883 Gy/min,源皮距为60 cm。以未照射荷瘤小鼠为荷瘤对照组,除了未给照射剂量外,其余操作与照射组相同,另设10只健康小黑鼠为健康对照组。以照射后7、14 d为检测时间点,处死并解剖小鼠进行检测。
3.小鼠脏器指数测定:解剖小鼠后,取出肿瘤及位于左腹部的脾脏,计算脏器指数。肿瘤脏器指数=肿瘤重量(g)/体重(g)×100%;脾脏脏器指数=脾脏重量(g)/体重(g)×100%。
4.小鼠脾脏T淋巴细胞亚群检测:采取小鼠淋巴细胞分离液分离脾淋巴细胞[7]。在35 mm培养皿中加入4 ml淋巴细胞分离液,研磨脾脏,把培养皿中悬有脾脏细胞的分离液立即转移至15 ml离心管中,覆盖1 ml无血清RPMI 1640培养基(美国GIBCO公司);800×g离心30 min,吸取位于中间的白色絮状物至新的15 ml离心管,再加入8 ml无血清RPMI 1640培养基,250×g离心10 min,弃上清,加入PBS稀释细胞至1×107/ml;取100 μl细胞悬液加入1 μl CD3、0.5 μl CD4以及0.5 μl CD8单克隆荧光抗体染色,避光反应30 min后,加入适量PBS振荡混匀,800×g离心10 min弃上清,再加入1 ml PBS,振荡混匀细胞,以流式细胞仪检测各淋巴细胞组分。
5.小鼠脾脏B淋巴细胞亚群检测:采取上述方法得到淋巴细胞悬液,取100 μl细胞悬液加入1 μl CD3、1 μl CD19单克隆荧光抗体染色,避光反应30 min后,加入适量PBS振荡混匀,800×g离心10 min弃上清,再加入1 ml PBS,振荡混匀细胞,以流式细胞仪检测。
6.小鼠脾脏NK淋巴细胞亚群检测:采取上述方法得到淋巴细胞悬液,取100 μl细胞悬液加入1 μl CD3、1 μl CD49单克隆荧光抗体染色,避光反应30 min后,加入适量PBS振荡混匀悬浮细胞,800×g离心10 min弃上清,再加入1 ml PBS,振荡混匀细胞,以流式细胞仪检测。
7.小鼠脾脏组织病理学检测:取出脾脏后放入组织固定液中,固定24 h后梯度乙醇脱水,石蜡包埋,切片,厚度约5 μm,苏木精-伊红(HE)染色,光学显微镜下观察脾脏病理学改变。
8.统计学处理:采用Origin Pro 8软件进行分析,符合正态分布的结果用x±s表示,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2、结果1.肿瘤分割照射后小鼠脏器指数的变化:如表 1所示,分割照射后7 d,肿瘤脏器指数明显小于荷瘤对照组(t=4.649,P < 0.05);照后14 d,肿瘤脏器指数进一步减小(t=26.34,P < 0.05),说明X射线分割照射对肿瘤具有灭活作用;荷瘤对照组照后14 d的肿瘤脏器指数明显大于荷瘤对照组照后7 d(t=7.385,P < 0.05),说明Hepa 1-6细胞能够在小鼠皮下成瘤,可以此建立荷瘤鼠模型。同时,分割照射后7~14 d,小鼠脾脏脏器指数均有降低趋势,但差异无统计学意义(P>0.05);与健康对照组相比,荷瘤对照组小鼠脾脏脏器指数均显著增高(t=4.144、3.259,P < 0.05)。
|
|
表 1 肿瘤分割照射后荷瘤小鼠脏器指数的变化(%,x±s) Table 1 Changes of the organ indexes of tumor and spleen of mice after fractionated irradiation(%, x±s) |
2.脾脏B淋巴细胞的变化:与荷瘤对照组相比,肿瘤分割照射后B淋巴细胞(CD3-CD19+百分比)比例降低,但差异无统计学意义(P>0.05),可见分割照射对脾脏B淋巴细胞影响较小。但对于健康对照组,荷瘤组小鼠脾脏B淋巴细胞比例明显降低(t=9.18、17.82,P < 0.05),而且相较于荷瘤对照组照后7 d,荷瘤对照组照后14 d组小鼠脾脏B淋巴细胞比例进一步降低(t=12.83,P < 0.05),见图 1。
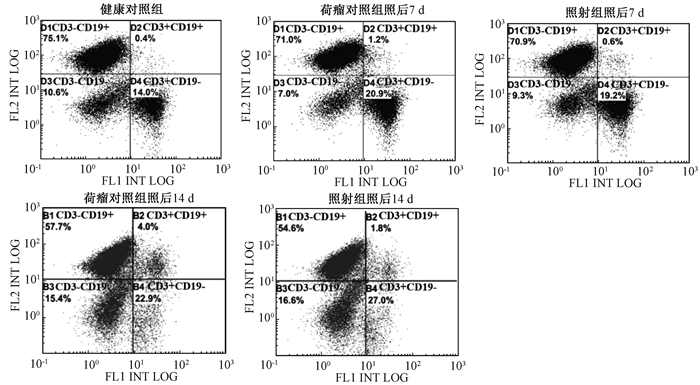
|
图 1 肿瘤分割照射后小鼠脾脏B淋巴细胞比例变化 Figure 1 Percentage of splenic B lymphocytes in mice after fractionated irradiation |
3.脾脏NK淋巴细胞的变化:肿瘤分割照射后,相较于荷瘤对照组,照后7 d及14 d小鼠脾脏NK淋巴细胞(CD3-CD49+百分比)比例显著增多(t=3.952、3.633,P < 0.05,图 2),可见分割照射引起了NK细胞比例的升高。相较于正常组,荷瘤组脾脏NK淋巴细胞比例升高(t=5.280、2.352,P < 0.05),但是荷瘤对照组照后14 d相较于荷瘤对照组照后7 d,脾脏NK淋巴细胞比例降低(t=2.841,P < 0.05)。
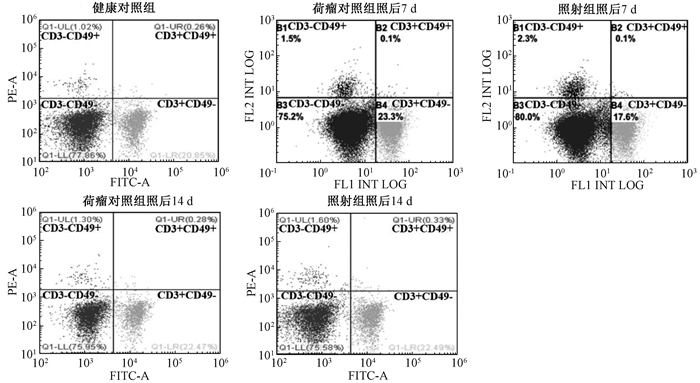
|
图 2 肿瘤分割照射后小鼠脾脏NK淋巴细胞比例变化 Figure 2 Percentage of splenic NK lymphocytes in mice after fractionated irradiation |
4.脾脏T淋巴细胞的变化:分割照射后小鼠脾脏内T淋巴细胞变化显著,见表 2。与荷瘤对照组照后7 d相比,照射组照后7 d组小鼠脾脏中CD3+、CD4+、CD3+CD4+淋巴细胞比例显著降低(t=3.193、3.656、3.219,P < 0.05);与荷瘤对照组照后14 d相比,照射组照后14 d组脾脏CD3+淋巴细胞比例显著降低(t=3.031,P < 0.05),其余淋巴细胞比例逐渐回升至对照水平。CD4+/CD8+比值照后7 d显著降低(t=2.641,P < 0.05),照后14 d有升高,但差异无统计学意义(P>0.05),可见分割照射引起了未照射脾脏T淋巴细胞损伤。另外,相较于荷瘤对照组照后7 d,荷瘤对照组照后14 d组中小鼠脾脏的CD8+、CD3+CD4+、CD3+CD8+淋巴细胞比例明显升高(t=5.678、2.649、6.354,P < 0.05),CD4+/CD8+比值显著降低(t=2.894,P < 0.05)。相较于健康对照组,荷瘤组小鼠脾脏中CD3+、CD4+、CD3+CD4+淋巴细胞比例显著降低,CD8+、CD3+CD8+淋巴细胞比例和CD4+/CD8+比值升高(t=1.053~12.96,P < 0.05)。
|
|
表 2 肿瘤分割照射后小鼠脾T淋巴细胞比例变化(%,x±s) Table 2 Percentage of splenic T lymphocytes in mice after fractionated irradiation(%, x±s) |
5.小鼠脾脏结构的变化:镜下观察发现,健康对照组脾脏红髓与白髓分界清晰,细胞排列整齐紧密;荷瘤组脾脏内白髓和红髓分界不清晰,边缘模糊,不易观察,且细胞排列紊乱,白髓区细胞间隙增大,红髓区充血明显,会引起脾脏的肿大,这与脾脏脏器指数变化相一致;照射组照后7 d脾脏结构破坏更为显著,白髓和红髓出现较多出血区和坏死区,照射组照后14 d稍有恢复,但是仍可见较多出血区(图 3)。
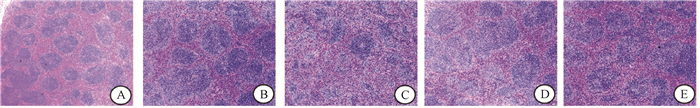
|
图 3 肿瘤分割照射后小鼠脾脏组织镜下观察HE染色×5 A.健康对照组;B.荷瘤对照组0 Gy照后7 d;C.照射组照后7 d;D.荷瘤对照组0 Gy照后14 d;E.照射组照后14 d Figure 3 The mice spleen tissues after fractionated irradiation HE staining ×5 A. Control group; B. Tumor-bearing control group at 7 d after 0 Gy irradiation; C. Irradiation group at 7 d after irradiation; D. Tumor-bearing control group at 14 d after 0 Gy irradiation; E. Irradiation group at 14 d after irradiation |
3、讨论
电离辐射对肿瘤有明显的杀伤作用,现代放疗技术的发展也使得放疗在肝癌治疗中充当越来越重要的角色,主要包括立体定向放疗、调强放疗、质子重离子治疗等,对肝癌有较好的局部控制率和生存率[8]。由于辐射旁效应的存在,受照射肿瘤细胞可以对周围未受辐射细胞产生一系列生物效应,包括基因突变、染色体断裂与突变、DNA损伤、细胞凋亡、炎症反应、细胞死亡等[9-10]。近年来,体内辐射旁效应引起了广泛重视。1953年,Mole等[11]观察到肿瘤患者接受局部放疗之后,位于照射野以外的转移瘤缩小甚至消失,这个现象被称为RIAE,虽然罕见,但在肺癌[12-13]、肝癌[14]等病例中可见。另一方面,也观察到一些未受照正常组织的损伤反应影响患者的预后[15-16],充分说明RIAE是一把双刃剑。临床上肿瘤放疗患者放射免疫损伤是常见问题,放疗会引起患者免疫系统损伤,引起外周血T淋巴细胞亚群的变化。然而,肿瘤局部放疗是否会对远隔免疫器官中的淋巴细胞亚群产生影响,少见报道。本研究通过建立小鼠肝癌移植瘤模型,观察肿瘤分割照射对未受照脾脏内淋巴细胞亚群分布的影响,分析其对免疫系统的影响。
脾脏是机体最大的免疫器官[5]。B淋巴细胞主要集中在脾脏,且富集在脾小体边缘与红髓区,主要参与体液免疫。临床研究发现,调强放疗后外周血B淋巴细胞较放疗前明显下降[17]。本实验发现照后脾脏脏器指数略有下降,B淋巴细胞也轻微降低,但差异无统计学意义。而相较于健康对照组,荷瘤对照组B淋巴细胞明显降低,随着肿瘤的增大,进一步降低,这可能是因为肿瘤进展,抑制免疫细胞,机体免疫力降低,形成免疫逃逸,进一步促进肿瘤恶化[18]。
NK细胞属于固有免疫细胞,在机体受到抗原和外界刺激时,快速应答[17]。有学者研究发现小剂量对NK细胞有促进作用,不断更新且有一定辐射抗性,大剂量会抑制其活性[19]。本研究显示,小鼠肝癌移植瘤受照后,照射组照后7、14 d脾脏NK细胞均显著升高,说明NK细胞具有一定的抗辐射能力,这可能是因为NK细胞中谷胱甘肽水平较高,能够在辐射应激后维持细胞内稳态[20],这提示可以利用这一特性,改善肿瘤患者放疗期间的免疫抑制状态。也有研究发现NK细胞联合放疗治疗在三阴性乳腺癌模型中具有长期的治疗和抗转移作用[21],这为RIAE发挥抗肿瘤作用提供了新思路。相较于健康对照组,荷瘤对照组小鼠脾脏NK细胞均显著增高,这可能是因为肿瘤促使NK细胞的免疫反应增强[22],而随着肿瘤的增长,NK细胞呈现降低趋势,这可能与肿瘤进展有关。
T淋巴细胞是肿瘤免疫中最关键的细胞亚群,分为CD4+T辅助细胞(Th)和CD8+T抑制细胞(Ts)两个亚群。Th细胞发挥促进作用,Ts细胞发挥抑制效应,CD4+CD8+通过动态平衡维持机体免疫[23]。本研究发现肝癌移植瘤经8 Gy ×3次分割照射后,脾脏T淋巴亚群明显改变,其中照射组照后7 d CD3+、CD4+、CD3+CD4+、CD3+CD8+淋巴细胞降低,CD8+淋巴细胞升高,而作为评价免疫系统损伤的指标CD4+/CD8+比值也显著降低,这证实淋巴细胞亚群受损,免疫系统受到损伤。照射组照后14 d虽然有所恢复,但仍未达到正常水平。相较于健康对照组,荷瘤对照组组脾脏T淋巴细胞受损显著,荷瘤对照组照后14 d比荷瘤对照组照后7 d CD8+淋巴细胞显著增高,CD4+/CD8+比值显著降低,CD8+T抑制细胞可破坏机体抗肿瘤机制并促进肿瘤产生,对肿瘤免疫反应起负调控作用。T细胞亚群的紊乱,使机体免疫监控功能下降, 识别肿瘤细胞的能力减弱,从而导致肿瘤细胞失控生长[24]。
总之,本研究发现局部分割照射小鼠肝癌组织,可引起小鼠未受照射远隔器官脾脏的结构与功能改变、脾脏淋巴细胞亚群改变,对免疫系统产生影响。这些变化可能会引起荷瘤小鼠放疗的不良预后。因此,在临床肿瘤放疗过程中或结束早期,可及时给予免疫调节治疗,使放疗发挥更好的疗效。
利益冲突 无
作者贡献声明 姚丹负责实验操作,撰写论文;张俊玲负责实验操作和数据分析;郑旺、陈倩萍、胡松玲协助实验操作;潘燕协助修改论文;邵春林指导课题设计和修改论文
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Kondo Y, Kimura O, Shimosegawa T. Radiation therapy has been shown to be adaptable for various stages of hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(1): 94-101. DOI:10.3748/wjg.v21.i1.94 |
| [4] |
Citrin DE. Recent developments in radiotherapy[J]. N Engl J Med, 2017, 377(22): 2200-2201. DOI:10.1056/NEJMc1713349 |
| [5] |
Zhao L, Liu L, Guo B, et al. Regulation of adaptive immune responses by guiding cell movements in the spleen[J]. Front Microbiol, 2015, 6: 645. DOI:10.3389/fmicb.2015.00645 |
| [6] |
Rageh MM, El-Gebaly RH, Abou-Shady H, et al. Melanin nanoparticles (MNPs) provide protection against whole-body γ-irradiation in mice via restoration of hematopoietic tissues[J]. Mol Cell Biochem, 2015, 399(1-2): 59-69. DOI:10.1007/s11010-014-2232-y |
| [7] |
何颖, 张俊玲, 赵忆宁, 等. 西咪替丁对伽马射线辐照小鼠免疫功能的保护作用[J]. 辐射研究与辐射工艺学报, 2018, 36(2): 22-28. He Y, Zhang JL, Zhao YN, et al. Protective effect of cimetidine on immune function of mice irradiated by gamma-rays[J]. J Radiat Res Radiat Process, 2018, 36(2): 22-28. DOI:10.11889/j.1000-3436.2018.rrj.36.020203 |
| [8] |
Das M. Individualised adaptive radiotherapy in liver cancer[J]. Lancet Oncol, 2017, 18(9): e520. DOI:10.1016/S1470-2045(17)30626-5 |
| [9] |
Tong L, Yu KN, Bao L, et al. Low concentration of exogenous carbon monoxide protects mammalian cells against proliferation induced by radiation-induced bystander effect[J]. Mutat Res, 2014, 759: 9-15. DOI:10.1016/j.mrfmmm.2013.11.006 |
| [10] |
Nuta O, Darroudi F. The impact of the bystander effect on the low-dose hypersensitivity phenomenon[J]. Radiat Environ Biophys, 2008, 47(2): 265-274. DOI:10.1007/s00411-007-0145-9 |
| [11] |
Mole RH. Whole body irradiation; radiobiology or medicine?[J]. Br J Radiol, 1953, 26(305): 234-241. DOI:10.1259/0007-1285-26-305-234 |
| [12] |
Kuroda A, Tabuchi T, Iwami E, et al. Abscopal effect of radiation on multiple lung metastases of lung adenocarcinoma:a case report[J]. BMC Cancer, 2019, 19(1): 336. DOI:10.1186/s12885-019-5566-8 |
| [13] |
Golden EB, Demaria S, Schiff PB, et al. An abscopal response to radiation and ipilimumab in a patient with metastatic non-small cell lung cancer[J]. Cancer Immunol Res, 2013, 1(6): 365-372. DOI:10.1158/2326-6066.CIR-13-0115 |
| [14] |
Okuma K, Yamashita H, Niibe Y, et al. Abscopal effect of radiation on lung metastases of hepatocellular carcinoma:a case report[J]. J Med Case Rep, 2011, 5: 111. DOI:10.1186/1752-1947-5-111 |
| [15] |
Siva S, Lobachevsky P, MacManus MP, et al. Radiotherapy for non-small cell lung cancer induces DNA damage response in both irradiated and out-of-field normal tissues[J]. Clin Cancer Res, 2016, 22(19): 4817-4826. DOI:10.1158/1078-0432.CCR-16-0138 |
| [16] |
Ǐgdem S, Alço G, Ercan T, et al. Insufficiency fractures after pelvic radiotherapy in patients with prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77(3): 818-823. DOI:10.1016/j.ijrobp.2009.05.059 |
| [17] |
杨婧, 高劲, 肖亮, 等. 调强放疗前后外周血淋巴细胞及其亚群的变化分析[J]. 安徽医科大学学报, 2019, 54(1): 102-107. Yang J, Gao J, Xiao L, et al. Analysis on the changes of lymphocytes and their subpopulations in the peripheral blood of patients with carcinoma after intensity modulated radiotherapy[J]. Acta Univ Med Anhui, 2019, 54(1): 102-107. DOI:10.19405/j.cnki.issn1000-1492.2019.01.020 |
| [18] |
刘荣花, 储以微. B细胞在抗肿瘤免疫中的双重作用[C].上海: 第十三届全国免疫学学术大会, 2018. Liu RH, Chu YW. Double function of B cell in anti-tumor immunity[C]. Shanghai: The 13th National Congress of Immunology, 2018. |
| [19] |
刘树铮. 辐射免疫学研究的回顾与展望[J]. 中华放射医学与防护杂志, 2005, 25(2): 193-200. Liu SZ. Review and prospect of radiation immunology[J]. Chin J Radiol Med Prot, 2005, 25(2): 193-200. DOI:10.3760/cma.j.issn.0254-5098.2005.02.048 |
| [20] |
Multhoff G, Meier T, Botzler C, et al. Differential effects of ifosfamide on the capacity of cytotoxic T lymphocytes and natural killer cells to lyse their target cells correlate with intracellular glutathione levels[J]. Blood, 1995, 85(8): 2124-2131. |
| [21] |
Kim KW, Jeong JU, Lee KH, et al. Combined NK cell therapy and radiation therapy exhibit long-term therapeutic and antimetastatic effects in a human triple negative breast cancer model[J].Int J Radiat Oncol Biol Phys, 2020, in press.DOI: 10.1016/j.ijrobp.2019.09.041.
|
| [22] |
赵美淇, 梁新强, 刘海洲, 等. 肿瘤患者外周血T淋巴细胞亚群及NK细胞比例检测的临床意义[J]. 中国实验诊断学, 2019, 23(3): 381-384. Zhao MQ, Liang XQ, Liu HZ, et al. Clinical significance of peripheral blood T lymphocyte subsets and NK levels in tumor patients[J]. Chin J Lab Diagn, 2019, 23(3): 381-384. DOI:10.3969/j.issn.1007-4287.2019.03.001 |
| [23] |
赵雯, 张子宁, 王亚男, 等. 2862例临床患者T淋巴细胞亚群检测结果分析[J]. 中国医科大学学报, 2012, 41(11): 1026-1029. Zhao W, Zhang ZN, Wang YN, et al. Analysis on distribution of T lymphocyte subset in 2862 clinical cases with various diseases[J]. J Chin Med Univ, 2012, 41(11): 1026-1029. DOI:10.3969/j.issn.0258-4646.2012.11.017 |
| [24] |
谭江峡. 外周血T淋巴细胞亚群与免疫球蛋白检测对肺癌病情监测及预后评价意义[J]. 现代仪器与医疗, 2015, 21(3): 90-92. Tan JX. Significance of detection of T lymphocyte subsets and immunoglobulins in peripheral blood for the monitoring and prognosis of lung cancer[J]. Mod Instrum Med Treat, 2015, 21(3): 90-92. DOI:10.11876/mimt201503033 |
 2020, Vol. 40
2020, Vol. 40


