2. 北京大学肿瘤医院暨北京市肿瘤防治研究所放疗科 恶性肿瘤发病机制及转化研究教育部重点实验室 100142
2. Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education/Beijing), Department of Radiation Oncology, Peking University Cancer Hospital & Institute, Beijing 100142, China
食管癌是临床常见的恶性肿瘤之一[1]。精准放疗在食管癌的早期根治、中晚期姑息以及无法手术切除等情况下均发挥不可或缺的重要作用[2]。由于食管癌靶区周围存在许多重要且敏感的正常器官, 如心、肺、脊髓、肝脏等, 放疗计划的设计难度较大。自动放疗计划技术的出现有效缓解了传统设计方法受物理师主观因素影响导致的效率低下、计划质量参差不齐等问题[3-9]。Eclipse放疗计划系统中集成的RapidPlan模块, 是基于机器学习技术的自动计划设计方法[10]。利用历史数据中提取的剂量分布、解剖结构、布野条件等数据建立的预测模型, 可以实现对新患者的个体化剂量预测和自动优化[11]。
本研究探索在复杂处方和解剖分段条件下建立整合RapidPlan模型的策略, 不仅有助于解决临床放疗中面临的效率、质量和一致性等实际问题, 也有利于推动基于机器学习的自动计划技术的发展, 实现跨中心建模和复杂应用场景的拓展等。本工作拟针对解决这一问题的可行性及方法进行探讨, 并评估整合模型的剂量学特性。
材料与方法1. RapidPlan模型的建立:本工作基于美国瓦里安15.6版本Eclipse计划系统(Varian Medical Systems, Palo Alto, CA), 为了使不同解剖分段(包括不同分段的衔接和过渡)的病例均有足够的数据用于训练RapidPlan模型, 本工作收集了北京大学肿瘤医院2017年8月至2020年6月期间完成食管癌放疗的301例患者计划作为训练集, 其中男性255例(84.72%), 女性46例(15.28%), 中位年龄64岁, 范围38~92岁。患者包含了广泛的解剖分段, 其中颈上段食管癌26例(8.64%), 胸中上段食管癌129例(42.86%), 胸中下段食管癌(含食管胃结合部癌17例)73例(24.3%), 全段食管癌64例(21.3%), 食管癌锁骨淋巴结或腹腔淋巴结转移9例(3%)。模型训练集还包含了复杂的处方剂量[12-16]。其中同步推量处方包含60 Gy/50.4 Gy(123例, 40.86%)、60 Gy/54 Gy(36例, 11.96%)、50 Gy/45 Gy(15例, 5%)、46 Gy/41.4 Gy(28例, 9.3%)、56 Gy/50.4 Gy(18例, 6%)、54 Gy/50.4 Gy(10例, 3.3%)等。单一处方包括60、50.4、45、54 Gy等, 共计53例, 占17.61%, 其余处方12例, 占4%, 该训练集数据广泛包括了不同分期、各解剖分段和复杂的处方剂量多样性等。
模型框架整合了各解剖分段和复杂靶区勾画方式下的结构和器官, 其中靶区结构包括:大体肿瘤靶区(GTV,包含原发肿瘤及受累区域的淋巴结)及其外扩5 mm所得的计划大体肿瘤靶区(PGTV);临床靶区(CTV,镜下病变风险的区域)及其外扩5 mm所得的计划靶区(PTV);还有涉及淋巴结GTVnd及PGTVnd。此外, 由于食管贯穿整个纵隔, 毗邻危及器官较多, 整合模型涵盖的危及器官包括双肺、心脏、脊髓及其外扩5 mm(脊髓+5 mm)、肝脏、肾脏、胃和肠。将301例训练集病例导入该模型, 把各结构与模板中相应的标签代码进行匹配, 并按照算法要求输入最高处方剂量。提取训练集数据后进行模型的初步训练, 随后参照Model Analytics的分析报告[17]和各统计学参数对模型进行统计学验证, 再根据具体情况合理处置离群值, 优化条件的设置和计划的评估均按照《2019美国国家综合癌症网络(NCCN)指南食管和食管胃结合部癌(第2版)》[18]结合本地临床要求进行。
2.模型独立验证:在建模病例之外, 本工作另选取了40例不同分段食管癌患者的数据用于独立验证, 验证集患者于2016年7月至2020年7月间在本院完成食管癌放疗, 其中男性37例(92.5%), 女性3例(7.5%), 中位年龄61.5岁(范围45~85岁)。靶区分段:颈上段食管癌4例, 占10%;胸中上段食管癌25例, 占62.5%;胸中下段食管癌(含食管胃结合部癌1例)10例, 占25%;食管癌锁骨淋巴结转移1例, 占2.5%。处方剂量:同步推量60 Gy/50.4 Gy 12例, 占30%;60 Gy/54 Gy 3例, 占7.5%;50 Gy/45 Gy 3例, 占7.5%;46 Gy/41.4 Gy 5例, 占12.5%;56 Gy/50.4 Gy 3例, 占7.5%;54 Gy/50.4 Gy 5例, 占12.5%;55 Gy/45 Gy 2例, 占5%。其余处方7例, 占17.5%。验证集的解剖分段和处方具有较好的代表性和丰富的多样性, 能够测试模型在复杂条件下的表现。验证集规模与文献报道相当或略多[19-20], 可以为模型参数的调试提供足够的反馈数据。复制临床计划并保持其中射野条件、光子能量、加速器配置及原有剂量算法等不变。利用上述已建立的模型预测该40例验证病例可能实现的DVH区间, 并生成新的个体优化参数。为减少人为因素对实验的影响, 优化过程中不对参数进行任何人工调整。优化结束后对靶区剂量进行归一, 使其与临床计划相似以便比较危及器官剂量。
3.计划评估:为评估RapidPlan自动优化结果相对于人工计划的表现, 对下述剂量学参数进行比较:PGTV和PTV的均匀性指数(HI),HI=(D2%-D98%)/D50%,HI越大,表示靶区内的剂量分布越不均匀;PTV适形度指数(conformity index,CI),CI=V100%Rx/Vtarget;CI越接近于1表示靶区的适形度越好。其中Dx%表示X%的体积对应的剂量;V100%Rx表示处方剂量所包括的体积;Vtarget表示靶区的体积。对于危及器官, 按照指南和临床要求统计Vx Gy, 即接受最小剂量为x Gy的体积;Dx cm3,即x cm3体积接受的最小剂量;Dmean,平均剂量;Dmax,最大剂量。
4.统计学处理:将Eclipse中导出的文本格式DVH数据传至自编Python程序中, 用于自动提取剂量学参数, 并计算40例患者的平均DVH数据, 由于处方不同, 平均DVH中采用相对剂量值, 并利用SigmaPlot软件绘制平均DVH图。利用SPSS 25.0软件对数据进行正态性检验(Kolmogorov-Smirnov检验), 符合正态分布的数据采用配对t检验, 反之采用非参数Wilcoxon检验。P < 0.05为差异有统计学意义。
结果1.模型的建立和调试评估:由于样本量充足, 数量多于建立常规模型所需的训练集以及此前相关的文献报道规模[21], 处理完离群值后的模型依然保证了不同靶区分段对应的各个危及器官均有不少于44例数据用于主成分分析建模, 最多的器官达到了299例匹配, 远高于算法对于20个病例的最少要求。另一方面, 为应对复杂的同步推量处方构成, 靶区匹配过程并未完全依照名称进行, 而是参照了该靶区与本患者最高处方剂量的比例关系, 以保证归一后的相对剂量能为危及器官的模型建立提供统一的参照。由于RapidPlan不对靶区剂量分布进行预测,相应固定优化参数在建模过程中由人工预设, 主要包含分别控制剂量冷点和热点的下限值和上限值。为适应食管癌不同的处方剂量需求, 靶区优化条件全部按相对剂量值设置。在危及器官优化条件设置方面, 则主要由模型基于新患者的解剖结构、布野信息和处方要求生成个体优化条件, 并根据病例验证结果对模型参数进行调试和迭代优化, 必要时再辅以固定条件。结果证明, 上述设置方法有效保障了整合模型能够在复杂解剖分段和处方条件下正确处理数据拟合和剂量预测。
模型一共经过5轮ModelAnalytics工具辅助下的清洗和迭代优化, 其间分步骤、逐轮排除了结构匹配异常、处方剂量错误, 以及几何离群值(modified Z-score, mZ>3.5)、剂量离群值(studentized residual values, SR>3.0)、强影响点(cook′s distance, CD>10)处置等清洗过程。其中几何离群值的处置尽可能保留了模型的多样性和代表性, 以适应未来模型应用过程中可能面对的复杂场景。对于剂量离群值, 则尽量通过重新优化的方式改善计划质量并重新加入模型, 调试后的模型使得每个危及器官的可决系数R2大于或接近0.7。
2.验证集和模型优化效果评估:复制验证集临床计划并保持布野等条件不变, 由RapidPlan模型生成的个体优化参数进行无人工干预的自动优化, 对结果进行归一以使靶区剂量覆盖相似且符合临床处方要求, 40例验证病例经RapidPlan自动优化, 结果全部一次性符合评估要求, 表明整合模型可以有效应对复杂靶区的解剖分段和多种处方要求等临床应用场景。为了更清晰展示RapidPlan和临床计划的区别, 两组计划心、肺、脊髓、肝、左右肾、胃及肠的平均DVH比较见图 1, 两组计划剂量参数定量汇总比较见表 1。PTV、HI、心脏V40和Dmean、Body Dmax、跳数差异有统计学意义(t=-4.17, Z=-2.38, t=2.24、-3.42, Z=-3.54, P < 0.05)
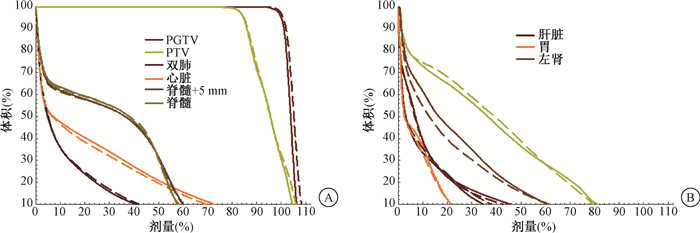
|
注:实线代表临床计划,虚线代表RapidPlan,脊髓+5 mm代表脊髓外扩5 mm范围 图 1 两组食管癌放疗计划的DVH比较 Figure 1 Inter-group comparison of average DVHs of esophageal cancer radiotherapy |
|
|
表 1 食管癌放疗RapidPlan与临床计划剂量学参数比较(x±s) Table 1 Dosimetric comparison of clinical plans vs. RapidPlan re-optimization in esophageal cancer radiotherapy(x±s) |
讨论
相对于其他肿瘤, 建立食管癌RapidPlan模型存在诸多挑战和特点。首先, 食管长度跨越颈、胸、上腹部, 靶区位置差异会导致放疗计划关注的危及器官种类和剂量限值大不相同, 这对基于各个危及器官分别建模的RapidPlan来说构成巨大挑战, 比如颈段和上腹部食管癌计划中的肺剂量远低于胸段, 容易在模型中产生强影响点和离群值[22-26];其次, 由于不同的分期、位置、分型等原因, 食管癌计划的处方剂量不尽相同, 这对基于处方归一并进行相对剂量预测的RapidPlan模型建立来说也是巨大挑战。虽然分别针对不同的处方和解剖分段单独建立模型可以解决上述问题[27], 但该方法不仅效率相对低下, 而且受限于每组训练集病例的数量减少, 对模型应用过程的拓展性和可推广性也会造成不利影响, 比如胸段食管癌模型无法在颈胸段的病例中应用等。
基于机器学习技术的自动放疗计划设计, 对模型训练集数据的标准化和一致性具有较高的要求。然而, 食管癌的解剖特点和放疗处方剂量均相对复杂, 如根据不同治疗目的, 如术前新辅助放化疗、术后辅助放疗、根治性放疗、姑息性放疗, 临床通常会给予不同的处方剂量。以中国食管癌诊疗规范为依据, 食管癌患者根治性放疗多采用60 Gy的处方剂量, 而依据美国国家综合癌症网络(NCCN)指南推荐, 对无法手术的食管癌患者行根治性放疗的处方剂量为50.4 Gy。这对RapidPlan模型的构建造成了一定挑战。本工作通过扩大训练集样本量构成的方法, 解决了不同靶区分段对应的危及器官差异的问题, 同时采用按相对剂量比例匹配靶区的策略, 应对了复杂同步推量处方给建模带来的挑战, 成功建立了食管癌整合模型, 避免了对各解剖分段单独建模导致的效率低下和适应范围有限等问题。
40例验证患者平均DVH图表明, RapidPlan自动计划相较于人工制定的临床计划, 在不同的危及器官保护方面各有优势。这可能是由于RapidPlan针对各个危及器官单独建模, 而应用的过程中各危及器官之间又处于相互竞争的关系, 导致两组计划的平均DVH曲线存在交叉。传统的计划设计是一个反复优化试错的过程, 不仅非常耗时, 而且计划的质量往往依赖于计划设计者的经验和技巧。RapidPlan自动计划设计不仅大幅提高了效率, 而且人工干预程度显著降低, 有利于缩小基层医院、不同年资的物理师计划质量存在的差异性。从本研究结果可以看出,RapidPlan的平均计划总跳数少于人工计划, 表明自动计划对射线的利用效率更高, 在避免过度调制的同时, 也有利于降低因准直器透漏和散射造成的额外正常器官剂量[28]。本工作提出了在复杂解剖分段和处方条件下建立食管癌自动放疗计划整合RapidPlan模型的方法, 并基于独立病例验证了其可行性和剂量学表现。
利益冲突 无
志谢 感谢北京大学医学部教育教学研究项目(2020YB34)和瓦里安科研基金对本研究的资助
作者贡献声明 陈艳进行实验、收集分析数据与论文撰写;王海洋、刘宏嘉协助实验与数据收集;王美娇、李莎、蒲亦晨协助数据处理;韩建军、何君、贾冬协助数据收集;吴昊提供实验平台与实验指导;张艺宝负责方法建立、研究过程指导和论文审阅
| [1] |
欧静, 陈天武, 唐隼, 等. 食管癌影像组学研究现状[J]. 国际医学放射学杂志, 2019, 42(4): 438-442. Ou J, Chen TW, Tang S, et al. Current status of radiomics in esophageal cancer[J]. Int J Med Radiol, 2019, 42(4): 438-442. DOI:10.19300/j.2019.Z6958 |
| [2] |
孔雁, 高红梅. 食管癌放射治疗10年生存分析及不同治疗方式的疗效比较[J]. 肿瘤防治研究, 2015, 42(1): 56-61. Kong Y, Gao HM. Long outcome of radiotherapy for esophageal carcinoma and efficacy comparison of different treatment methods[J]. Cancer Res Prev Treat, 2015, 42(1): 56-61. DOI:10.3971/j.issn.1000-8578.2015.01.014 |
| [3] |
Appenzoller LM, Michalski JM, Thorstad WL, et al. Predicting dose-volume histograms for organs-at-risk in IMRT planning[J]. Med Phys, 2012, 39(12): 7446-7461. DOI:10.1118/1.4761864 |
| [4] |
Wu B, McNutt T, Zahurak M, et al. Fully automated simultaneous integrated boosted-intensity modulated radiation therapy treatment planning is feasible for head-and-neck cancer:a prospective clinical study[J]. Int J Radiat Oncol Biol Phys, 2012, 84(5): e647-653. DOI:10.1016/j.ijrobp.2012.06.047 |
| [5] |
Wu B, Pang D, Lei S, et al. Improved robotic stereotactic body radiation therapy plan quality and planning efficacy for organ-confined prostate cancer utilizing overlap-volume histogram-driven planning methodology[J]. Radiother Oncol, 2014, 112(2): 221-226. DOI:10.1016/j.radonc.2014.07.009 |
| [6] |
Moore KL, Schmidt R, Moiseenko V, et al. Quantifying unnecessary normal tissue complication risks due to suboptimal planning:a secondary study on RTOG0126[J]. Int J Radiat Oncol Biol Phys, 2015, 92(2): 228-235. DOI:10.1016/j.ijrobp.2015.01.046 |
| [7] |
Yang Y, Ford EC, Wu B, et al. An overlap-volume-histogram based method for rectal dose prediction and automated treatment planning in the external beam prostate radiotherapy following hydrogel injection[J]. Med Phys, 2013, 40(1): 011709. DOI:10.1118/1.4769424 |
| [8] |
Wu B, Pang D, Simari P, et al. Using overlap volume histogram and IMRT plan data to guide and automate VMAT planning:a head-and-neck case study[J]. Med Phys, 2013, 40(2): 021714. DOI:10.1118/1.4788671 |
| [9] |
Lian J, Yuan L, Ge Y, et al. Modeling the dosimetry of organ-atrisk in head and neck IMRT planning:an intertechnique and interinstitutional study[J]. Med Phys, 2013, 40(12): 121704. DOI:10.1118/1.4828788 |
| [10] |
Sharpe MB, Moore KL, Orton CG. Within the next ten years treatment planning will become fully automated without the need for human intervention[J]. Med Phys, 2014, 41(12): 120601. DOI:10.1118/1.4894496 |
| [11] |
Zarepisheh M, Long T, Li N, et al. A DVH-guided IMRT optimization algorithm for automatic treatment planning and adaptive radiotherapy replanning[J]. Med Phys, 2014, 41(6): 061711. DOI:10.1118/1.4875700 |
| [12] |
张芹, 吴培培, 苗亚丽, 等. 同步整合加量调强放疗治疗颈及胸上段食管癌的临床观察[J]. 现代肿瘤医学, 2017, 25(10): 61-64. Zhang Q, Wu PP, Miao YL, et al. The clinical observation of the imultaneously integrated boost intensity-modulated radiotheragy in cervical and upper thoracic esophageal carcinoma[J]. J Mode Oncol, 2017, 25(10): 61-64. DOI:10.3969/j.issn.1672-4992.2017.10.014 |
| [13] |
任雪姣, 王澜, 韩春, 等. 食管鳞癌同期放化疗模式下高剂量与常规剂量放疗的疗效和安全性比较[J]. 中华肿瘤杂志, 2019, 41(2): 135-139. Ren XJ, Wang L, Han C, et al. The efficacy and safety of high dose versus standard dose radiotherapy in concurrent chemoradiotherapy for patients with esophageal squamous cell carcinoma[J]. Chin J Oncol, 2019, 41(2): 135-139. DOI:10.3760/cma.j.issn.0253-3766.2019.02.011 |
| [14] |
程欣宇, 吴慧, 张瑞瑞, 等. 307例Ⅱ-Ⅲ期食管癌同期放化疗预后分析[J]. 中华放射肿瘤学杂志, 2018, 27(2): 140-144. Cheng XY, Wu H, Zhang RR, et al. Analysis of outcomes and prognostic factors in 307 stages Ⅱ-Ⅲ esophageal cancer patients treated with concurrent chemoradiotherapy[J]. Chin J Radiat Oncol, 2018, 27(2): 140-144. DOI:10.3760/cma.j.issn.1004-4221.2018.02.004 |
| [15] |
Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123(Radiation Therapy Oncology Group 94-05) phase Ⅲ trial of combined-modality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy[J]. J Clin Oncol, 2002, 20(5): 1167-1174. DOI:10.1200/JCO.2002.20.5.1167 |
| [16] |
Xiao L, Czito BG, Pang Q, et al. Do higher radiation doses with concurrent chemotherapy in the definitive treatment of esophageal cancer improve outcomes? a Meta-analysis and systematic review[J]. J Cancer, 2020, 11(15): 4605-4613. DOI:10.7150/jca.44447 |
| [17] |
王美娇, 李莎, 岳海振, 等. Model Analytics辅助的智能放疗计划建模[J]. 中国医学物理学杂志, 2017, 34(9): 870-873. Wang MJ, Li S, Yue HZ, et al. Modeling for knowledge-based plan assisted with Model Analytics[J]. Chin J Med Phys, 2017, 34(9): 870-873. DOI:10.3969/j.issn.1005-202X.2017.09.002 |
| [18] |
Ajani JA, D'Amico TA, Bentrem DJ, et al. Esophageal and esophagogastric junction cancers, version 2.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(7): 855-883. DOI:10.6004/jnccn.2019.0033 |
| [19] |
王海洋, 吴昊, 项小羽, 等. 肺癌立体定向放疗RapidPlan商业模型的本地改造可行性探究[J]. 中华放射医学与防护杂志, 2020, 40(3): 203-208. Wang HY, Wu H, Xiang XY, et al. A feasibility study of local adaptation of lung SBRT RapidPlan commercial model[J]. Chin J Radiol Med Prot, 2020, 40(3): 203-208. DOI:10.3760/cma.j.issn.0254-5098.2020.03.008 |
| [20] |
吴昊, 蒋璠, 岳海振, 等. 瓦里安RapidPlan模型训练中统计离群值的处理及其剂量学影响[J]. 中国医学物理学杂志, 2016, 33(7): 649-653. Wu H, Jiang F, Yue HZ, et al. Statistical outlier processing and dosimetric effect in VarianRapid plan model verification[J]. Chin J Med Phys, 2016, 33(7): 649-653. DOI:10.3969/j.issn.1005-202X.2016.07.001 |
| [21] |
Boutilier JJ, Craig T, Sharpe MB, et al. Sample size requirements for knowledge-based treatment planning[J]. Med Phys, 2016, 43(3): 1212-1221. DOI:10.1118/1.4941363 |
| [22] |
Boutilier JJ, Babier ADC, Craig T, et al. MO-G-201-02:comparing sample size requirements for knowledge-based treatment planning[J]. Med Phys, 2016, 43(6): 3724. DOI:10.1118/1.4957368 |
| [23] |
Delaney AR, Tol JP, Dahele M, et al. Effect of dosimetric outliers on the performance of a commercial knowledge-based planning solution[J]. Int J Radiat Oncol Biol Phys, 2016, 94(3): 469-477. DOI:10.1016/j.ijrobp.2015.11.011 |
| [24] |
Sheng Y, Ge Y, Yuan L, et al. Outlier identification in radiation therapy knowledge-based planning:a study of pelvic cases[J]. Med Phys, 2017, 44(11): 5617-5626. DOI:10.1002/mp.12556 |
| [25] |
Fusella M, Scaggion A, Pivato N, et al. Efficiently train and validate a RapidPlan model through APQM scoring[J]. Med Phys, 2018, 45(6): 2611-2619. DOI:10.1002/mp.12896 |
| [26] |
Alpuche Aviles JE, Cordero Marcos MI, Sasaki D, et al. Creation of knowledge-based planning models intended for large scale distribution:minimizing the effect of outlier plans[J]. J Appl Clin Med Phys, 2018, 19(3): 215-226. DOI:10.1002/acm2.12322 |
| [27] |
Fogliata A, Nicolini G, Clivio A, et al. A broad scope knowledge based model for optimization of VMAT in esophageal cancer:validation and assessment of plan quality among different treatment centers[J]. Radiat Oncol, 2015, 10: 220. DOI:10.1186/s13014-015-0530-5 |
| [28] |
Mohan R, Jayesh K, Joshi RC, et al. Dosimetric evaluation of 120-leaf multileaf collimator in a Varian linear accelerator with 6-MV and 18-MV photon beams[J]. J Med Phys, 2008, 33(3): 114-118. DOI:10.4103/0971-6203.42757 |
 2020, Vol. 40
2020, Vol. 40


