2. 石家庄市第三医院肾内科 050011
2. Department of Nephrology, Third Hospital of Shijiazhuang, Shijiazhuang 050011, China
食管癌是常见的消化系统恶性肿瘤,在我国以食管鳞癌为主[1]。随着人均寿命的延长及老龄化进程加快,30%~40%的食管癌患者明确诊断时年龄≥75岁[2]。该患病人群常常因器官功能下降及并发其他疾病而无法行手术治疗,甚至部分适合手术切除的患者仍会拒绝该治疗方式,因此根治性放疗或放化疗成为主要治疗手段[3]。既往研究发现,高龄与营养不良为食管癌患者不良预后的危险因素,而临床诊治中高龄食管癌患者常常伴有不同程度的营养不良[4-5]。临床常用的营养评估指标有体质量指数(BMI)、老年营养风险指数(geriatric nutritional risk index,GNRI)、血红蛋白水平等,本研究拟分析高龄食管癌患者的营养状况指标与近期疗效及生存预后的关系,以期可为临床治疗提供预后相关信息及个体化诊疗思路。
资料与方法1.临床资料:回顾性分析河北医科大学第四医院2007—2013年食管癌患者病历资料。纳入标准:入组患者经病理证实且资料完善的食管鳞癌患者,年龄≥75岁;KPS评分≥70,既往无肝肾疾病,无血液系统及免疫系统疾病;拒绝手术或存在手术禁忌证,完成根治性放疗或放化疗;按照2002美国癌症联合会(AJCC)分期标准,排除远处器官转移患者,即M1B期。最终共197例患者符合入组标准,其中男119例,女78例;中位年龄78岁(75~97岁);食管胸上、中、下段癌分别为46、95、56例。
2.放疗靶区及计划:根据CT图像结合X射线钡餐造影、纤维胃镜结果勾画食管大体肿瘤靶区(GTV),其标准为食管壁厚度>0.5 cm或不含气管腔直径>1.0 cm;临床靶区(CTV)为GTV上下外扩1.5~2.0 cm,轴向外扩0.5~1.0 cm;计划靶区(PTV)为CTV外扩0.5~0.8 cm。纵隔转移淋巴结(GTVnd)的勾画标准为淋巴结短径≥1.0 cm,食管旁、气管食管旁沟、心膈角、腹腔淋巴结的勾画标准为长径≥0.5 cm。转移淋巴结PTVnd为GTVnd外扩1.0 cm。全组PTV/PTVnd处方剂量56~66 Gy,中位剂量60 Gy,1.8~2 Gy/次,1次/d,5次/周。
3.化疗方案:遵循患者意愿及评分[美国东部肿瘤协作组(ECOG)评分为0~1分]给予化疗,化疗采用放疗同步化疗或放疗后序贯化疗。LFP方案(亚叶酸钙200 mg/次,第1~5天+替加氟1.0 g/次,第1~5天+顺铂20 mg/次,第1~5天)或TP方案(紫杉醇135 mg/m2,第1天+顺铂75 mg/m2,第1天)。全组接受化疗者共22例(主要为75~78岁,其中75岁14例),其中同步化疗者3例,序贯化疗者19例。
4.观察指标收集:于放疗前及放疗结束1周内检测患者血常规和生化全项,分别得到中性粒细胞、淋巴细胞、血红蛋白、血清白蛋白等指标计数。量取患者身高及放疗前、放疗结束1周内体重数据。
观察指标:①GNRI=1.489×血清白蛋白水平(g/L) + 41.7 × (体重/理想体重)[6]。GNRI的风险等级分4级[7](正常:GNRI>98;低风险:92≤GNRI≤98;中风险:82≤GNRI < 92;高风险:GNRI < 82)。理想体重=22×身高(m)×身高(m)(Lorentz公式)。本研究以GNRI评分98分为临界值,将患者分为正常组(GNRI>98分)和异常组(GNRI≤98分)。②BMI=体重/身高的平方(kg/m2),按照世界卫生组织(WHO)2000年标准分为3类:低体重(BMI < 18.5 kg/m2),正常体重(18.5≤BMI<22.9 kg/m2),超重(BMI≥23 kg/m2)。③中性粒细胞与淋巴细胞比值(NLR),以放疗前及放疗后NLR各自的中位数为界依次将患者分为放疗前NLR>4.74组和NLR≤4.74组,放疗后NLR>2.93组和NLR≤2.93组。④血红蛋白:依据本院检验科正常范围对血红蛋白指标进行分组,男性130~175 g/L为正常水平,女性115~150 g/L为正常水平。
5.不良反应、近期疗效及随访:依据美国肿瘤放射治疗协作组织(RTOG)急性放射损伤分级标准对入组患者不良反应进行评价,时间从放疗开始至结束后3个月内。放射治疗结束及结束后1个月分别复查食管钡餐造影和胸及上腹部CT进行近期疗效评价,评价依据实体瘤疗效评价标准(RECIST 1.1),分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD),客观缓解率=CR率+PR率。放疗后前2年每3个月常规复查1次,2年后每6个月复查1次。随访以电话随访及门诊复查为主。
6.统计学处理:采用SPSS 13.0统计软件进行数据处理,Kaplan-Meier法对生存时间行单因素预后分析,Cox回归模型行多因素预后分析。观察指标与放疗近期疗效间关系单因素及多因素分析分别使用卡方检验和logistic法检验。P<0.05为差异有统计学意义。
结果1.生存情况:全组共197例患者,截止至2018年1月,中位随访时间16.5个月,失访5例,死亡170例。死亡患者中,局部复发者89例,远处转移者55例,局部复发同时远处转移者16例,食管癌以外疾病者8例,死因不明者2例。全组患者1、3、5年总生存率分别为64.0%、25.1%、10.8%,中位总生存时间(OS)18.0个月;1、3、5年无进展生存率分别为47.6%、18.2%、7.9%,中位无进展生存时间(PFS)13.1个月。
2. GNRI评分与食管癌患者预后的关系:放疗前GNRI正常组1、3、5年OS分别为64.0%、20.0%、11.1%,异常组分别为63.8%、13.8%、9.8%,差异无统计学意义(P>0.05)。放疗前GNRI正常组1、3、5年PFS分别为48.8%、20.7%、8.7%,异常组分别为44.8%、12.4%、6.2%,差异无统计学意义(P>0.05)。
放疗后GNRI正常组1、3、5年OS分别为73.5%、42.4%、17.0%,异常组分别为58.9%、15.8%、7.4%,差异有统计学意义(χ2=12.316,P<0.05)。放疗后GNRI正常组1、3、5年PFS分别为60.3%、29.8%、16.2%,异常组分别为40.9%、11.9%、3.7%,差异有统计学意义(χ2=14.617,P<0.05),见图 1。
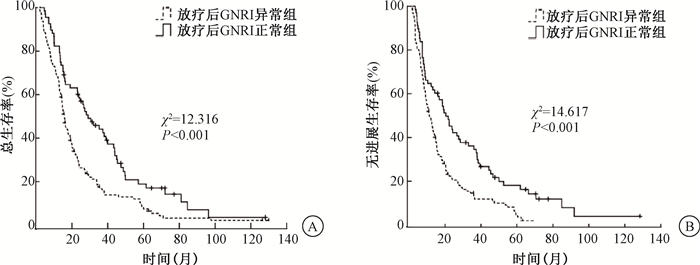
|
图 1 197例老年食管癌患者不同GNRI分组的1、3、5年总生存(A)与无进展生存(B)曲线 Figure 1 OS(A) and PFS(B) curves of 197 old patients with ESCC in different GNRI groups |
2.总生存时间(OS)的影响因素分析:单因素分析显示,T、N、TNM分期、GTV体积、放疗前NLR及放疗后的BMI、血红蛋白水平、GNRI与OS相关(χ2=6.569~22.434, P<0.05),见表 1。以OS为因变量,以单因素分析有统计学意义的因素为自变量,将各因素纳入Cox风险比例模型,结果显示,T分期晚、N分期晚、GTV体积大、放疗前NLR较高、放疗后的血红蛋白低于正常水平、放疗后GNRI评分低于正常水平为影响患者OS的独立危险因素(P<0.05),见表 2。
|
|
表 1 197例老年食管癌患者临床及营养指标的单因素预后分析 Table 1 The univariate analysis of clincal characteristics and nutritional index in 197 elderly patients with ESCC |
|
|
表 2 影响197例老年食管癌患者OS的Cox多因素分析 Table 2 The Cox regression analysis of OS in 197 elderly patients with ESCC |
4.无进展生存时间(PFS)的影响因素分析:单因素分析显示,T分期、GTV、放疗前NLR及放疗后的BMI、血红蛋白水平、GNRI与PFS相关(χ2=4.579~18.990, P<0.05),见表 1。以PFS为因变量,以单因素分析有统计学意义的因素为自变量,将各因素纳入Cox风险比例模型,结果显示,放疗前NLR较高、放疗后的血红蛋白低于正常水平、放疗后GNRI评分低于正常水平为影响患者PFS的独立危险因素(P<0.05),见表 3。
|
|
表 3 影响197例老年食管癌患者PFS的Cox多因素分析 Table 3 The Cox regression analysis of PFS in 197 elderly patients with ESCC |
5.临床及营养指标与近期疗效关系:全组患者近期疗效评价:CR 20例,PR 73例,SD 85例,PD 19例,客观缓解率为47.21%(93/197)。单因素分析显示,T分期、N分期、GTV、放疗前NLR及放疗后的血红蛋白水平、GNRI均与近期疗效相关(χ2=7.716、5.300、6.269、7.781、19.396、9.467,P < 0.05),其余指标与近期疗效未见明显相关性(P>0.05)。将单因素分析有统计学意义的指标纳入多因素分析,结果显示T分期、放疗后的血红蛋白水平、GNRI均为影响患者近期疗效的独立相关因素(χ2=4.716、13.083、4.519,P < 0.05),其中,放疗后血红蛋白水平正常、GNRI评分正常患者可获得更好的近期疗效。
6.放射性损伤:全组患者急性放射性食管炎发生率为68.02%(134/197),其中1、2、3、4级分别为66、54、9、5例;急性放射性肺炎发生率为48.73%(96/197),其中1、2、3、4级分别为50、30、11、5例。≥2级急性放射性损伤的发生率为49.24%(97/197),其中≥2级急性放射性食管炎51例,≥2级急性放射性肺炎29例,同时合并者17例。
讨论食管癌患者以进食时吞咽不适为主要表现,严重者只能进流食,甚至无法进食,导致营养状况下降,而老年食管癌患者更甚,进而影响治疗的实施及疾病的预后。另外,研究表明恶性肿瘤患者的不良营养状况可影响机体的免疫功能,非特异性及特异性免疫均受影响,进而诱发机体炎症反应紊乱,最终影响肿瘤的治疗及预后[7]。
近期多项研究发现,老年食管癌患者的营养状况可作为评估预后的指标[8-10]。Wang等[8]入组52例>70岁接受根治性放疗的食管鳞癌患者,以手术前GNRI评分92、98分为界, 将患者分为3组,生存分析GNRI评分为影响高龄食管癌患者OS及PFS的独立预后因素,评分正常的患者预后最佳。Bo等[9]将239例年龄≥60岁接受根治性放疗的食管癌患者按照放疗前GNRI评分92、98分为界值分为3组,生存分析示营养不良为影响高龄食管癌患者生存的独立危险因素。相比GNRI评分>98分组患者,92~98分组和<92分组患者的死亡风险分别升高了68.8%和169.9%。不同于以上两项研究,本研究入组患者年龄≥75岁,且分别收集了患者放疗前、后的GNRI评分,生存分析发现放疗后GNRI评分是影响患者OS、PFS的独立因素,相比GNRI评分>98分组患者,≤98分组患者OS的死亡风险升高了47.7%、PFS的进展风险升高了68.6%。GNRI由血清白蛋白和体重构成,其中血清白蛋白半衰期约为21 d,故该指标客观且相对稳定。既往研究发现,GNRI评分和食管癌患者机体的免疫功能呈正相关,放疗后免疫功能正常的患者拥有更好的近期疗效和预后[11-12]。本研究同样发现放疗后GNRI评分正常的患者较评分下降的患者拥有更好的近期疗效。故认为放疗后GNRI评分可以更准确地反映老年食管癌患者放疗后的免疫功能状态,更好地指导预后。
BMI是临床上常用的营养评估指标,研究发现其对食管癌患者的预后也有一定的指导作用[10, 13]。Gu等[13]研究615例食管癌患者的BMI与预后关系发现,该指标可较好地预测食管癌患者的生存预后。BMI处于超重或肥胖患者的生存预后明显优于BMI处于低体重或正常体重的患者。本研究单因素预后分析示放疗后BMI为生存预后的显著相关因素,但多因素分析显示该指标并非影响预后的独立因素。故认为GNRI在高龄食管癌患者中作为预后的预测指标可能更具优势。
近期有研究发现,外周血LNR作为预测食管癌患者预后的指标可有效弥补TNM分期在指导预后方面的不足,具有较好的临床价值[11, 14]。本研究显示,该指标在老年食管癌患者中同样具有指导预后的意义。研究发现放疗前LNR处于低水平的患者具有更好的生存预后,究其原因可能肿瘤微环境中相关炎性因子诱导肿瘤相关中性粒细胞增多,而机体中以细胞免疫为主的淋巴细胞因抑制而减少,导致肿瘤细胞增殖而影响预后[15]。血红蛋白是评价患者是否存在贫血的重要指标,也是临床上针对恶性肿瘤患者尤其是消化道肿瘤患者常用的监测指标。本研究发现放疗后血红蛋白水平正常组患者拥有更好的近期疗效及生存预后。考虑一方面血红蛋白使正常患者具有更好的营养状况,另一方面血红蛋白的主要作用是为机体运输氧气,可改善肿瘤组织乏氧状态,增加放疗敏感性,提高放疗疗效,进而将近期疗效转化为生存获益。
综上,对于老年食管癌患者可以将的营养指标GNRI与临床病理因素共同作为评估预后的指标。在临床治疗过程中,对GNRI评分风险较高的老年患者可积极进行营养干预,防止严重营养不良情况出现,进而改善患者的生存预后。
利益冲突 无
作者贡献声明 宋春洋负责整理数据、统计分析及论文撰写;祝淑钗负责研究设计和论文修改;高丝娜、王旋、曹瀚负责统计分析;赵彦、许金蕊、李曙光负责收集整理病历资料;沈文斌协助修改论文
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Faiz Z, Lemmens VE, Siersema PD, et al. Increased resection rates and survival among patients aged 75 years and older with esophageal cancer:a Dutch nationwide population-based study[J]. World J Surg, 2012, 36(12): 2872-2878. DOI:10.1007/s00268-012-1762-2 |
| [3] |
Vlacich G, Samson PP, Perkins SM, et al. Treatment utilization and outcomes in elderly patients with locally advanced esophageal carcinoma:a review of the National Cancer Database[J]. Cancer Med, 2017, 6(12): 2886-2896. DOI:10.1002/cam4.1250 |
| [4] |
Sorensen J, Kondrup J, Prokopowicz J, et al. EuroOOPS:an international, multicentre study to implement nutritional risk screening and evaluate clinical outcome[J]. Clin Nutr, 2008, 27(3): 340-349. DOI:10.1016/j.clnu.2008.03.012 |
| [5] |
Norman K, Pichard C, Lochs H, et al. Prognostic impact of disease-related malnutrition[J]. Clin Nutr, 2008, 27(1): 5-15. DOI:10.1016/j.clnu.2007.10.007 |
| [6] |
Bouillanne O, Morineau G, Dupont C, et al. Geriatric nutritional risk index:a new index for evaluating at risk elderly medical patients[J]. Am J Clin Nutr, 2005, 82(4): 777-783. DOI:10.1093/ajcn/82.4.777 |
| [7] |
Zhang H, Shang X, Ren P, et al. The predictive value of a preoperative systemic immune-inflammation index and prognostic nutritional index in patients with esophageal squamous cell carcinoma[J]. J Cell Physiol, 2019, 234(2): 1794-1802. DOI:10.1002/jcp.27052 |
| [8] |
Wang Y, Wang L, Fang M, et al. Prognostic value of the geriatric nutritional risk index in patients exceeding 70 years old with esophageal squamous cell carcinoma[J]. Nutr Cancer, 2020, 72(4): 620-626. DOI:10.1080/01635581.2019.1650189 |
| [9] |
Bo Y, Wang K, Liu Y, et al. The geriatric nutritional risk index predicts survival in elderly esophageal squamous cell carcinoma patients with radiotherapy[J]. PLoS One, 2016, 11(5): e0155903. DOI:10.1371/journal.pone.0155903 |
| [10] |
苗晓慧, 尚晓滨, 张洪典, 等. 老年营养风险指数对食管鳞癌患者根治性切除术后生存的影响[J]. 中国肿瘤临床, 2019, 46(6): 293-298. Miao XH, Shang XB, Zhang HD, et al. Effect of the preoperative Geriatric Nutritional Risk Index on the prognosis of patients with esophageal squamous cell carcinoma after radical resection[J]. Chin J Clin Oncol, 2019, 46(6): 293-298. DOI:10.3969/j.issn.1000-8179.2019.06.163 |
| [11] |
Kubo N, Sakurai K, Tamura T, et al. The impact of geriatric nutritional risk index on surgical outcomes after esophagectomy in patients with esophageal cancer[J]. Esophagus, 2019, 16(2): 147-154. DOI:10.1007/s10388-018-0644-6 |
| [12] |
宋春洋, 祝淑钗, 沈文斌, 等. 临床Ⅲ期食管癌患者放疗前后免疫功能及外周血炎症指标对预后的影响分析[J]. 中华放射医学与防护杂志, 2020, 40(3): 189-195. Song CY, Zhu SC, Shen WB, et al. Analysis of the effects of immunity index and blood inflammatory markers pre- and post-radiotherapy on prognosis of clinical stage Ⅲ esophageal cancer patients[J]. Chin J Radiol Med Prot, 2020, 40(3): 189-195. DOI:10.3760/cma.j.issn.0254-5098.2020.03.006 |
| [13] |
Gu WS, Fang WZ, Liu CY, et al. Prognostic significance of combined pretreatment body mass index (BMI) and BMI loss in patients with esophageal cancer[J]. Cancer Manag Res, 2019, 11: 3029-3041. DOI:10.2147/CMAR.S197820 |
| [14] |
Duan H, Zhang X, Wang FX, et al. Prognostic role of neutrophil-lymphocyte ratio in operable esophageal squamous cell carcinoma[J]. World J Gastroenterol, 2015, 21(18): 5591-5597. DOI:10.3748/wjg.v21.i18.5591 |
| [15] |
Nowarski R, Gagliani N, Huber S, et al. Innate immune cells in inflammation and cancer[J]. Cancer Immunol Res, 2013, 1(2): 77-84. DOI:10.1158/2326-6066.CIR-13-0081 |
 2020, Vol. 40
2020, Vol. 40


